体系热力学平衡分析
2020-06-10任晋
任 晋
(中国有色金属建设股份有限公司,北京 100029)

1 L-谷氨酸钠浸出碳酸钙、碳酸镁的离子反应平衡
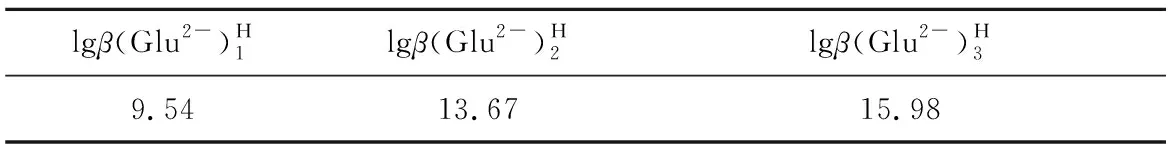
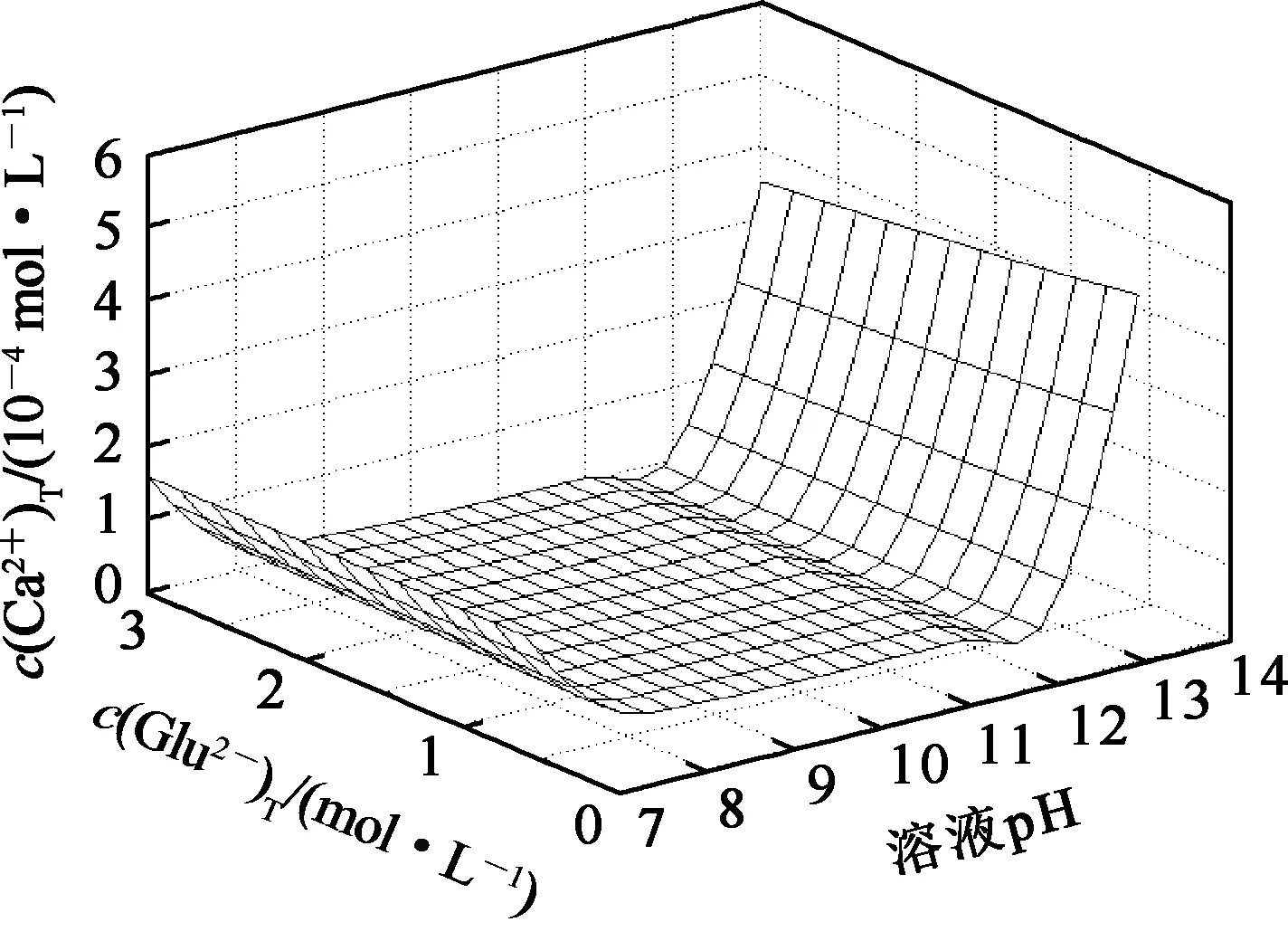
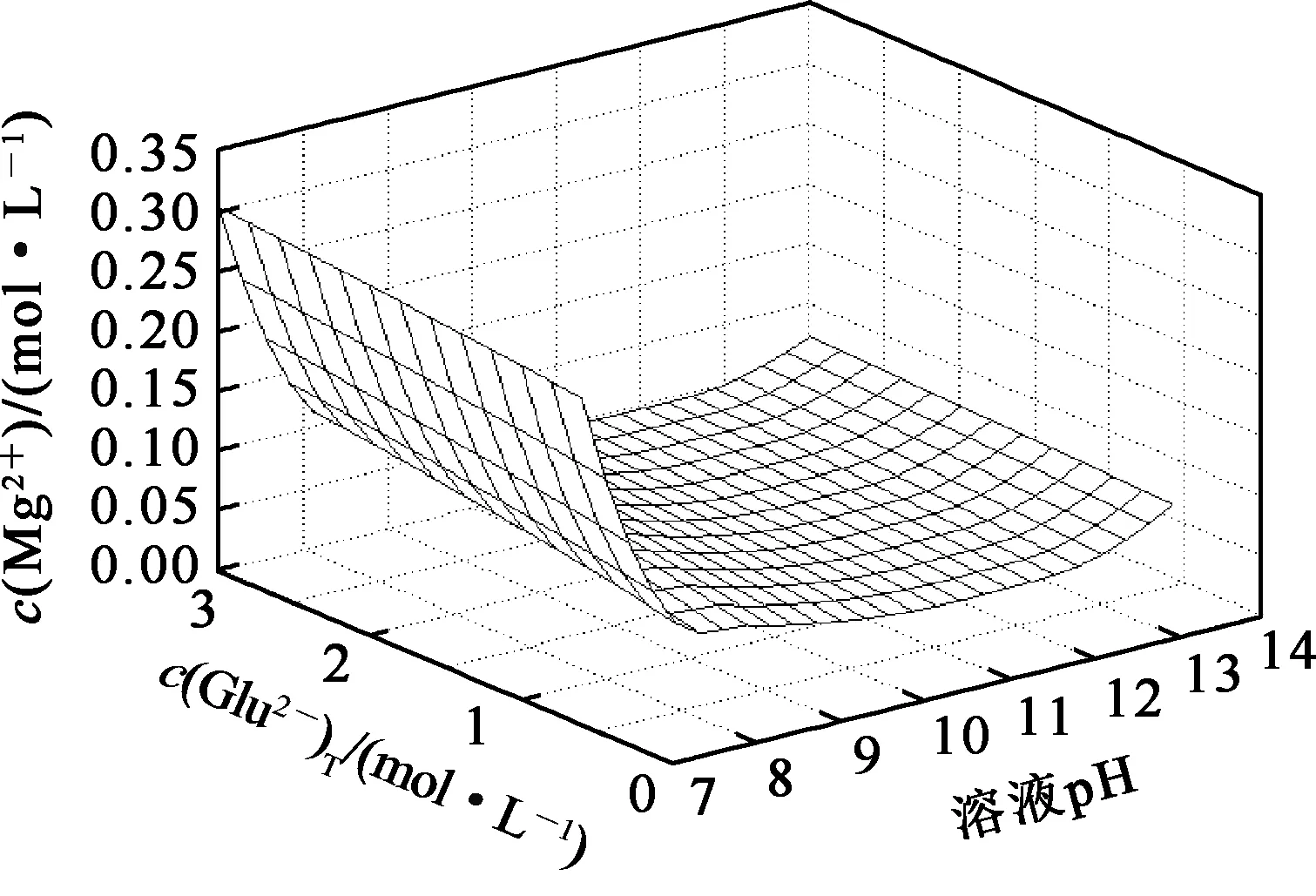
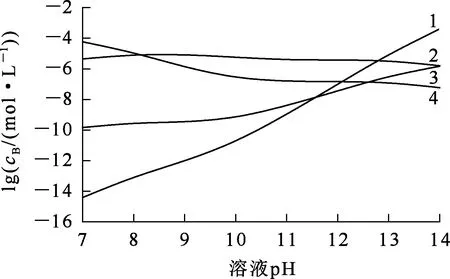
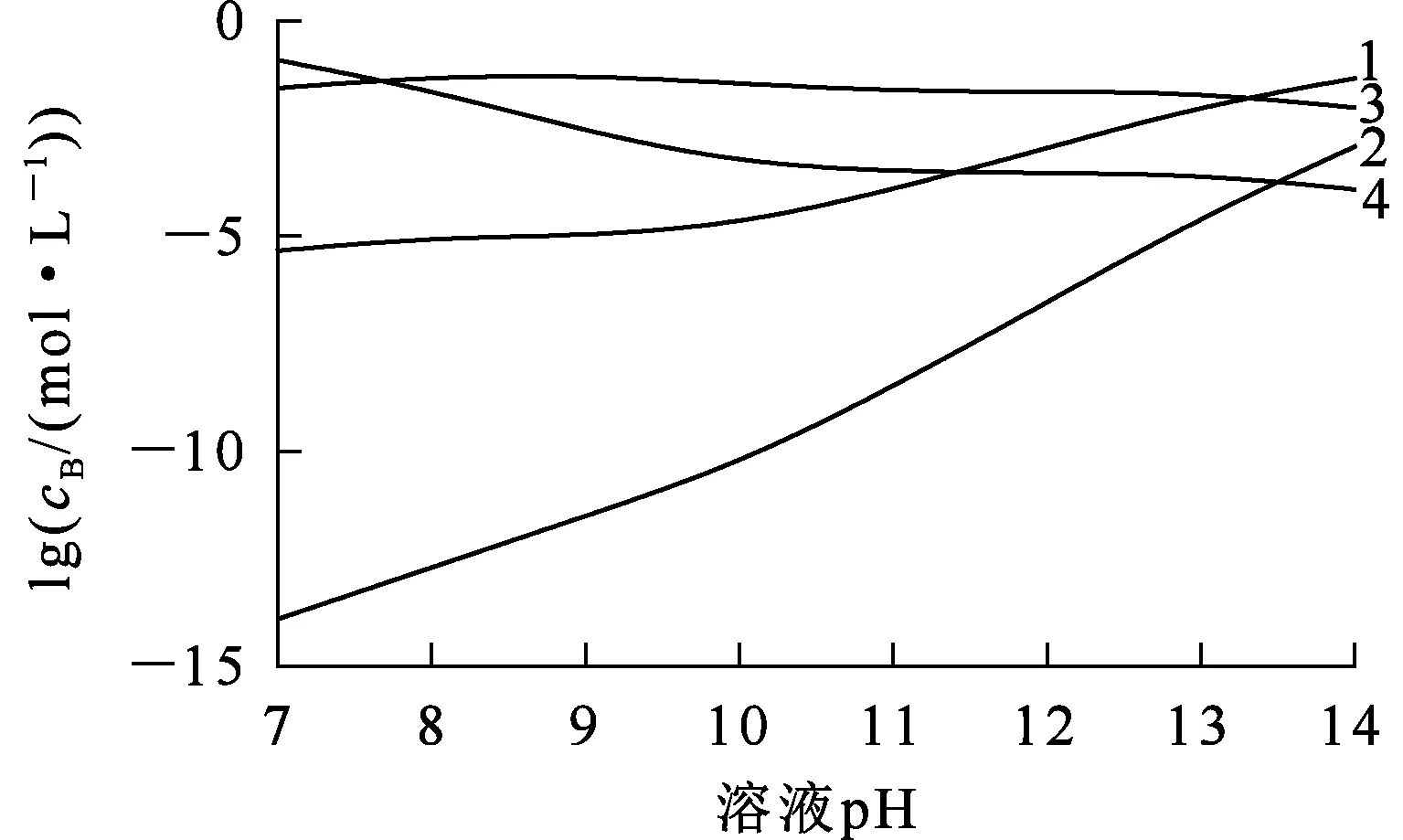
在L-谷氨酸钠浓度0~3 mol/L、7 (Ⅰ) (Ⅱ) CaCO3的溶度积 (1) MgCO3的溶度积 (2) 298 K条件下,Ksp(CaCO3)、Ksp(MgCO3)[11]见表1。 表1 CaCO3、MgCO3的溶度积 溶液中,Ca2+、Mg2+与Glu2-会发生配位反应,生成CaGlu和MgGlu,反应可表示为: (Ⅲ) (Ⅳ) CaGlu、MgGlu配合物的累积生成反应[12]平衡常数β1、β1′分别为: 298 K条件下,CaGlu、MgGlu配合物的累积生成反应平衡常数的常用对数见表2。 表2 CaGlu、MgGlu配合物的累积生成反应平衡常数的常用对数 溶液中,Ca2+、Mg2+与OH-会发生配位反应,生成Ca(OH)+、Ca(OH)2(aq)、Mg(OH)+、Mg(OH)2(aq),反应可表示为: (Ⅴ) (Ⅵ) 表的累积生成反应平衡常数的常用对数 溶液中,Glu2-与H+发生配位反应,生成HGlu-、H2Glu、H3Glu+,反应可表示为 (Ⅶ) Glu2-与H+的加质子平衡常数为 298 K条件下,Glu2-的加质子平衡常数的常用对数[12]见表4。 表4 Glu2-的加质子平衡常数的常用对数 (Ⅷ) 表加质子平衡常数的常用对数 (3) (4) (5) (6) (7) 图随c(Glu2-)T和溶液pH变化的平衡曲面 溶液中,总钙、总镁浓度随c(Glu2-)T和溶液pH变化的平衡曲面分别如图2、3所示。可以看出,当7 图2 c(Ca2+)T随c(Glu2-)T和pH的变化的平衡曲面 图3 c(Mg2+)T随c(Glu2-)T和溶液pH的变化的平衡曲面 当c(Glu2-)=0.5 mol/L时,溶液中钙、镁各配合物浓度与溶液pH之间的关系如图4、5所示。 1—c(Ca(OH)2(aq));2—c(CaGlu);3—c(Ca(OH)+);4—c(Ca2+)。 1—c(Mg(OH)+);2—c(Mg(OH)2(aq));3—c(MgGlu);4—c(Mg2+)。 由图4、5看出:在一定浓度L-谷氨酸钠溶液中,c(Ca(OH)2(aq))、c(Ca(OH)+)、c(Mg(OH)2(aq))、c(Mg(OH)+)均随pH增大而提高,c(CaGlu)、c(Ca2+)、c(MgGlu)、c(Mg2+)随pH增大而降低;pH>12时,溶液中钙物种主要为Ca(OH)2(aq)、Mg(OH)+。1.1 碳酸钙、碳酸镁的溶解平衡


1.2 Ca2+、Mg2+与Glu2-的配位反应



1.3 Ca2+、Mg2+与OH-的配位反应
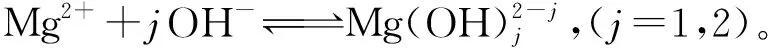
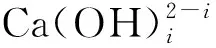
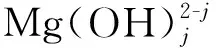
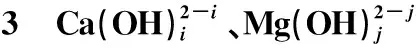
1.4 Glu2-与H+的加质子平衡

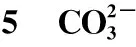
2 溶解反应平衡方程
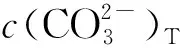
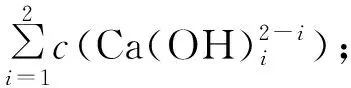

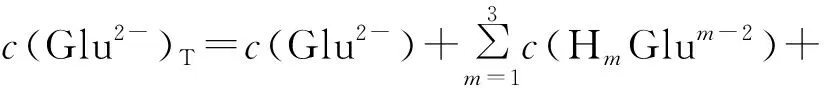
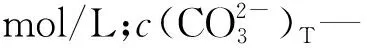


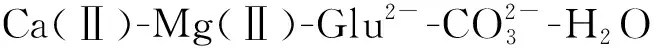
3 试验结果与讨论
3.1 溶液中碳酸根各配合物浓度的变化

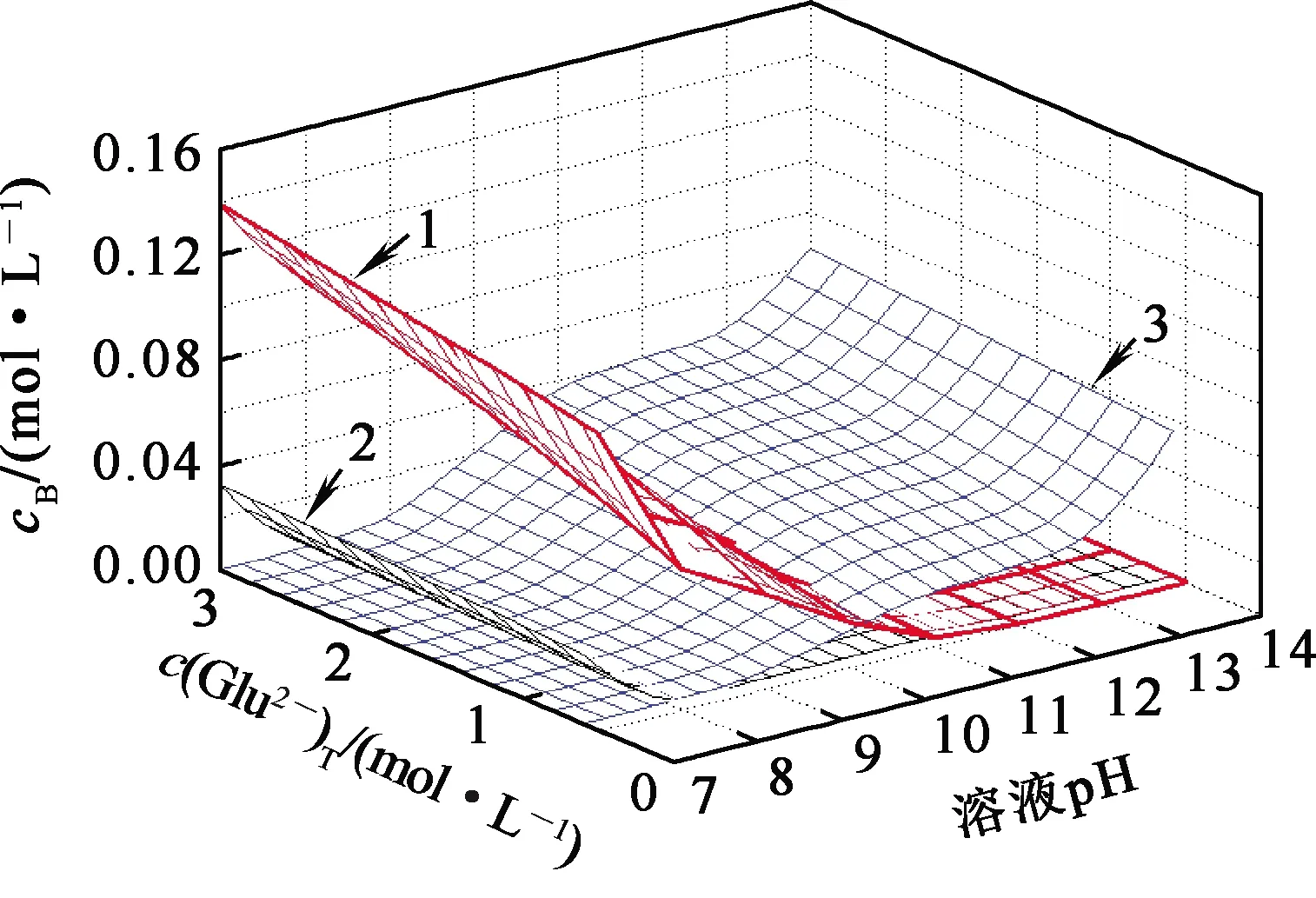
3.2 Glu2-浓度和溶液pH对总钙、总镁浓度的影响
3.3 溶液pH对钙、镁各配合物浓度的影响
4 结论