松油烯-4-醇干预KLF4信号改善高糖诱导VSMCs氧化应激损伤的实验研究
2020-06-10杨彩琴付凌云蒋朝晖王惠林沈祥春徐旖旎张彦燕
何 丽,黄 梅,杨彩琴,陈 娜,付凌云,蒋朝晖,3,王惠林,沈祥春,徐旖旎,张彦燕
(贵州医科大学1. 药学院临床药学教研室,2.天然药物资源优效利用重点实验室,贵州 贵阳 550025;3.贵州省第一人民医院,贵州 贵阳 550002;4.贵州中医药大学第一附属医院,贵州 贵阳 550001)
平,蛋白免疫印迹法检测KLF4、Nrf2和HO-1的表达水平。进一步采用siRNA技术实现KLF4的敲低表达,检测细胞活力、ROS水平,及其对Nrf2、HO-1蛋白表达的影响。结果松油烯-4-醇能够抑制高糖诱导的VSMCs异常增殖,降低ROS水平,下调高糖诱导VSMCs中KLF4的表达,并上调抗氧化信号Nrf2、HO-1的表达。进一步研究表明,siKLF4转染组明显下调KLF4表达,抑制VSMCs增殖,降低细胞内ROS水平,并上调Nrf2、HO-1的表达水平。结论松油烯-4-醇对高糖诱导的VSMCs氧化应激损伤具有保护作用,其机制与其抑制核转录因子KLF4的表达,上调Nrf2/HO-1抗氧化信号轴有关。
血管平滑肌细胞(vascular smooth muscle cells,VSMCs)为血管中膜的主要细胞成分,在各种血管功能损伤中扮演着重要作用[1]。活性氧物质(reactive oxygenic species,ROS)生成和清除机制的失衡诱导细胞氧化应激损伤,为VSMCs结构和功能异常的重要病理过程[2-3]。研究表明,在氧化应激条件下,VSMCs可通过调节核因子E2相关因子2/血红素加氧酶-1(nuclear factor erythroid-2-related actor 2/Heme oxygenase 1,Nrf2/HO-1)信号轴调控ROS诱导的氧化应激损伤[4-5]。因此,积极寻找靶向调控VSMCs氧化应激损伤的创新药物,分析其分子信号机制能够为临床防治血管疾病提供新的治疗靶点和策略。
松油烯-4-醇(terpinen-4-ol,T4O)为多数植物精油所含的单萜类成分。目前对其药理活性研究主要集中于抗炎、抗肿瘤、抗菌等研究领域[6-7],对血管平滑肌细胞的药理学研究尚未见报道。KLF4(krüpple-like factor 4,KLF4)是具有锌指结构的核转录因子,在细胞的增殖和分化中发挥重要作用[8-9]。本研究分析T4O对高糖诱导的VSMCs氧化应激损伤的保护作用,并基于KLF4信号进一步分析其作用机制,以期为临床防治心血管疾病提供新的治疗靶点和实验依据。
1 材料与方法
1.1 细胞株大鼠VSMCs购自美国模式培养物保藏所(American Type Culture Collection,ATCC)细胞库。
1.2 试剂T4O(山东西亚化学工业有限公司,纯度≥98%,W33427),DMEM(Gibco,8118374),Nrf2多克隆抗体(proteinthch,16396-1-AP),HO-1多克隆抗体(proteinthch公司,00071512),KLF4 单克隆抗体(Cell Signaling Technology,12173S),DMSO(Sigma公司,RNBF1060),四甲基偶氮唑蓝(索莱宝,804W059),活性氧检测试剂盒(Beyotime,S0033-1),Lipofectamine 2000 Reagent(美国Invitrogen公司,2004957),siRNA(上海吉玛基因科技有限公司,KLF4 siRNA正义:5′-GGACUUUAUUCUCUCCAAUTT-3′,反义:5′-AUUGGAGAGAAUAAAGUCCTT-3′。对照siRNA正义:5′-UUCUCCGAACGUGUCACGUTT-3′,反义:5′-ACGUGACACGUUCGGAGAATT-3′)。
1.3 药物配制精密吸取T4O溶液(纯度为98%)100 μL,溶于900 μL DMSO中,配成浓度为6×105μmol·L-1的母液,过滤除菌,-20℃保存。用时以DMEM培养基稀释至不同工作浓度(DMSO浓度≤0.015‰)。
1.4 细胞培养及分组将复苏的VSMC细胞转入含10%胎牛血清、1%双抗、100 μg·L-1FGF细胞因子的DMEM培养基,置于37 ℃、5% CO2、饱和湿度的培养箱中。根据实验目的,实验分为两个部分,第一部分实验分为5个组:正常对照组(Control,5.5 mmol·L-1葡萄糖)、模型组(Model,24.5 mmol·L-1葡萄糖)、T4O低剂量组(24.5 mmol·L-1葡萄糖+2.5 μmol·L-1T4O)、T4O中剂量组(24.5 mmol·L-1葡萄糖+5 μmol·L-1T4O)、T4O高剂量组(24.5 mmol·L-1葡萄糖+10 μmol·L-1T4O)。各给药组预处理2 h后,加入高糖共同孵育24 h建立VSMCs氧化应激损伤模型。第二部分实验分为4个组:正常对照组(Control,5.5 mmol·L-1葡萄糖)、模型组(Model,24.5 mmol·L-1葡萄糖)、siKLF4组(24.5 mmol·L-1葡萄糖+siKLF4)、siKLF4+T4O共给药组(siKLF4+24.5 mmol·L-1葡萄糖+10 μmol·L-1T4O)。VSMCs接种于六孔板,待细胞生长密度为40%~50%时进行转染。转染组采用Lipofectamine 2000配制siRNA-lipofectamin复合物,VSMCs转染6 h之后正常培养12 h,依据各实验分组处理细胞。
1.5 MTT法测VSMC细胞活力将细胞以每毫升2×104个的密度接种于96孔板,采用MTT法检测细胞活力。在本实验中增加溶剂对照组(vechile,DMSO含量为0.015‰),分析其对细胞存活率的影响。每组设6个平行孔,实验重复3次。计算公式:细胞存活率/%=给药组OD值/正常组OD值×100%。
1.6 DCFA-DA荧光探针检测VSMC细胞ROS水平将VSMCs接种于6孔板中,各组分别按1.4项下第一部分及第二部分实验分组处理24 h后,加入10 μmol·L-1的DCFA-DA荧光探针继续培养30 min,无血清DMEM洗涤细胞2~3次,于倒置显微镜下观察并拍照。
1.7 Western blot检测分别收集各处理组的细胞,加入细胞裂解液(PMSF ∶ RIPA=1 ∶ 99)提取总蛋白,定量分装后上样。经十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳后,湿转至PVDF膜,5%脱脂牛奶室温封闭。加入一抗4 ℃孵育过夜,洗涤后加入二抗(1 ∶ 10 000)室温孵育2 h。1×TBST洗膜3次,采用增强型化学发光液暗室显影。
1.8 KLF4 siRNA干扰实验VSMCs接种于六孔板,待细胞生长密度为40%~50%时按1.4项下第二部分实验分组处理细胞,提取收集各处理组蛋白,检测KLF4、Nrf2和HO-1蛋白表达。
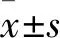
2 结果
2.1 T4O抑制高糖诱导的VSMC细胞增殖MTT结果表明,给予高糖诱导24 h后促进细胞增殖(P<0.01)。给予不同剂量的T4O预孵育2 h后,能够抑制高糖诱导的VSMCs增殖,且呈浓度依赖性。如Fig 1所示。

Fig 1 Inhibitory effect of terpinen-4-ol on proliferation of VSMCs induced by
Vehicle(0.015‰ DMSO),**P<0.01vsControl group;#P<0.05,##P<0.01vsModel group
2.2 T4O对细胞内ROS生成的影响采用DCFH-DA探针检测VSMC细胞内ROS水平。结果表明,高糖诱导VSMC细胞内ROS水平增加,而T4O不同剂量组均能够不同程度降低细胞内ROS水平,如Fig 2所示。
2.3 T4O对KLF4及Nrf2/HO-1信号蛋白表达的影响已有研究表明, KLF4表达与VSMCs的增殖密切相关,故本研究分析了T4O对高糖诱导的VSMCs中KLF4表达的影响。结果表明,模型组与正常组比较,KLF4蛋白水平明显上调(P<0.05),Nrf2和HO-1的表达明显下调(P<0.05)。与高糖组比较,给予不同剂量的T4O干预后可明显下调KLF4蛋白表达水平(P<0.01),上调Nrf2、HO-1的蛋白表达(P<0.05),如Fig 3所示。
2.4 siKLF4对VSMC细胞存活率及细胞内ROS水平的影响MTT结果显示,转染siKLF4能够抑制高糖诱导的VSMCs增殖(P<0.01),如Fig 4A所示。同时,采用DCFH-DA探针检测VSMCs内ROS水平,siKLF4转染组能够降低细胞内ROS水平,如Fig 4B所示。以上结果表明,T4O可能通过抑制KLF4信号,降低高糖诱导的平滑肌细胞氧化应激损伤。
2.5 siKLF4对Nrf2/HO-1信号及KLF4蛋白表达的影响Western blot结果表明,与Control组比较,siKLF4组KLF4蛋白表达明显下调(P<0.01),敲低效率为52%,证明转染成功,如Fig 5A所示。siKLF4转染组及siKLF4+T4O共给药组均能明显上调Nrf2、HO-1表达水平(P<0.05),组间比较差异无统计学意义,如Fig 5B所示。结果表明T4O能够通过抑制KLF4信号,上调Nrf2/HO-1信号轴的活性,改善高糖诱导的平滑肌细胞氧化应激损伤,即表明T4O主要作用机制与KLF4信号相关,且KLF4为Nrf2/HO-1信号轴的上游调控分子。
3 讨论
VSMC细胞异常增殖是血管重构的关键环节。研究表明,高糖可诱导VSMCs的增殖,介导动脉壁增厚和管腔狭窄,为血管损伤性重构的重要病理过程[10-11]。高糖损伤因素诱导ROS生成和氧化应激损伤,细胞内活性氧蓄积致氧化与抗氧化之间的平衡被打破,在超过抗氧化防御系统对其消除能力时,过多的氧自由基会直接或间接引起生物膜脂过氧化,从而导致组织的损伤[12]。Nrf2/HO-1信号轴是抗氧化应激反应中不可或缺的信号通路,其中Nrf2是协调抗氧化应激反应重要的转录因子,可以有效清除ROS[13]。KLF4作为调控VSMCs增殖与分化的强有力调节因子,研究表明,上调KLF4的表达可促进VSMCs增殖,而降低KLF4的表达则可抑制VSMCs增殖[14-15]。因此,本研究探寻高糖诱导的平滑肌细胞增殖及氧化应激损伤与核转录因子KLF4信号的相关性,并进一步分析KLF4信号是否能够调控Nrf2/HO-1信号轴,从而抑制平滑肌细胞氧化应激损伤。
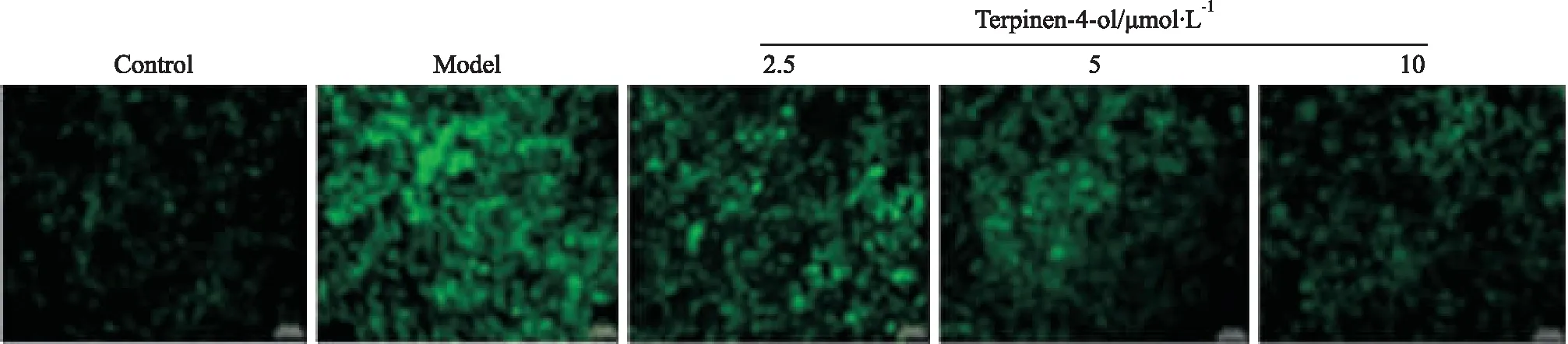
Fig 2 Terpinen-4-ol decreased ROS level in VSMCs induced by HG(×200)

Fig 3 Effect of terpinen-4-ol on KLF4 and Nrf2/HO-1 signal proteins of VSMCs induced by HG
*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsModel group

A: Cell survival rate by MTT assay; B: Effect of KLF4 knockdown on ROS levels in HG-induced VSMCs.*P<0.05vscontrol group;##P<0.01vsHG group

Fig 5 Effect of KLF4 siRNA on expression of Nrf2 and HO-1 protein after high glucose injury in VSMCs
A:Down-regulation of KLF4 after transfection of siKLF4 in VSMCs; B: KLF4 and Nrf2/HO-1 were detected by Western blot and normalized to GAPDH expression.**P<0.01vscontrol group;#P<0.05,##P<0.01vsHG group
筛选有效的天然活性物质一直是防治心血管疾病的研究热点。T4O是从芳香植物精油中提取的单体化合物,目前T4O的血管药理学研究报道尽显稀缺。因此,本研究以氧化应激损伤为切入点,分析T4O对高糖诱导VSMCs异常增殖及抗氧化能力的作用,对寻找具有自主知识产权的创新药物具有重要意义。本研究表明,高糖孵育VSMCs细胞24 h诱导其增殖能力明显增强,ROS水平明显升高。而T4O低、中、高剂量组预处理可不同程度抑制VSMCs细胞的异常增殖,降低ROS的表达水平。蛋白免疫印迹结果进一步表明,T4O可下调高糖诱导VSMCs的KLF4蛋白水平,并上调Nrf2和HO-1抗氧化信号的水平。上述实验提示,转录因子KLF4信号可能为T4O抑制高糖诱导的氧化应激损伤的潜在靶点,其机制可能与调控Nrf2/HO-1抗氧化信号轴有关。为了进一步分析KLF4信号与Nrf2/HO-1信号轴之间的关系,我们采用siRNA干扰技术实现KLF4的敲低表达, 结果证实T4O主要作用机制与KLF4信号相关,且KLF4为Nrf2/HO-1信号轴的上游调控分子。
本研究发现T4O对高糖诱导的血管平滑肌细胞氧化应激损伤具有保护作用,其调控机制与其抑制转录因子KLF4,上调Nrf2/HO-1抗氧化信号轴的水平有关,但T4O基于KLF4与Nrf2/HO-1信号轴的精密调节机制尚待进一步研究分析。
