关节滑膜炎性微环境对类风湿关节炎发生发展作用的研究进展
2020-06-10戴学静
王 言,吴 虹,邓 然,戴学静,占 翔
(安徽中医药大学药学院,新安医学教育部重点实验室,中药复方安徽省重点实验室,安徽 合肥 230012)
类风湿关节炎(rheumatoid arthritis, RA)是一种常见的、以慢性滑膜炎症为特征的自身免疫性疾病,其病理特征表现为滑膜组织异常炎性增生、血管新生、血管翳形成、关节软骨和骨的不可逆性破坏,甚至引发畸形病变以及严重的并发症[1]。目前为止,全世界约有1%-2%的人口深受RA疾病的困扰,严重影响人们的健康与生活质量。然而,RA致病机制尚未完全明确,但是已经有研究表明关节滑膜微环境与RA的发病过程紧密相关。近年来,大量研究表明血管翳的形成可能是RA的潜在发病机制,此特点同恶性肿瘤中血管增生极为相似。RA患者关节滑膜微环境中常常显示关节腔缺氧和众多炎性因子浸润等[2]。因此,全面阐明RA与关节滑膜炎性微环境之间的具体联系有助于拓展对RA更加深入的认识。
1 RA炎性微环境
Schofield在1978年第一次提出了“微环境”的概念,其主要是由各种细胞、细胞外部基质营养成分和生长因子等因素共同构成的一种动态生长环境,有利于细胞的正常存活[3]。在生理状态下,微环境对滑膜细胞起保护作用;在病理状态下,微环境发送各种应激信号,引起关节滑膜周围细胞的各种应激反应。炎症反应是机体组织受损时最常见的应激反应,也是RA的主要病理表现之一。巨噬细胞、成纤维样滑膜细胞(fibroblast synoviocytes,FLS)以及血管内皮细胞(vascular endothelial cells,VECs)等共同组成了RA关节滑膜炎性微环境的细胞成员。这些细胞相互影响,相互作用,通过机体产生大量的基质细胞衍生因子、促炎细胞因子、促血管生成细胞因子以及其他多种介质进入关节腔,从而介导RA的病变过程。
2 巨噬细胞
巨噬细胞是一类具有吞噬作用的免疫细胞,其通过分泌基质细胞衍生因子和促炎细胞因子而发挥机体免疫调节作用和介导炎症反应。人体单核细胞作为巨噬细胞主要的来源者,其经过机体血液循环系统而广泛分布于全身组织,并逐渐分化形成巨噬细胞。滑膜组织巨噬细胞是健康滑膜组织的常驻细胞,其细胞不同的表现形式和RA具有相关联系。近来发现,单核细胞衍生的巨噬细胞在慢性疾病模型中占主导地位并驱动炎症,这些巨噬细胞可能决定着慢性疾病或者炎症的发生以及消退[4]。
2.1 RA发病机制与巨噬细胞极化相关在复杂的细胞微环境中,巨噬细胞根据外界所受刺激产生迅速的反应,活化成不同的形态,该过程称为极化。正常滑膜组织巨噬细胞可被关节滑膜炎性微环境中某些细胞因子所极化,极化的巨噬细胞主要包括两种亚型:经典活化型巨噬细胞(classically activated macrophages,CAMs or M1)和替代性活化型巨噬细胞(alternatively activated macrophages,AAMs or M2)。M1拥有很强的自我促炎免疫能力以及抗原呈递能力,对促进机体刺激物的清除和自我免疫功能的调节具有关键作用。M1型巨噬细胞在炎性介质的刺激作用下,使适应性免疫系统倾向于Th1反应;M2型巨噬细胞可能参与炎症的解决,使免疫倾向于Th2反应。这两种功能迥异甚至拮抗的不同极化类型的巨噬细胞分别反映着Th1/Th2免疫应答(Fig 1)。在RA疾病相关研究中已有结果显示,M1/M2比值升高可以打破关节滑膜微环境中的炎性动态平衡[5]。因此,针对M1/M2不平衡的比例,探寻更多的方法将M1型巨噬细胞重新极化成M2型巨噬细胞,可能会成为RA有效的治疗策略。
2.2 信号途径与巨噬细胞的极化相关
2.2.1Notch途径 Notch途径在RA以及其他自身免性疫疾病中扮演一个重要的角色。DAPT作为Notch的抑制剂,能有效的改善RA关节损伤。Notch信号在巨噬细胞中也发挥了重要的促炎作用,如LPS信号刺激活化的巨噬细胞,在炎症状态下伴有Notch信号活化和巨噬细胞极化以及炎症因子产生的现象。Sun[6]发现,滑膜巨噬细胞在炎性微环境下变得异常活跃并且伴有Notch途径的激活和趋向M1型极化的现象。接着也有研究发现,Notch和TLR4信号途径存在交叉串扰,Notch能够有效提高IRF8蛋白的表达,通过激活TLR4途径增强Notch信号转导[7](Fig 2)。当Notch1信号被激活时,能明显促进巨噬细胞在炎症反应中相关炎症介质的释放。因此,以早期激活Notch信号的M1型巨噬细胞为治疗对象,可能会逐渐成为治疗RA和其他多种炎症疾病的一种新的治疗方法和策略。

Fig 1 Role of macrophages in RA
Macrophages derived from synovium of the joint are polarized toward M1 and M2 under the stimulation of different signals in the microenvironment. Polarized macrophages secrete different cytokines and chemokines, which regulate the balance of Th1/Th2 immunity and induce other cells to participate in inflammatory response.
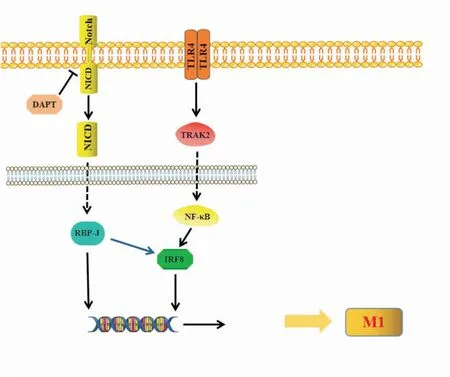
Fig 2 Function of Notch pathway
Activation of Notch signaling promotes RA development. DAPT acts as an inhibitor of Notch, which blocks the Notch pathway and relieves RA symptoms. NICD regulates the expression of Notch target genes(Hes, Hey) by linking to the RBP-J protein. Meanwhile, RBP-J can activate TLR4 pathway by up-regulating IRF8, increase the number of M1, and promote the development of inflammation.
2.2.2MAPKs途径 丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)是一类丝氨酸/苏氨酸蛋白激酶,可通过外部信号激活并诱导下游炎症基因的转录表达[8]。MAPKs家族成员主要有ERK、p38、JNK,并且在RA和其他炎症疾病中高度表达。MAPKs通过自身磷酸化水平进行活性调节,同时伴有相关转录因子(NF-κB)的激活,发挥促炎作用。Tian[9]等人发现,CXCR4在急性肺损伤ALI模型小鼠巨噬细胞中呈现高度表达状态,可能具有调控巨噬细胞的功能,使用siRNA干扰RAW 264.7中CXCR4表达,发现MAPKs和NF-κB通路中关键蛋白的磷酸化水平被显著降低,同时也降低了巨噬细胞相关炎性介质(IL-6和TNF-α)的释放,缓解了炎症损伤。Zhao[10]等人发现,IL-4对氧化型低密度脂蛋白(oxidized low density lipoprotein, ox-LDL)所诱导p-ERK和p-JNK的表达以及CD86/CD206(M1/M2)的比值均具有显著的下调作用,提示IL-4对于MAPKs途径的抑制作用与M2巨噬细胞的极化相关。目前还有新的研究显示,JNK信号通路在调节脂肪性肥胖引起的炎症反应和巨噬细胞极化以及代谢功能障碍的发展过程中均具有重要调控作用。因此,进一步全面了解MAPKs途径与巨噬细胞极化之间的联系,对于早期炎症的控制具有重要作用。
2.2.3JAK/STAT途径 JAK-STAT通路是一类由细胞因子所刺激激活的信号途径,广泛参与机体的各种生理病理过程,尤其在炎症反应中具有重要作用[11]。JAK-STAT途径具有多种信号因子的靶点,主要有IFN-γ、IL-2、IL-4、IL-6、IL-10、IL-12、IL-15、IL-23和GM-SCF等,这些细胞因子被认为在RA炎症反应中具有重要的生物学作用。例如,IL-6可以通过JAK-1、JAK-2、TYK-2激酶激活JAK/STAT途径,其主要是通过影响STAT1和STAT3蛋白表达,发挥基因调控作用[12]。同时有研究表明,JAK/STAT信号转导途径的激活与巨噬细胞的极化过程具有密切关联。IFN-γ作为巨噬细胞最强的免疫激活剂之一,其主要负责激活STAT1,从而有效增强机体免疫调节作用和介导炎症反应以及M1型极化。IL-4作为典型的抗炎细胞因子,其通过与IL-4Rα结合,激活JAK/STAT6途径,从而促进M2型巨噬细胞极化[13]。不同JAK/STAT途径的激活对巨噬细胞的极化具有不同的调控作用,全面深入了解JAK/STAT途径与RA巨噬细胞极化之间的具体联系,可为RA新的药物研制提供有力的理论支撑。
3 FLS
滑膜细胞是一类具有基质重塑作用的关节腔常驻细胞,其通过异常活化介导关节破坏和炎症反应。FLS作为滑膜细胞的主要亚型,是滑液和滑膜基质中关键成分的主要制造者,在维持正常关节平衡中具有重要作用。近来发现,异常激活的FLS在RA中占据主导地位并驱动炎症发生,其可能决定疾病的进程。
3.1 RA发病机制与FLS异常增殖相关滑膜组织异常炎性增生主要是由FLS和巨噬细胞所驱动的结果。FLS作为关节滑膜间充质细胞以及效应细胞,在RA发病中具有重要作用。FLS具有类癌细胞的生长特性,在RA病理状态下FLS可以被促炎因子和其他炎性信号所刺激激活,呈现出细胞增殖异常和凋亡能力不足,同时还伴有大量、多种促炎介质的释放。产生的促炎介质又可以直接或间接作用于FLS自身使其持续活化,两者不间断反复循环,促使滑膜组织异常增生,关节腔出现缺氧现象,加重滑膜炎症不良反应。因此,深入了解FLS增殖异常和凋亡不足的具体机制,可为RA治疗提供新的思路。
3.2 信号途径与FLS的异常增殖相关
3.2.1Wnt/β-catenin途径 Wnt途径广泛参与人体细胞的增殖和分化过程,严重影响机体的多种生理和病理。尽管Wnt途径在RA中研究相对较晚,但是已经有很多证据表明该通路可以通过多种方式广泛作用于RA,并在RA的发生及发展演变过程中发挥主导作用。根据激活方式的不同,Wnt通路主要被划分为4条:① Wnt/β-catenin;② Wnt/c-JNK;③ Wnt/Ca2+;④ Wnt/PCP。目前研究最多、最全面的Wnt途径是Wnt/β-catenin,其主要通过一种细胞因子(Wnt配体)与受体配对结合,形成二聚体形式而得到激活,并通过β-catenin与转录因子形成复合物调控下游基因的表达。
Wnt/β-catenin途径在RA发病的过程中具有双重作用,一方面可以通过调控FLS的异常增殖、影响TNF-α和IL-1等炎性因子的分泌;另一方面也可以调控骨代谢/骨破坏等途径,对骨的形成具有促进作用[14]。有研究表明,Wnt1、Wnt5a、Wnt7在FLS异常增殖的过程中均有较高的表达,通过下调这些配体的表达可以显著抑制FLS的异常增殖。Wnt10在FLS和VEC中均有较高的表达,且与炎性细胞的浸润程度具有相关联系(Fig 3)。Wnt1配体通过激活Wnt/β-catenin途径来调控纤维连接蛋白和基质金属蛋白酶3的生成,从而促进FLS的生存和黏附能力,诱导RA炎症的发生。Wnt3主要在骨形成方面具有重要促进作用,其主要是通过激活经典Wnt途径从而打破成骨细胞和破骨细胞的形成平衡。FLS产生Wnt5a配体,其通过与Frz5结合形成复合物直接或间接作用于FLS自身,导致PKC途径激活,有效加剧RA炎症反应。Wnt7b在RAFLS中被发现存在异常表达,通过体外研究实验发现上调FLS中Wnt7b的表达能够有效促进炎性因子产生,加重RA症状[15]。鉴于Wnt基因在滑膜炎症和成骨细胞分化方面存在不同的作用,只有寻找或者
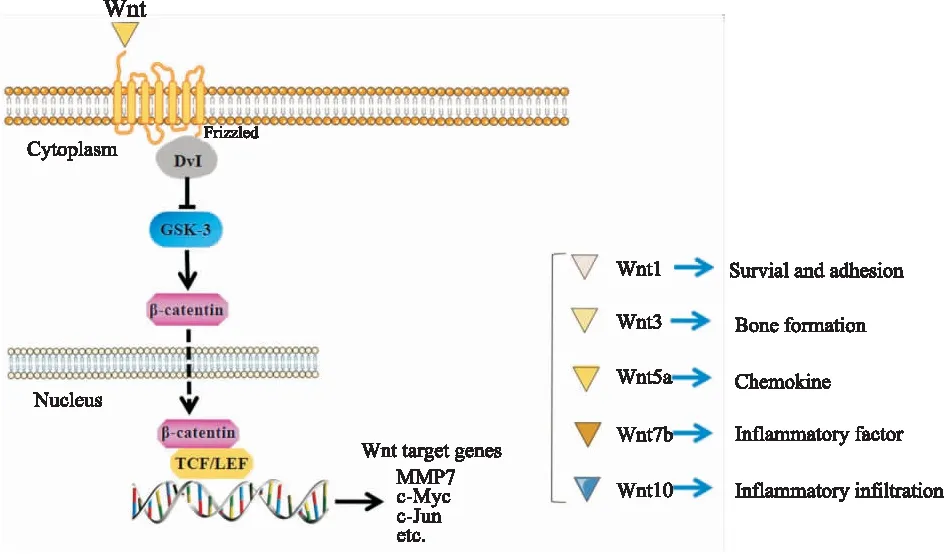
Fig 3 Function of Wnt pathway
Wnt signaling plays a dual role in the pathogenesis of RA. The different ligands of Wnt signaling activate Wnt pathway by binding to the receptor, increase the expression of β-catenin in cytoplasm, and regulate the expression of Wnt target genes(MMP7, c-Myc, c-Jun). The activation of Wnt signal promotes abnormal synovial proliferation and inflammatory factor secretion, and regulates bone metabolism/bone destruction, which can promote bone formation.
设计对FLS异常增殖具有选择性抑制而不影响成骨细胞分化的药物,对RA的治疗才能起到更加显著的效果。
3.2.2P13K/AKT途径 3-磷酸肌醇激酶/蛋白激酶B(phosphoinositide 3-kinase/protein kinase B, PI3K/AKT)途径是目前被认为与细胞凋亡最相关的信号途径之一,其在RA滑膜组织中被发现异常表达,可能对FLS增殖和凋亡的失衡具有重要主导作用。有研究表明,PI3K/AKT途径与RA的发生及其发展过程具有密切关联。TNF-α作为该通路的正向激活调控因子,其通过刺激激活该途径,进一步降低Bax/Bcl-2的比值,抑制FLS凋亡反应。同时也有研究显示,通过PI3K/AKT/mTOR途径可以抑制FLS自噬,从而促进FLS存活,加重RA炎症反应[16]。胰岛素生长因子1受体(insulin like growth factor 1 receptor, IGF-1R)作为该途径的另外一个正向调控因子,其具有促进细胞生长和增殖的作用。Chen[17]等人阐明了RA患者FLS中IGF-IR/PI3K/AKT/m-TOR信号通路的异常活化对于FLS异常增殖的可能具体机制,并通过下调IGF-1的表达水平,抑制该通路的活化,结果发现FLS的G2/M细胞周期受到阻滞,导致FLS增殖受到抑制。到目前为止,对于PI3K/AKT途径与FLS异常增殖的机制仍然需要进一步深入全面了解,从而为RA的治疗提供新的理论基础。
4 VEC
内皮细胞也称VEC,是一类覆盖血管内膜表面的连续单层扁平或多角形的细胞,其通过异常增殖和迁移介导血管新生。作为血管壁与血液之间的分界细胞,是新生血管形成的形态基础,在维持血管的功能中发挥重要作用。近来发现,VEC既是感应细胞又是效应细胞,其不仅能感知血液中的炎性信号、激素水平和压力等信息,而且能通过分泌多种血管活性物质对这些信息做出反应。
4.1 RA发病机制与VEC增殖和迁移相关血管新生是目前治疗RA的主要假说机制之一,其既是引起血-关节腔屏障的间质通透性加大的原因,又是RA血管翳产生和维持的重要标志[18]。在RA中,关节滑膜处存在着大量微血管的新生。VEC作为血管结构的主要构成细胞,其增殖和迁移功能的改变对于新血管的形成都具有重要调控作用。就RA来说,血管新生是由促进血管新生和抑制血管新生两类不同的介质共同调控的过程。因此,进一步了解血管新生的调控机制,干预VEC,抑制RA血管新生是治疗RA新的方向。
4.2 信号途径与VEC增殖和迁移相关
4.2.1VEGF/VEGFR-2途径 血管内皮生长因子(vascular endothelial growth factor,VEGF)与其受体(vascular endothelial growth factor receptor,VEGFR)组成的信号途径被普遍认为是RA血管新生的中央调控系统。VEGF对RA血管新生具有显著的刺激作用,其表达含量可被用来衡量疾病的严重程度。而主要表达在VEC细胞膜上的VEGFR-2则被认为是促进细胞增殖、迁移、血管新生以及改变血管渗透性的关键媒介。VEGF/VEGFR-2是一条对机体血管新生整个过程都具有正向调控作用的途径,其特点可以通过串联反应过程活化下游所介导的其他信号途径(p38、ERK、PI3K/AKT)从而诱导VEC增殖、迁移,调控机体血管新生[19]。目前也有研究表明,VEGF/VEGFR-2途径和Dll4/Notch途径在RA血管新生过程中存在一定的相关联系(Fig 4)。VEC在低氧的环境下容易受到VEGF的强烈刺激,一方面通过激活VEGFR-2受体可以促进血管生成;另一方面VEGF也可以通过调控Notch配体Dll4的信号表达,激活Dll4/Notch信号转导通路从而减弱血管生成。从而揭示了VEGF对Dll4具有正向调控作用,而Dll4对VEGF具有负向调节作用[20]。因此,RA滑膜血管新生并不是一个简单的过程,而是在VEGF/VEGFR-2和Dll4/Notch以及其它相关信号途径之间相互协调共同完成的过程。

Fig 4 Correlation between VEGF/VEGFR-2 and Dll/Notch pathways
VEGF has a significant stimulating effect on RA angiogenesis. Activation of the VEGF/VEGFR-2 pathway stimulates downstream signaling pathways(p38, ERK, PI3K/AKT) to promote VEC proliferation, migration, and regulate angiogenesis. However, VEGF also has a positive regulatory effect on Dll4. The activation of Dll/Notch pathway can inhibit the proliferation and migration of VEC. Finally, the VEGF/VEGFR-2 and Dll/Notch pathways interact with each other to regulate RA angiogenesis.
4.2.2Ang/Tie2途径 血管生成素(angiopoietin,Ang)和酪氨酸激酶受体2(angiopoietin-tyrosine kinase receptor 2,Tie2)组成的途径对毛细血管的成熟和维持功能的稳定具有重要作用[21]。目前了解较多的是Ang1和Ang2,Ang1主要是由周细胞产生,其通过旁分泌的方式传递并作用于VEC胞膜上的Tie2,促进连接蛋白的连接,降低血管通透性;而Ang2是由VEC分泌产生,其通过与Ang1竞争性结合到Tie2,促进连接蛋白连接的解离,提高局部血管的通透性并促进血管新生[22]。同时也有研究显示,在缺氧状态下VEGF与Ang2存在紧密联系。当VEGF存在时,Ang2可以促进VEC的增殖和迁移,从而促进血管的新生;当VEGF表达受到抑制时,Ang2可以引起VEC的死亡,以及血管退化。因此,深入了解HIF-VEGF-Ang信号轴参与RA血管新生的调控机制,对于RA疾病的防治具有重要的作用。
5 炎症细胞因子
关节滑膜炎性浸润是RA疾病的主要特征表现之一,其主要是由微环境中细胞因子信号网络紊乱所造成的结果,对巨噬细胞的极化、FLS的异常增殖、VEC的血管新生等过程都具有重要影响作用。RA中较典型的炎症因子主要有:TNF-α、IL-6、VEGF、GM-CSF等。TNF-α主要来源于滑膜巨噬细胞和FLS,其通过与TNFR1结合直接激活下游的MAPK和NF-κB信号转导通路,促进众多炎症介质的释放,开启一系列的促炎反应[23]。IL-6也是巨噬细胞和FLS的产物之一,其通过与sIL-6R形成复合物介导下游信号通路(MAPK、JAK/STAT3、RANKL/NF-κB)的激活,诱导滑膜细胞异常增殖以及促进VEC分泌VEGF和MMP,激活微血管新生[24]。而由巨噬细胞和FLS产生的另一细胞因子VEGF主要受到缺氧诱导因子1α(hypoxia-inducible factor-1α, HIF-1α) 的调控,其组成的HIF-VEGF-Ang信号轴对RA滑膜血管新生具有重要调控作用。众多细胞在多种促炎细胞因子的刺激下均可以表达GM-CSF,而过表达的GM-CSF也可以激活其下游介导的JAK/STAT/SOCS、MAPK、PI3K以及其他的信号途径,参与调控RA炎症反应[25]。关节滑膜微环境中的这些炎症细胞因子相互交错、相互联系,共同刺激加速了RA的产生以及发展。
6 结语
关节滑膜炎性微环境同肿瘤炎性微环境相似,是一个由多种细胞以及生长因子组成的复杂整体,它们共同调控着RA疾病的发生发展过程。微环境中某些炎性细胞因子能够直接刺激激活巨噬细胞的极化,极化后的细胞又间接促进特定炎性因子的释放,进一步加重机体炎症免疫反应。FLS具有类肿瘤样生长特性,使滑膜正常组织过度增生肥大,耗氧量增加而滑膜组织产生急性缺血缺氧现象,导致滑膜微血管过度生成,新生的微血管又可以为滑膜组织的生长提供大量营养物质,在FLS异常增殖和VEC的血管新生协同作用下共同促进RA特征性的血管翳的形成。因此,RA关节滑膜炎性微环境影响着RA疾病的发生发展各个阶段,重视RA关节滑膜炎性微环境的研究有助于拓展对RA疾病更加全面的认识并为探索RA的治疗提供参考。
