基于线粒体COⅠ基因序列的中国近海蓝圆鲹遗传多样性研究
2020-06-10王业磷裴丽梅黄志基
徐 示,章 群,王业磷,裴丽梅,罗 纯,黄志基
(暨南大学生态学系,广州 510632)
蓝圆鲹(Decapterusmaruadsi)隶属鲈形目(Perciformes)鲹科(Carangidae)圆鲹属,俗称巴浪、池鱼,主要以浮游甲壳类和小型鱼类为食,广泛分布于日本至澳大利亚北部的西太平洋侧,是暖水性中上层鱼类。蓝圆鲹在我国渤海、黄海、东海、南海均有分布,年产量曾一度高达60万t;鱼肉含高蛋白低脂肪,营养价值较高[1-2],是我国重要的经济鱼类[3-5]。但近年来,受过度捕捞和生态环境破坏的影响,南海北部一些经济鱼类资源严重衰退以致难以形成渔汛,而据统计,蓝圆鲹2004—2009年全国年均产量约6.2×105t,2010—2018年全国年均产量约为5.6×105t[6]。为防止蓝圆鲹逐渐向低龄化、小型化和简单化等的不利演变,避免重蹈小黄鱼(Larimichthyspolyactis)、大黄鱼(L.crocea)等种质资源衰退覆辙,亟待制定相应的管理措施,以更好地保护和开发利用中国沿海蓝圆鲹种质资源。
遗传多样性是生物多样性与种质资源研究的基础和核心,遗传多样性下降可能导致物种对环境适应力的下降,威胁野外复杂环境下物种的生存[7]。目前,国内外学者对蓝圆鲹的研究主要集中在渔业资源利用、生理特性、摄食习性和营养级、形态特征和部分地区生物学分析层面[8-10]。种群遗传方面的研究,目前仅有牛素芳等[11-12]分别使用控制区全序列标记和Cytb基因标记对福建闽东、闽南2个群体和南海北部湾海域9个群体的蓝圆鲹遗传多样性分析的报道,尚未见中国东海和黄海等海域的研究。
动物线粒体DNA(mtDNA)进化速度是核基因的4~10倍[13-14],母系遗传有效群体数量仅为核基因的1/4,拷贝数多,是开展种群遗传研究的首选分子标记[15]。其中COⅠ基因已被广泛用于群体遗传学和系统发育关系研究[16-19],线粒体COⅠ序列也被广泛用于研究不同阶元的系统发育关系,如水生生物的群体遗传学、系统进化、物种鉴定[20]等领域。目前已有大量采用COⅠ基因对不同海洋物种如蓝点马鲛(Scomberomorusniphonius)[21]、印度明对虾(Fenneropenaeusindicus)[22]、日本红毛蟹(Erimacrusisenbeckii)[23]等进行的群体遗传多样性研究报道,蓝圆鲹的线粒体COⅠ基因序列也同样可很好地用于种群遗传研究。本研究测定并分析了中国沿海蓝圆鲹10个地理群体的COⅠ基因序列多样性,以期更加全面地了解中国近海蓝圆鲹的遗传多样性和种群结构,为种质资源的保护和可持续利用提供科学依据。
1 材料与方法
1.1 样品的采集、DNA提取和测序
本研究采集了中国山东、浙江、福建、广东、广西、海南6省10个地理群体193尾蓝圆鲹(表1),新鲜肌肉样品保存于95%乙醇备用。DNA提取采用苯酚-氯仿法[24],用于PCR扩增的引物、反应体系和反应程序参考WARD[25]的实验方法,将电泳检测条带清晰明亮的PCR扩增产物送华大基因公司测序。
1.2 数据处理
运用MEGA X对测序峰图人工校对,并计算碱基组成、颠换率,统计突变位点数,基于Kimura2-Parameter模型的遗传距离构建邻接树。通过DnaSP 6.12.03软件计算单倍型数(number of haplotypes,Nh)、单倍型多样性(haplotype diversity,Hd )、核苷酸多样性(nucleotide diversity,π)以及遗传分化系数(Fst)。使用Network 5.0[26]构建单倍型网络图,通过Arlequin 3.5.2.2软件的分子方差分析(AMOVA)[27]估算群体的遗传变异,获得核苷酸错配信息,检查组别的显著性差异,计算Tajima’sD和Fu’sFS值并进行中性检验,得到SSD值、Rg值、τ值参数[27]。根据公式T=(τ/2μk)×G,其中,τ、μ、k、T和G依次代表种群扩张时间参数、序列的变异速率[采用1%~3%/MY[28](million year, MY)]、序列长度、代时以及种群扩张时间。使用 BEAST 1. 8. 2 进行种群动态的 Bayesian skyline plot(BSP)分析[29]。
2 结果与分析
2.1 中国近海蓝圆鲹群体COⅠ基因序列多态性
测序峰图经人工校正并去掉两侧引物序列后进行比对,在所获得193条蓝圆鲹COⅠ基因5′端652 bp序列中,A、T、G、C含量分别为22.7%、30.8%、19.7%和26.8%,A+T的含量(53.5%)略高于G+C(46.5%)含量,与其他硬骨鱼类的COⅠ碱基特性相一致[30]。在检测到62个变异位点中有简约信息位点21个,转换和颠换比(Ts/Tv)为2.47,表明序列未达到饱和,适合进行种群遗传发育分析[31];29个单倍型中,22个为独享单倍型,其中共享频率最高的是Hap_1(106个),由大部分群体共享;其次是Hap_2(54个),说明二者可能起源于母系祖先的主体单倍型。蓝圆鲹整体呈现高单倍型多样性(0.626 00±0.030 00)和低核苷酸多样性(0.002 25±0.001 16)的特点,其中舟山群体的单倍型多样性、崂山群体的遗传多样性最高,分别为0.771 00和0.005 68;新盈群体两个多样性数值最低,分别为0.111 00和0.000 17,结果如表1所示。
2.2 中国近海蓝圆鲹群体的遗传分化
以Kimura2-Parameter模型构建的单倍型网络中呈现典型的星状结构,没有明显的地理聚群和谱系结构(图1)。表2中两两群体间的遗传分化系数Fst值为-0.040~0.798,其中,北海群体与其他群体Fst值为0.145~0.798且都是极显著差异;此外,新盈与陵水、惠来、阳江、福州和舟山之间也存在显著性的遗传分化(0.006~0.229,P<0.05)[32]。其余组别之间均无显著差异,不存在明显分化。
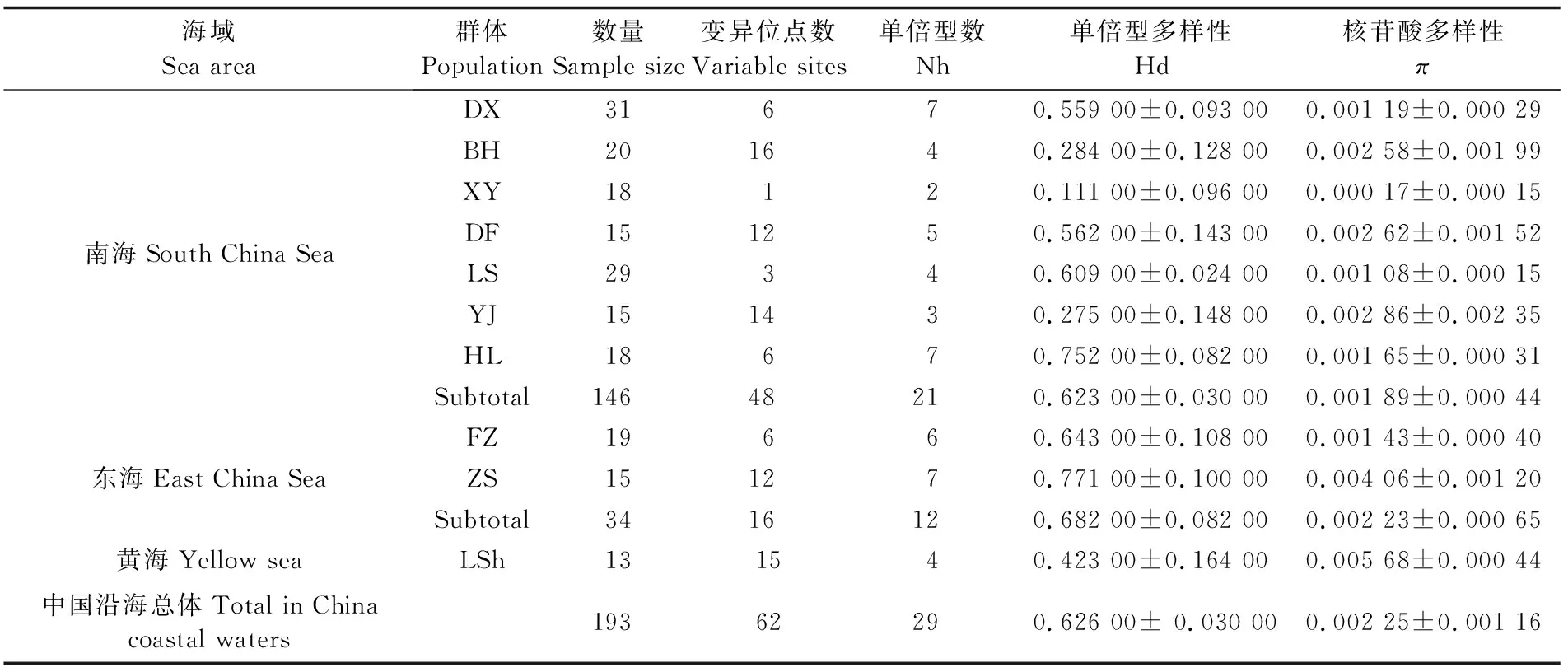
表1 中国沿海蓝圆鲹群体的遗传多样性Tab.1 Parameters of genetic diversity of D.maruadsi populations in coastal waters of China
注:DX:东兴; BH:北海; XY:新盈; DF: 东方; LS: 陵水; YJ:阳江; HL: 惠来; FZ: 福州; ZS: 舟山; LSh: 崂山
Note: DX:Dongxing; BH:Beihai; XY:Xinying; DF: Dongfang; LS: Lingshui; YJ: Yangjiang; HL: Huilai; FZ: Fuzhou; ZS: Zhoushan; LSh: Laoshan
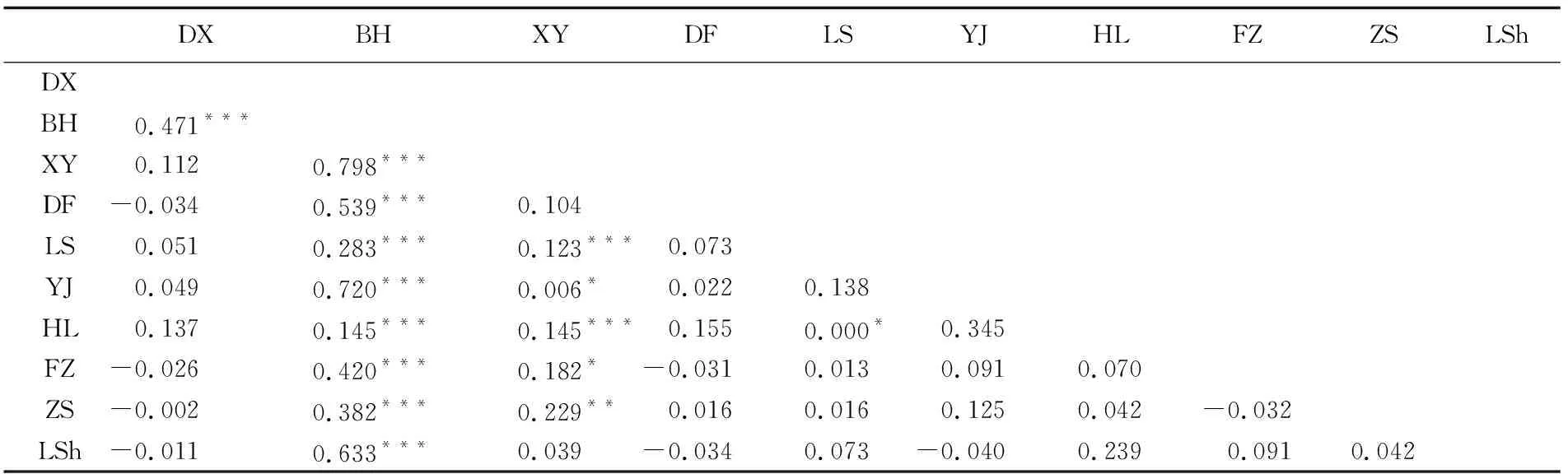
表2 中国沿海蓝圆鲹10个群体间遗传分化系数(Fst)Tab.2 Fixation index (Fst) of 10 D.maruadsi popalations in coastal waters of China
注:X:东兴; BH:北海; XY:新盈; DF: 东方; LS: 陵水; YJ:阳江; HL: 惠来; FZ: 福州; ZS: 舟山; LSh: 崂山。*:P<0.05;**:P<0.01;***:P<0.001
Note: DX:Dongxing; BH:Beihai; XY:Xinying; DF: Dongfang; LS: Lingshui; YJ: Yangjiang; HL: Huilai; FZ: Fuzhou; ZS: Zhoushan; LSh: Laoshan. Statistical significance:*:P<0.05;**:P<0.01;***:P<0.001
按照地理位置将样品分为下列3组:①10个地理群体间;②黄海(崂山)、东海(舟山和福州)、南海(惠来、阳江、北海、东兴、新盈、陵水、东方)之间;③台湾海峡以北(福州、舟山、崂山)、台湾海峡以南至北部湾之间(惠来、阳江、北海、东兴、新盈、陵水、东方)。AMOVA分析(表3)表明:群体内的变异达到81%以上,组群内群体间变异比列为16.66%~19.49%。上述3个分组:10个群体间(Fst=0.202 50,P<0.001)、3个不同海域间(Fst=0.301 22,P<0.001)、台湾海峡南北之间(Fst=0.185 21,P<0.001),都显示出很高的遗传分化。
2.3 蓝圆鲹的历史动态
Tajima’sD和Fu’sFS中性检验结果见表4。蓝圆鲹整体Tajima’sD=-1.326 5(P>0.1),其中北海、东方、阳江、舟山4个群体为显著性负值(-2.324 4~-1.684 1,P<0.05),其余为不显著性负值。Fu’sFS检验东兴、惠来和福州是显著性负值(-3.631 6~-2.552 4,P<0.05),总体上也是显著性负值(FS=-1.171 8,P<0.01)。Ramos-Onsins&Rozas’sR2检验分析显示Rg值(0.048 6~0.617 3)和SSD值(0.000 1~0.058 2)较小,且均为不显著性,表明中国沿海蓝圆鲹群体没有显著偏离扩张模型。此外,核苷酸错配图(图2)呈现明显单峰,且观测分布和期望分布拟合优度较好;Fu’sFS检验比Tajima’sD对群体近期扩张更敏感[33];单倍型网络图呈典型星型结构,表明蓝圆鲹在历史上经历了明显的快速扩张事件[34],蓝圆鲹整体扩张参数τ为2.912 5,以线粒体COⅠ基因进化速率为(1%~3%)/百万年[28]、性成熟期1年,估算出中国蓝圆鲹种群扩张大约发生在0.226 30~0.075 44百万年之前,处于晚更新世时期的末次冰期。BSP进一步分析表明,中国沿海蓝圆鲹在距今0.21~0.03 Ma BP(图3)发生过快速的种群扩张事件,这与公式估算得到的种群扩张时间相吻合。

图1 蓝圆鲹单倍型网络图Fig.1 Parsimony network of haplotypes of D.maruadsi注:DX:东兴; BH:北海; XY:新盈; DF: 东方; LS: 陵水; YJ:阳江; HL: 惠来; FZ: 福州; ZS: 舟山; LSh: 崂山。不同的填充形式代表不同的种群,圈的大小表示样本在不同的单倍型出现的频率Note: DX:Dongxing; BH:Beihai; XY:Xinying; DF: Dongfang; LS: Lingshui; YJ: Yangjiang; HL: Huilai; FZ: Fuzhou; ZS: Zhoushan; LSh: Laoshan. Different filling traits represent different populations,size of circles is approximately proportional to the frequency of each haplotype

表3 中国沿海蓝圆鲹种群结构的分子方差分析Tab.3 AMOVA analysis based on mtDNA differentiation of D.maruadsi in coastal waters of China
注:X:东兴; BH:北海; XY:新盈; DF: 东方; LS: 陵水; YJ:阳江; HL: 惠来; FZ: 福州; ZS: 舟山; LSh: 崂山。*:P<0.05;**:P<0.01;***:P<0.001
Note: DX:Dongxing; BH:Beihai; XY:Xinying; DF: Dongfang; LS: Lingshui; YJ: Yangjiang; HL: Huilai; FZ: Fuzhou; ZS: Zhoushan; LSh: Laoshan.*:P<0.05;**:P<0.01;***:P<0.001
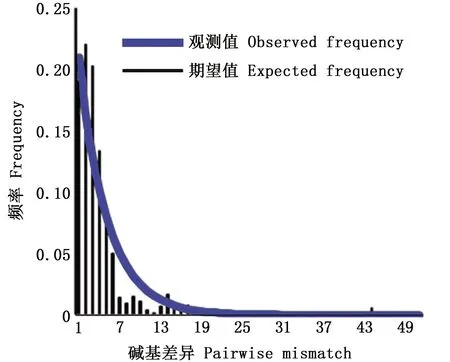
图2 中国沿海蓝圆鲹群体COⅠ核酸不对称分布Fig.2 Distribution of pairwise differences for mtDNA region haplotypes
3 讨论
3.1 蓝圆鲹的遗传多样性和历史动态
遗传多样性是在较长的一段时间积累下的产物,决定该物种生存、发展的前景和进化的方向[35]。物种适应能力、分化能力以及受环境影响的耐受力很大程度上影响了其遗传多样性的高低[36],而单倍型多样性(Hd)和核酸多样性(π)是衡量某一物种遗传多样性的2个重要指标。蓝圆鲹COⅠ序列遗传多样性(Hd=0.626 00±0.030 00,π=0.002 25±0.001 16)与牛素芳等[12]报道南海北部的蓝圆鲹(Hd=0.577 00±0.036 00,π=0.001 55±0.001 12)在具体数据上略有差异,可能是用于分析的标记基因、序列长度、个体数量和地理群体来源不同所致。但二者都表现为:东部高、西部低。蓝圆鲹多样性呈现出高Hd低π的特点,这与日本比目鱼(Paralichthysolivaceus)(Hd=0.736 00±0.053 70,π=0.003 29±0.000 58)[37]、蓝点马鲛(Hd=0.476 00±0.171 00,π=0.001 90±0.000 70)[21]、黄姑鱼(Nibeaalbiflora)(Hd=0.697 00±0.002 25,π=0.001 72±0.000 21)[38]表现出相同的多样性分布模式。而黄海和东海等北方群体核苷酸多样性高于南海群体,则是本研究扩大地理范围所得到的新结果。

图3 蓝圆鲹BSP种群动态分析Fig.3 Bayesian skyline plot of D.maruadsi population注:黑线表示中值。阴影区域表示95%的置信区间,所有的ESS≥200Note: The black line indicates the median. The shaded portion represents a 95% HPD interval,all ESS values ≥200
一般而言,遗传变异和分化较低的物种受到各种不利因素的影响后,其恢复能力较低,甚至会受到灭绝的风险,反之则能很好地适应环境的变化和有较高进化的可能性[39]。北海与其余9个群体之间存在显著的遗传分化(0.145~0.798,表2),新盈与陵水、惠来、福州、舟山之间的群体分化也显著。AMOVA分析结果显示,主要变异来源于群体内个体间(变异比例81.745%~91.680%)外,3个分组结果均在组群内的群体间有不同程度的遗传分化(Fst=0.185 21~0.301 22,P<0.001)。蓝圆鲹只在不同季节做或深或浅的游动,而不进行长距离洄游[40]。受南北洋流及大陆架的影响,一方面中国近海北部的蓝圆鲹随中国沿岸流暖流和黑潮穿越台湾海峡;另一方面南海南部暖流和中国沿岸流到达北部湾,受琼州海峡和南海大陆架特殊的地理景观影响[41],北部湾北海群体和新盈群体难以通过附近洋流和沿岸流进行远距离传播,因此可能与其他地理群体间遗传分化明显。另外,蓝圆鲹在近期整体上发生过种群扩张事件,推测在晚更新世时期的末次冰期,海平面上升,随着强烈的冬季风增强、南海沿岸流上升,地表古生产力(surface paleoproductivity)增加,使得南北部的蓝圆鲹种群得以迅速扩张,产生新的变异[42]。中性检验Tajima’sD检验法侧重于种群的古老突变,因此此检验方法能够反映出较长跨度时间范围内所发生的事件;Fu’sFS中性检验法对种群近期事件更为敏感,因此当种群在近期积累较多变异时,FS往往是较大的负值。本研究中Tajima’sD都是负值,而蓝圆鲹整体上的Fu’sFS值出现显著性负值;单倍型错配分布呈单峰,也说明蓝圆鲹可能在历史上经历过种群扩张事件。
3.2 蓝圆鲹的种群资源保护
蓝圆鲹是我国重要的海洋经济鱼类之一,历史上产量曾长期位列南海首位,但近年受捕捞强度加大、海洋污染、人为栖息地的破坏和全球气候变化等多重因素影响,南海蓝圆鲹资源量有所下降,其产量也已退居南海鱼类第三位,有可能对种质遗传资源产生不利影响[43-44]。为避免重蹈大黄鱼种质资源衰退以致枯竭覆辙,需要加强蓝圆鲹种质资源保护和可持续开发利用研究。就本研究而言,南海海域的北海和新盈群体与其他群体间存在较高的分化,可作为一个独立的管理保护单位,其中新盈群体是遗传多样性最低的一个群体,应采取措施避免遗传多样性的进一步降低;其余群体作为另一管理保护单位,其中黄海海域的崂山群体核苷酸遗传多样性最高,东海海域的舟山群体次之,应作为蓝圆鲹种质遗传资源保护和开发利用的核心群体。本研究仅使用母系遗传的分子标记,中国沿海蓝圆鲹的双亲遗传和遗传分化信息并不能完整地反映。在未来的研究中,将运用多个分子标记进行分析,同时扩大采样的范围和增加采样的数量,以期对中国近海蓝圆鲹的遗传背景做更加深入的了解。
