大亚湾典型珊瑚礁区域冬春季节底栖生物分布研究
2020-06-10朱文涛秦传新段丁毓马鸿梅席世改潘莞倪黎小国
朱文涛,秦传新,段丁毓,马 欢,马鸿梅,席世改,左 涛,潘莞倪,黎小国
(1. 中国水产科学研究院南海水产研究所,国家渔业资源环境大鹏观测实验站,农业农村部南海渔业资源环境科学观测实验站,中国水产科学研究院海洋牧场技术重点实验室,广东省渔业生态环境重点实验室,广州 510300; 2. 上海海洋大学海洋科学学院,上海 201306)
珊瑚礁通常位于营养贫乏的水域,却有极高生产力和生物多样性[1],被称为“海洋热带雨林”[2]。珊瑚礁结构错综复杂,珊瑚作为骨架形成的大量空隙可为海洋生物提供栖息地和适宜的生存环境[3]。珊瑚礁中可能存在多达100万的物种[4],几乎所有海洋生物的门类都有代表生活在珊瑚礁区。据估计全球珊瑚礁创造的经济产值高达千亿美元[5],珊瑚礁能够为人类提供丰富的生物资源,并且具有巨大的经济效益和丰富的生态功能[6]。近年来国内学者在珊瑚礁生态系统的现状调查[7]、珊瑚礁生物多样性[8]、生态修复[9]等方面开展了多项研究,为深入了解我国珊瑚礁生态系统分布、现状以及保护等提供了基础资料和理论依据。
海洋底栖生物是指生活在海底表面或沉积物基质中的生物,参与有机碎屑的分解、物质交换、营养物质循环等生态功能,在维持着海洋生态系统的结构和功能中有举足轻重的作用[10-12]。目前,国内底栖生物研究以近岸海域的报道为主,关于深海的底栖生物调查也在逐渐增加[12],而对珊瑚礁生态系统底栖生物的研究较少[10,13-16]。我国大型底栖生物的调查和研究所使用的仪器设备主要包括抓斗式采泥器、重力采泥器、箱式采泥器、现场摄影研究等[12],在大部分海洋生态系统中,底栖群落的采样可以用采泥器等直接采样。但考虑到对礁石相关栖息地进行取样的限制[17],这种采样方法对于脆弱的珊瑚礁生态系统是不可行的。利用高清水下摄像机沿着每个横切面拍摄一定数量的照片,并使用Excel扩展软件Coral Point Count进行分析[18-19],这种标准视觉普查是用于礁区藻类、鱼类或底栖群落的鉴定和分析最常用的方法,但会受到海况和摄像设备等外界因素影响。
美国国家海洋和大气管理局(NOAA)的珊瑚礁部门(CRED)首先开发了廉价和有效的采样工具珊瑚礁监测结构(autonomous reef monitoring structures,ARMS),通过模拟珊瑚礁栖息地的结构来吸引无脊椎动物和藻类定居,用于规范底栖生境的采样工作[17]。ARMS由几层 PVC(聚氯乙烯)板组装而成,模拟珊瑚礁的3D结构进而允许底栖生物定殖[20];各PVC层由螺丝和长铁棒固定住,需要的时候可以卸载成单独的板层进行下一步处理[21]。ARMS降低了野外工作和监测的成本,目前已在全球不同珊瑚礁区底栖生物研究中发挥了重要作用。虽然ARMS最初是为珊瑚礁栖息地设计的,但已经被多位学者用于评估加勒比海、印度太平洋、红海等海域底栖生物的多样性[20,22]。这些研究结果表明,ARMS采样能很好地反映底栖群落生物多样性,并且可以根据相同的规格进行标准化制造,为珊瑚礁区甚至其他海域硬底生境的底栖生物提供良好的研究和监测工具。
大亚湾位于南海北部珠江口东侧,具有多样的自然生境和丰富的生物资源[23]。目前大亚湾海域的亚热带珊瑚礁的生物多样性研究还较少,只有少数几次的珊瑚分布状况调查记录在案[24]。珊瑚礁内栖息的底栖生物是珊瑚礁生态系统的重要组成部分,维持和促进生态功能的发挥,可以作为珊瑚礁生态系统健康的重要监控手段[25]。本研究应用ARMS采样工具和采样方相结合的采样方式,调查了大亚湾海域中典型珊瑚礁区冬春两季底栖生物分布情况,分析了ARMS在珊瑚礁底栖生物调查研究中的可行性,以期为大亚湾珊瑚礁底栖生物多样性和群落结构研究提供基础资料。
1 材料与方法
1.1 采样区域
大亚湾是广东省内的半封闭式海湾,湾内岛屿众多并且岸线曲折,具有生物多样性丰富的珊瑚礁生态系统。根据历史上学者在大亚湾海域进行的珊瑚分布调查结果和站位设计[24,26-27],于2018年11月份、2019年2月份在大亚湾的5个典型珊瑚礁区放置了采样装置,并在上面固定HOBO温光仪(MX2202,USA)以记录该站位的水温变化。采样地点的站位分布如图1所示,各调查站位经纬度坐标见表1。大亚湾珊瑚礁调查站位的水深介于2.1~3.6 m之间,礁区水深平均为2.8 m。冬季水温在10.61~20.49 ℃之间,春季水温在18.58~25.57 ℃之间。

图1 典型大亚湾珊瑚区采样站位设置示意图Fig.1 Sketch map of sampling stations in typical coral reefs in the Daya Bay

表1 调查站位的地理坐标Tab.1 Geographical positions of sampling stations in the Daya Bay
1.2 采样方法
珊瑚礁区的底部结构复杂且难以取样,海洋底栖生物常用的采泥器采样会影响脆弱的珊瑚生境。所以本研究采用ARMS附着珊瑚底栖群落和采样方相结合的方法进行样品采集。本实验中的ARMS是由5块长29.6 cm、宽29.6 cm、厚1 cm的PVC板(聚氯乙烯塑料)、螺丝等组合而成的人工礁体,通过模拟珊瑚礁复杂的结构来聚集底栖生物,能够有效且无破坏性地采集到生活在礁区底部的生物。潜水员于2018年11月在大亚湾的5个站位的珊瑚礁区底部分别放置3个ARMS,经过3个月的底栖生物聚集后潜水员再于2019年2月份使用网眼径106 μm的网袋套住(防止ARMS上附着的生物脱落)礁体并带回船上,将11个ARMS带上岸后分别刮下底栖生物,并用0.5 mm 孔径的网筛分选样品,将样品装入标记的样品袋中,放入低温环境保存。底栖生物样品的处理、保存、计数、鉴定等均按《海洋调查规范》(GB/T12763.6-2007)进行。ARMS礁体上长时间附着的底栖生物即为该珊瑚礁区域在冬季的附着性的底栖群落。ARMS刮取干净后,潜水员再在相同的采样站位分别投入3个。同时,潜水员会使用面积为0.25 m2的取样框套在珊瑚礁石区域,拣取样方内的大型动物作为游泳性底栖生物进行补充。潜水员于2019年4月份取回12个ARMS,春季的底栖生物的其他处理和冬季一样。
1.3 数据分析
将样品带回实验室分别进行种类鉴定、个体计数和称重。依据采样面积,利用个体计数、称重数据在Excel记录表中将各种数据换算为单位面积的丰度(个·m-2)和生物量(g·m-2)。将底栖生物按照主要的五大类群(环节动物、棘皮动物、软体动物、藻类、节肢动物)进行归类,使用Excel 2016统计各站位中每个类群的种类数。基于各站位的种类数、单位面积的丰度和密度数值,使用 Arc GIS 工具中的自然断点分级法,展示它们在不同站位中的空间分布。并利用SPSS软件的独立样本的非参数检验(Wilcoxon方法)对冬春两季的门类种类数组成差异进行分析。
利用R语言(R3.5.1版本)中vegan软件包计算两个季节每一采样地点的物种丰富度指数(D)、多样性指数(H′)和均匀度指数(J),在ggplot2包中绘制3个多样性参数的箱线图,并使用t检验分析两个季节多样性指数差异的显著性。

在大型多元统计软件Primer 5.0中将底栖生物丰度数据经四次方平方根转化后,然后采用Bray-Curtis相似性等级聚类(CLUSTER)进行聚类分析、非度量多维尺度分析(MDS)进行群落结构划分,并使用相似性分析(ANOSIM)来检验冬春两季的群落差异是否显著。将藻类的数据去除后,分别利用冬春两季中大型底栖动物的生物量和丰度,绘制大型底栖动物 ABC 曲线,分析大型底栖动物群落受干扰程度。

图2 ARMS采样过程Fig.2 Sampling process of ARMS
2 结果与分析
2.1 种类组成
冬春两季在大亚湾珊瑚礁调查海域共鉴定出底栖生物包括棘皮动物、软体动物、环节动物、藻类、节肢动物5大门类91种,其中软体动物的种类最多(64种),约占总种数的70.33%。种类数从高到低排序为: 软体动物>环节动物>藻类>节肢动物>棘皮动物。冬季采样调查共鉴定出底栖生物 5 大门类 49 种,软体动物最多(36种),约占总种数的 73.47%(表2);另外存在环节动物7种、节肢动物4种、藻类4种、棘皮动物2种。各站种类数的变化范围为17~22种,调查海区S4站位种类较其他区域少,S3种类最多(图3)。春季ARMS采获底栖生物4大门类48种,软体动物最多(32种),约占总种数的 66.67%(表2);另外存在环节动物7种、节肢动物4种、藻类5种。各站种类数的变化范围为10~14种,调查海区S4和S5站位种类最多,S1种类较其他区域少(图3)。对冬春两季的门类种类数组成进行独立样本的非参数检验(Wilcoxon方法),结果表明,冬春两季 2 次调查的种类数组成存在显著性差异(P<0.05)。以优势度Y≥2% 界定优势种,表3列出了冬春两季出现的优势种和出现频率。三角藤壶(Balanustrigonus)、网纹藤壶(Balanusreticulatue)在冬季是具有绝对优势的优势种。网纹藤壶、珠母核果螺(Drupamargariticola)、疣荔枝螺(Thaisclavigera)等是春季优势度较高的优势种。大亚湾珊瑚礁海域两个季节优势种组成有所差异,春季优势种组成更丰富。
2.2 栖息密度和生物量分布
根据各站位点的丰度值,运用Arc GIS得到冬季和春季底栖生物丰度空间分布如图4所示。冬季珊瑚礁区域底栖生物平均密度为1 962.51个·m-2,其中:节肢动物密度最高,约占总栖息密度量的 93.90%;其次为软体动物,约占总密度的3.25%。各站密度的主要组成种类无较大变化,主要是由节肢动物(三角藤壶和网纹藤壶)贡献。各站的密度的变化范围为1 088.98~2 739.93个·m-2,在S4站位的密度最高,在S2站位的密度最低。春季珊瑚礁区域底栖生物平均密度76.27个·m-2,软体动物密度最高,约占总密度的44.23%;其次为环节动物,约占总密度的33.77%。各站的平均密度的变化范围为43.15~112.68个·m-2,在S5站位密度最低,在S2站位的密度最高。

图3 不同季节底栖生物种数分布Fig.3 Species distribution of benthos in different seasons注:图中数字表示每站种类数Note: Numbers in the figure mean species number in each station
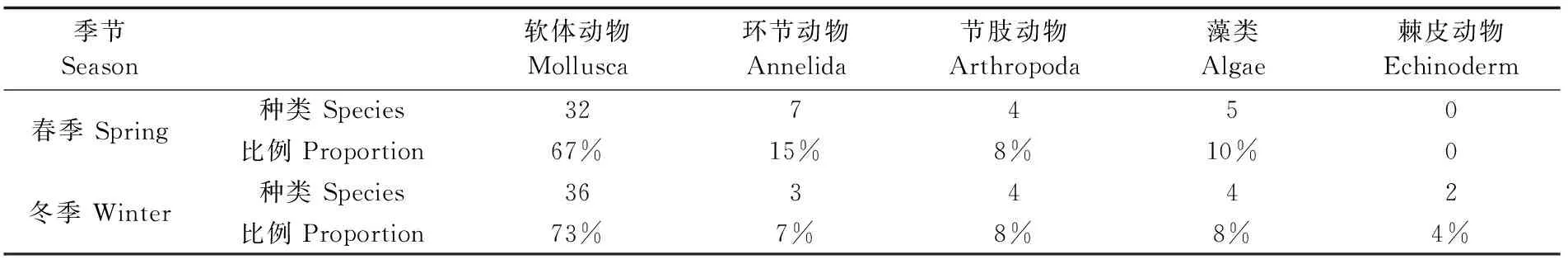
表2 不同季节底栖生物的种类组成和各类群所占百分比Fig.2 Species composition and percentage of benthos(winter/spring)
根据各站位点的生物量值,冬季和春季底栖生物生物量的空间分布如图5所示。冬季珊瑚礁区域底栖生物平均生物量为693.37 g·m-2,节肢动物生物量最高,约占总生物量的60.38%;其次为软体动物,约占总生物量的19.16%。各站生物量的主要组成种类有较大差别,各站的平均生物量的变化范围为357.57~990.71 g·m-2,在S1站位的生物量最高,在S5站位生物量最低。春季珊瑚礁区域底栖生物平均生物量107.09 g·m-2,节肢动物生物量最高,约占总生物量的 49.75%;其次为软体动物,约占总生物量的36.58%。各站的平均生物量的变化范围为32.78~221.82 g·m-2,在S5站位生物量最低,S2站位生物量最高。
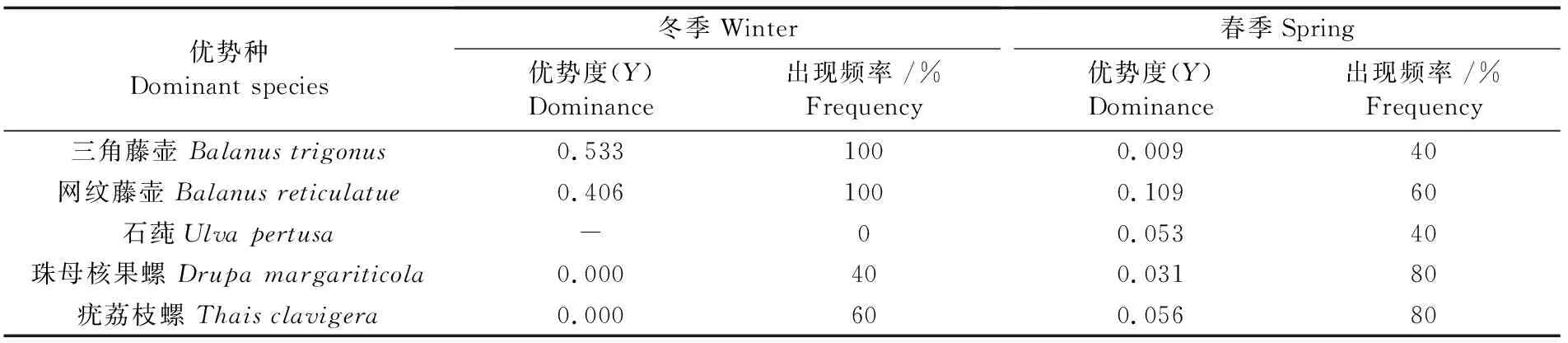
表3 底栖生物优势种在冬季和春季的优势度及出现频率Tab.3 Dominance (Y)and appearance frequency of dominant benthos (winter/spring)

图4 不同季节底栖生物丰度分布Fig.4 Spatial distribution of density of benthos (winter/spring)

图5 不同季节底栖生物生物量Fig.5 Spatial distribution of biomass of benthos(winter/spring)
2.3 多样性指数
不同季节中底栖生物群落生物多样性指数如图6所示。冬季物种丰富度指数(D)、多样性指数(H′)和均匀度指数(J)平均值分别为2.48±0.28、1.43±0.12和0.33±0.02,变化范围分别为2.02~2.72、1.27~1.59和0.31~0.36,其中多样性指数和均匀度指数都偏低。冬季S2的种丰富度指数、多样性指数和均匀度指数都是最高,3个多样性参数最低的站位是S4。春季物种丰富度指数(D)、多样性指数(H′)和均匀度指数(J)平均值分别为2.68±0.56、2.53±0.47和0.70±0.11,变化范围分别为2.07~3.45、1.87~3.00和0.54~0.81。春季丰富度指数和多样性指数最高的站位是S5,S4的均匀度指数最高;S1的丰富度指数最低,多样性指数和均匀度指数在S3最低。通过t检验发现,冬、春季的丰富度指数无显著性差异(P>0.05),而多样性指数和均匀度存在极显著差异(P<0.01),春季的多样性指数和均匀度极显著高于冬季。具体而言,从冬季到春季5个区域的多样性指数和均匀度均在增加,而丰富度指数只在S4和S5有所增加。
2.4 群落结构
采用等级聚类(CLUSTER)进行聚类分析和非度量多维尺度分析(MDS)的方法分析了底栖生物群落结构(图7)。结果表明两种方法得到的群落结构划分较为一致,大亚湾典型珊瑚礁区域冬、春季底栖生物群落可分划分为 3个生物群落。其中春季可分为两个群落,群落Ⅰ只包括S1站1个调查站;群落Ⅱ包括 S2~ S5共4个站位。冬季海区各站底栖生物具有较高的相似性,可以划分为 1个生物群落,包括S1~S5 所有站位。不同季节相比较,冬季和春季各站位底栖生物群落相似性季节差异较大。基于Bray-Curtis 距离的ANOSIM 分析结果表示,冬季和春季的群落结构差异显著(R=0.44,P=0.01)。由此可见大亚湾珊瑚礁底栖群落结构存在显著的季节变异。
2.5 群落稳定性
典型大亚湾珊瑚礁区的大型底栖动物的丰度生物量比较曲线(ABC曲线)见图8。冬季丰度曲线在前段始终位于生物量曲线之上,且后段生物量曲线与丰度曲线出现交叉,说明底栖生物群落结构受到一定程度的干扰,群落结构不稳定。春季丰度与生物量曲线没有交叉与重叠的现象,且丰度和生物量曲线并不接近,生物量曲线始终位于丰度曲线上方,说明春季底栖动物群落没有受到干扰,群落结构相对稳定。

图6 不同季节的多样性指数箱线图Fig.6 Diversity indices of benthos community in the Daya Bay(winter/spring)注:ns表示无显著性差异(P>0.05),**表示具有极显著差异(P<0.01)Note:ns means no significant difference (P>0.05), ** means extremely significant differences (P<0.01)

图7 聚类分析(A)与多维排序尺度(B)分析Fig.7 Cluster analysis(A) and multi-dimentional scaling(MDS)(B) analysis注:-W表示冬季站位;-S表示春季站位Note:-W stands for winter station; -S stands for spring station
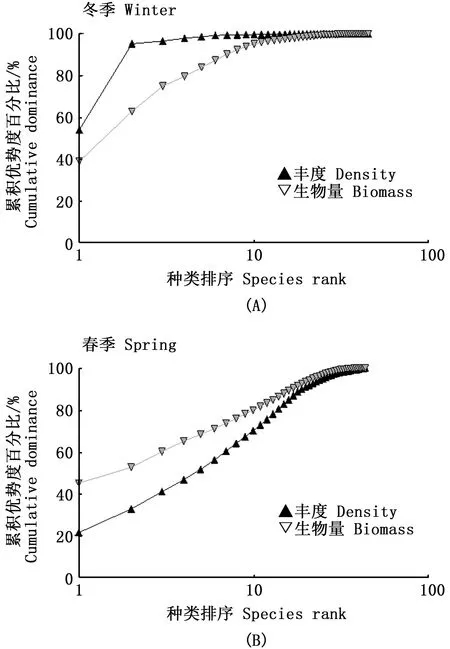
图8 不同季节的大型底栖动物群落ABC曲线Fig.8 ABC curve of macrobenthos in different seasons注:A.冬季;B.春季Note:A.Winter;B.Spring
3 讨论
海洋生态系统中底质支持着特定的底栖生物群落,是影响底栖群落的重要因素之一[30-31]。冬春两季在典型大亚湾珊瑚礁区域中共采获底栖生物91种,其中软体动物的种类最多。软体动物是珊瑚礁中物种最丰富的海洋无脊椎动物门类,例如它们是拉特兰岛珊瑚礁生态系统中最具生产力和价值的大型底栖动物[32]。大亚湾珊瑚绝大多数为浅水石珊瑚,底质主要以砂砾为主,间杂碎石和小块岩石[26]。螺类和牡蛎类等软体动物营附着生活[33],珊瑚礁和ARMS的复杂结构为软体动物提供了良好的空间。大亚湾珊瑚礁近3年内珊瑚死亡率达到了5.5%[24],岁月较长的死珊瑚礁内部也有利于积累数量较多的软体动物[13]。近年来在大亚湾的开放海域中发现,多毛类在大型底栖动物群落中占据明显优势地位,它们通过过滤底泥吸取营养为生,海域营养水平的提高有利于多毛类的生长[34]。与大亚湾的开放海域处于中等营养水平不同,珊瑚礁生态系统的水域通常是贫营养的,因为营养物质很容易被潮汐、波浪和水流带到开放海域[35]。另外在大亚湾珊瑚礁区也发现了少量的棘皮动物,这符合珊瑚礁中通常以成年棘皮动物的低密度为特征的研究结果[36]。
对于海洋底栖生物多样性研究,采样站位数量、采样位置、调查季节、采样方式和采样强度的不同均会造成物种数目、密度和生物量的差别[13,37]。目前国内关于珊瑚礁底栖生物多样性研究的文献资料较少,主要包括卢伙胜等[13]对徐闻珊瑚礁自然保护区、王丽荣等[14]对徐闻灯楼角珊瑚礁、李新正等[15]对南沙群岛渚碧礁、董栋等[16]对海南三亚珊瑚礁区中底栖群落的少量研究。王丽荣等[14]在徐闻灯楼角珊瑚礁获取77种大型底栖生物,种类数量低于本研究,但是其丰度和生物量都非常高,分别可达692.37个·m-2、1 043.37 g·m-2。李新正等[15]在南沙群岛渚碧礁使用轻潜水(SCUBA)方法共获得大型底栖动物314种,种类极其丰富,远远高于本研究结果,但其平均资源丰度和生物量相对较低,分别为357.94个·m-2和64.85 g·m-2。董栋等[16]于2011年11月在海南岛3个珊瑚礁自然保护区内采用潜水方法共获得大型底栖动物166 种,种类数高于本调查,其中平均丰度566.29个·m-2和生物量82.15 g·m-2均与本文相近。本调查中底栖群落的种类、丰度和生物量和上述采样结果均存在不同,这说明不同海域珊瑚礁底栖生物的群落结构差别可能与采样方法不同有关。和大亚湾海域的历次调查数据相比较,本研究中底栖动物物种的种类数偏小,但底栖生物的丰度和密度都是远远高于大亚湾海域的5次调查[34,38-41]。因为珊瑚礁生态系统可以支持珊瑚礁内数量庞大的生物生存,其中,浮游动物的生物量能用g·m-2来表示,底栖动物和鱼类甚至可以用100g·m-2来表示[42]。各站位中较高的生物量和丰度符合珊瑚礁作为“海洋热带雨林”的特性。
大亚湾珊瑚礁底栖生物在冬季和春季的群落结构差异显著,生物量、丰度、多样性指数和均匀度在不同季节变化较大。冬季珊瑚礁区域底栖生物平均密度为1 962.51个·m-2,平均生物量为693.37 g·m-2,均主要由节肢动物贡献,而多样性指数(H′)和均匀度指数(J)均低于春季。这可能是因为冬季三角藤壶、网纹藤壶的丰度值极高,削弱了其他物种在数量上的优势,使得其他优势种较少。藤壶的新陈代谢活动在低盐度会受到影响,进而附着和生长被抑制[43]。冬季东海的高营养盐外海水会形成顺时针方向的环流进入大亚湾,使得湾口海水区在冬季具有高营养盐的特征[44]。冬季由于藤壶等节肢动物成为主要的优势种之一且个体丰度值极高,另外冬季气温较低也有可能限制珊瑚礁底栖生物的生长繁殖等,进一步导致冬季大亚湾珊瑚礁底栖生物多样性水平偏低。本研究所调查大亚湾珊瑚礁区域属于亚热带性气候海域,每年3月至9月西南季风会带来丰沛的降雨[39],具有明显的干湿季特征。春季珊瑚礁区域底栖生物平均密度和生物量均低于冬季,分别为76.27个·m-2和107.09 g·m-2,冬季和春季优势种类、资源量差异较大。冬春季两次调查的种类数组成存在差异(P<0.05),ANOSIM 分析结果也显示群落结构差异显著(R=0.44,P=0.01)。群落结构存在显著的季节演替现象,造成这种现象的主要原因与海域中营养盐和水环境的季节性变化密切相关。春季雨水丰沛且温度升高,降雨为珊瑚礁区带来一定的外源营养物质,导致珠母核果螺、疣荔枝螺等优势地位提高,其他常见类群的资源量也在增加。雨水会在一定程度上冲淡海水盐度,肉食性螺类的捕食会进一步导致藤壶在春季的优势度降低。当然,溶解氧、叶绿素含量等其他环境因素也会影响到珊瑚礁的底栖生物群落结构[45],更多环境参数有待于进一步测量。通过ABC曲线可以看出,冬季大型底栖动物的群落结构受到了一定程度的干扰,而春季群落结构相对稳定,这也和从冬季到春季珊瑚礁区域的多样性指数和均匀度有所增加的趋势一致。总体来看,大亚湾典型珊瑚礁区域的生物多样性指数是偏低的,除去采样因素的影响外,大亚湾珊瑚礁的轻微扰动可能与旅游等人类活动有关[39],与王云祥等[24]得到的深圳海域造礁石珊瑚附近海域生态环境正在逐步遭到人类活动影响的结果相类似。
传统的珊瑚礁监测方法是以轻潜水SCUBA为基础,利用照片或视频录像在截断面进行视觉记录来描述底栖生物群落[46-47]。SCUBA潜水员在拍摄过程中会与珊瑚存在较长时间的物理接触,往往造成慢性破坏,底栖生物类群极易受潜水影响[48];视觉普查记录仅对暴露区域进行,存在许多局限性[17,49];至于海洋底栖生物常用的如采泥器等工具具有破坏性,在脆弱的珊瑚礁中是不适宜的。ARMS对礁区底栖生物有很好的吸附作用,能够提供固定和进行固着生物的多样性研究,可以作为复杂的珊瑚礁环境中简单而强大的监测工具[50]。ARMS在其表面或内部为底栖生物提供了空间和栖息地,以固着生物和附着物为主,但对底栖生物中活动能力强的吸附作用较小。值得注意的是,生物附着是需要一定时间的,在短时间内ARMS形成的生物群落可能不够成熟[17];人工珊瑚礁单元形成的稳定群落和附近自然珊瑚礁的底栖群落组合仍然有所不同[51]。后续应进一步改善ARMS的材料和结构,创建类似于天然珊瑚礁的年龄级结构和3D结构[17,52],来更好地模拟珊瑚礁的特性。另外在回收的时候发现ARMS存在遗失的可能,今后需要注意固定在珊瑚礁区的底部以防丢失。在珊瑚礁生物多样性研究中,传统的珊瑚礁调查方法可与ARMS方法相结合来改进取样方法的不足,ARMS标准化取样也能与分子测序结合起来增强鉴定结果的可信度[53]。通过上述方法的一些改进,ARMS有望作为珊瑚礁底栖生物的最佳监测工具,有助于在不同时空范围内全面了解珊瑚礁系统的生物多样性。
