HPLC指纹图谱结合正交试验优化红参的炮制工艺
2020-06-09侯新莲黄露彭成朱雅宁蔡帮军周勤梅
侯新莲 黄露 彭成 朱雅宁 蔡帮军 周勤梅
中圖分类号 R284.1 文献标志码 A 文章编号 1001-0408(2020)10-1228-06
DOI 10.6039/j.issn.1001-0408.2020.10.14
摘 要 目的:建立红参的高效液相色谱(HPLC)指纹图谱,并优选其最优炮制工艺。方法:采用HPLC法。色谱柱为Waters SymmetryShieldTM RP18,流动相为乙腈-水(梯度洗脱),柱温为30 ℃,流速为1.0 mL/min,检测波长为203 nm,进样量为10 μL。以人参皂苷Rb1为参照,绘制10批红参样品的HPLC指纹图谱;采用《中药色谱指纹图谱相似度评价系统(2012A版)》进行相似度评价,并确定共有峰。以蒸制温度、蒸制时间、干燥方法为考察因素,人皂苷类成分含量、指纹图谱相似度为指标,采用L16(43)正交试验优化红参的炮制工艺并进行验证;采用SPSS 19.0软件对10批红参样品和最优工艺炮制品进行聚类分析。结果:10批红参共有13个共有峰,相似度均大于0.920;共指认人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1等3个共有峰。最优炮制工艺为100 ℃蒸制150 min,60 ℃干燥;验证试验结果显示,3批红参最优工艺炮制品中人参皂苷Rg1、Re、Rb1的含量分别为0.26%~0.29%、0.17%~0.20%、0.47%~0.54%,其指纹图谱与对照图谱相似度均大于0.970。聚类分析结果显示,10批红参及3批最优工艺炮制品可聚为两类,即HS3~HS10聚为一类、3批最优工艺炮制品及HS1、HS2聚为一类。结论:所建指纹图谱可用于红参的炮制工艺优化,能表征炮制工艺参数波动与药材整体质量的相关性变化;所得最优炮制工艺合理可行。
关键词 红参;炮制工艺优化;正交试验;高效液相色谱法;指纹图谱;聚类分析
Optimization of Processing Technology of Ginseng Radix et Rhizoma Rubra by HPLC Fingerprint Combined with Orthogonal Test
HOU Xinlian1,HUANG Lu2,PENG Cheng2,ZHU Yaning1,CAI Bangjun1,ZHOU Qinmei2,3 [1. China Resources Sanjiu(Yaan) Pharmaceutical Co., Ltd., Sichuan Yaan 625000, China; 2. Pharmacy College, Chengdu University of TCM, Chengdu 611137, China; 3. Institute of Innovative Medicine Ingredients of Southwest Specialty Medicinal Materials, Chengdu 611137, China]
ABSTRACT OBJECTIVE: To establish an HPLC fingerprint of Ginseng Radix et Rhizoma Rubra, and to optimize its processing technology. METHODS: HPLC method was adopted. The determination was performed on Waters SymmetryShieldTM RP18 column with mobile phase consisted of acetonitrile-water (gradient elution) at the flow rate of 1.0 mL/min. The column temperature was set at 30 ℃, and the detection wavelength was 203 nm. The sample size was 10 μL. Using ginsenoside Rb1 as reference peak, HPLC fingerprints of 10 batches of Ginseng Radix et Rhizoma Rubra was established. The similarity of them was evaluated by using Similarity Evaluation System of TCM Chromatogram Fingerprint (2012 A edition) to confirm common peak. With steaming temperature, time and drying method as factors, using the content of ginsenoside and fingerprint similarity as index, the processing technology was optimized with L16(43) orthogonal test design and verified. Cluster analysis was conducted with SPSS 19.0 statistical software of 10 batches of Ginseng Radix et Rhizoma Rubra and 3 batches of optimal processed sample. RESULTS: There were a total of 13 common peaks in the fingerprints of 10 batches of Ginseng Radix et Rhizoma Rubra. The similarity was more than 0.920; 3 common peaks were identified, such as ginsenoside Rg1, ginsenoside Re, ginsenoside Rb1. The optimal processing technology included that steamed at 100 ℃ for 150 min, dried at 60 ℃. The results of validation test show that the contents of ginsenoside Rg1, Re and Rb1 were 0.26%-0.29%, 0.17%-0.20%, 0.47%-0.54%, and the similarity between 3 batches of Ginseng Radix et Rhizome Rubra optimal processed sample and the control fingerprints was more than 0.970. The results of cluster analysis showed that 10 batches of Gimseng Radix et Rhizoma Rubra and 3 batches of optimal processed sample could be clustered into two categories; HS3-HS10 could be clustered into one category, and 3 batches of optimal processed sample, HS1 and HS2 be clustered into one category. CONCLUSIONS: Established fingerprint can be used for the optimization of processing technology of Gimseng Radix et Rhizoma Rubra, and characterize the correlation between fluctuation of technology parameter and quality of medicinal material; the optimal processing technology is reasonable and feasible.
KEYWORDS Ginseng Radix et Rhizoma Rubra; Processing technology optimization; Orthogonal test design; HPLC; Fingerprint; Cluster analysis
红参是五加科植物人参(Panax ginseng C. A. Mey.)的栽培品经蒸制后的干燥根及根茎,具有大补元气、复脉固脱、益气摄血之功效[1]。药理研究发现,人参炮制成红参后,其活性有所改变,具有更强的抗氧化[2]、抗肿瘤[3]、抗肝毒[4]和促进组织血液循环[5]等作用。红参不仅是常用的中药饮片,同时也是中药注射剂如参附注射液、参麦注射液、生脉注射液等的主要原料之一。现代研究表明,红参炮制过程会引发化学反应,可生成大量皂苷类活性成分,且不同炮制参数会导致相应成分含量发生显著变化[6-8]。
红参现收载于2015年版《中国药典》(一部)[1],从1963年版《中国药典》有收载记录以来,品种项下仅描述“秋季采挖,洗净,蒸制后干燥”,未见炮制参数,质量控制也无指纹图谱等内容。市场出售红参质量的良莠不齐给下游中成药制剂质量的控制带来风险[9]。为规范和指导中药注射剂安全性再评价工作,国家食品药品监督管理局于2010年印发了《中药注射剂安全性再评价生产工艺评价等7个技术指导原则》,其中《中药注射剂安全性再评价质量控制评价技术原则(试行)》规定药材、制剂均应制定指纹图谱及相关性研究[10]。为提高含红参中药注射剂质量的可控性,本研究建立了红参的高效液相色谱(HPLC)指纹图谱,并结合正交试验设计对其炮制工艺进行了优化,以综合评价不同工艺参数对红参整体质量的影响,旨在为其质量控制提供参考。
1 材料
1.1 仪器
1260型HPLC仪(美国Agilent公司);HX-ZSG6型多功能大型蒸制柜(白山市恒祥机械制造有限公司);DHG-9240A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);XA-20型十万分之一电子天平(瑞士Mettler-Toledo公司);KQ-250DV型超声波清洗机(昆山市超声仪器有限公司)。
1.2 药品与试剂
鲜人参采自雅安三九中药材科技产业化有限公司吉林敦化人参基地5年生地块。10批红参药材(编号:HS1~HS10)经成都中医药大学国家中药种质资源库高继海副教授鉴定,均为五加科植物人参(P. ginseng C. A.Mey.)5年生的根和根茎或其栽培品经蒸制后的干燥根和根茎,均为市场流通的优质品种,其样品信息来源见表1。
人参皂苷Rg1对照品(批号:110703-201128,纯度:93.4%)、人参皂苷Re对照品(批号:110754-201123,纯度:89.1%)、人参皂苷Rb1对照品(批号:110704-201726,纯度:91.1%)均购自中国食品药品检定研究院;乙腈(色谱纯,美国Thermo Fisher Scientific公司,批号:184264);95%乙醇(分析纯,成都市科隆化学品有限公司,批号:20190506);水为超纯水。
2 方法与结果
2.1 指纹图谱的建立
2.1.1 色谱条件 色谱柱:Waters SymmetryShieldTM RP18(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-水(B),梯度洗脱(0~30 min,100%B→10%A;30~40 min,10% A→23%A;40~50 min,23%A;50~85 min,23% A→60%A;85~95 min,60% A→100%A;95~105 min,100% A);柱温:30 ℃;流速:1.0 mL/min;检测波长:203 nm;进样量:10 μL。
2.1.2 供试品溶液的制备 取红参粉末(过四号筛)2.0 g,精密称定,置于100 mL具塞锥形瓶中,加75%乙醇20 mL,密塞,称定质量,超声(功率:250 W,频率:50 kHz)处理45 min,放冷,再次称定质量,用75%乙醇补足减失的质量,摇匀,滤过,取续滤液5 mL,水浴挥干,残渣加10%乙醇复溶并定容至5 mL量瓶中,即得供试品溶液。
2.1.3 混合对照品溶液的制备 精密称取人参皂苷Rg1、Re、Rb1对照品各适量,置于棕色量瓶中,加20%乙腈制成人参皂苷Rg1、Re、Rb1质量浓度分别为 0.508 3、0.317 7、0.506 1 mg/mL的混合对照品溶液。
2.1.4 精密度试验 精密吸取“2.1.2”项下供试品溶液(编号:HS1)10 μL,按“2.1.1”项下色谱条件连续进样测定6次,以人参皂苷Rb1为参照,计算各共有峰的相对保留时间和相对峰面积。结果,13个共有峰相对保留时间的RSD均小于2%(n=6),相对峰面积的RSD均小于2%(n=6),表明仪器精密度良好。
2.1.5 稳定性试验 取“2.1.2” 项下供试品溶液(编号:HS1)适量,分别于室温下放置0、4、8、12、24、36 h时按“2.1.1”项下色谱条件进样测定,以人参皂苷Rb1为参照,计算各共有峰的相对保留时间和相对峰面积。结果,13个共有峰相对保留时间的RSD均小于2%(n=6),相对峰面积的RSD均小于7%(n=6)。笔者发现,供试品溶液在放置36 h时有沉淀析出现象,保留时间70 min后的色谱峰面积变小;24 h内相对峰面积的RSD小于3%,表明供试品在室温下放置24 h内稳定。
2.1.6 重复性试验 精密称定红参(编号:HS1)粉末(过四号筛)2.0 g,精密称定,共6份,按“2.1.2” 项下方法制备供试品溶液,再按“2.1.1”項下色谱条件进样测定,以人参皂苷Rb1为参照,计算各共有峰的相对保留时间和相对峰面积。结果,13个共有峰相对保留时间的RSD均小于2%(n=6),相对峰面积的RSD均小于3%(n=6),表明本方法重复性良好。
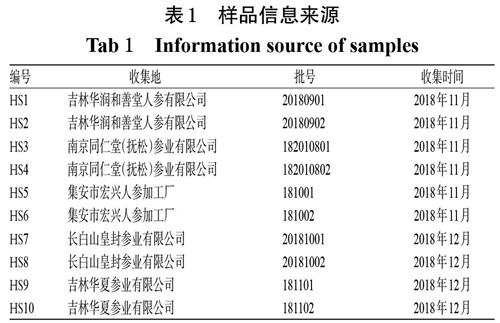
2.1.7 指纹图谱的生成 取10批红参样品,按“2.1.2”项下方法制备供试品溶液,再按“2.1.1”项下色谱条件进样测定。采用《中药色谱指纹图谱相似度评价系统(2012版)》进行数据分析与处理,设定时间窗宽度为0.10,通过多点校正方法进行色谱峰的自动匹配,以平均数法生成叠加指纹图谱和对照指纹图谱,详见图1、图2。
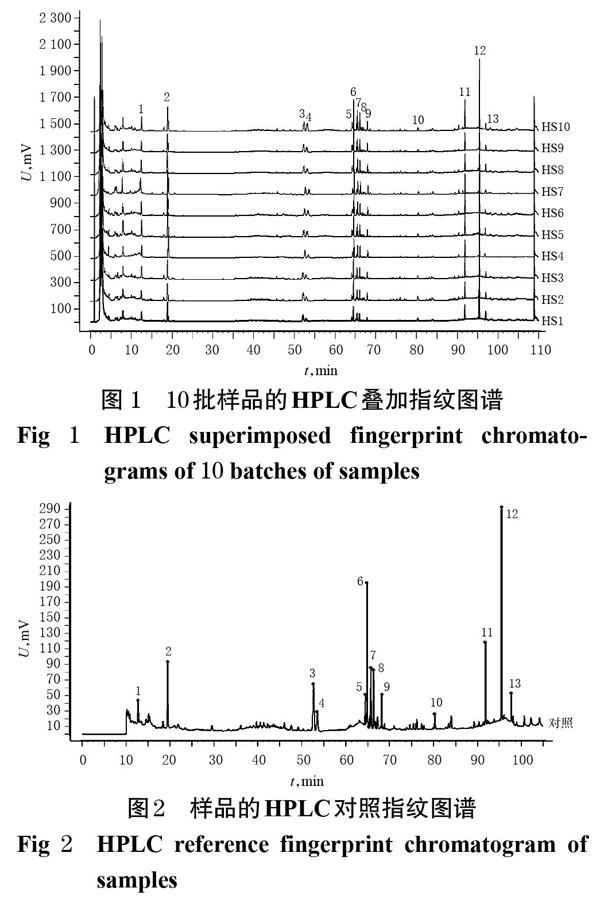
2.1.8 相似度评价 取10批红参样品,按“2.1.2”项下方法制备供试品溶液,以人参皂苷Rg1峰面积的5%作为最小峰面积,与红参样品HPLC对照指纹图谱中的13个特征峰进行多点校正并行全峰匹配,采用《中药色谱指纹图谱相似度评价系统(2012版)》进行整体相似度分析,结果见表2。
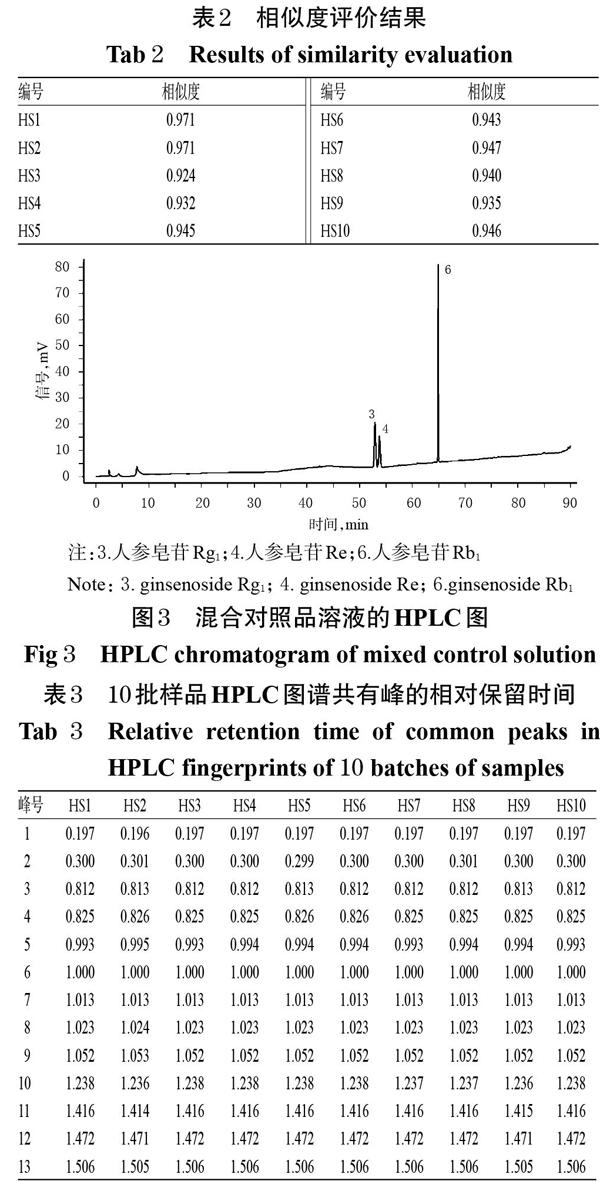
2.1.9 共有峰指认及相关性分析 10批红参样品共有13个共有峰,通过与混合对照品溶液HPLC图谱(图3)比对,指认了其中的3个:峰3为人参皂苷Rg1、峰4为人参皂苷Re、峰6为人参皂苷Rb1。10批红参的HPLC指纹图谱中,由于人参皂苷Rb1色谱峰(6号峰)与邻近峰分离度较好,峰面积较大,峰位适中,故以其为参照,计算其他峰的相对保留时间和相对峰面积,结果见表3、表4。
2.2 定量分析
本研究按2015年版《中国药典》(一部)“红参”项下含量测定方法[1]对人参皂苷Rg1、Re、Rb1含量进行测定。前期方法学考察结果显示,精密度、稳定性、重复性试验的RSD均小于2%, 加样回收率分别为96.7%(RSD=1.37%,n=9)、99.4%(RSD=1.56%,n=9)、100.7% (RSD=1.30%,n=9),符合药典要求。
2.3 炮制工艺优化
2.3.1 试验设计 参考炮制企业加工工艺参数及相关文献[11-12],将红参蒸制温度设为80~120 ℃,根据根茎大小将蒸制时间设为60~180 min不等,根据研究样本量或红参干燥设备等因素,设置晾晒自然干燥以及60 ℃左右烘房干燥、80 ℃热风快速干燥等不同方法。本课题组前期单因素试验结果发现,120 ℃蒸制90 min时,红参外观呈红褐色,其性状及人参皂苷Rg1、Re含量均不符合2015年版《中国药典》(一部)规定[1];80 ℃蒸制时生产效率太低,不适合工业化大生产;而晾晒通常为干燥设备故障或小规模生产企业为节约生产成本时采用。此外,由于本研究采用的是5年生、主根最大直径为1.3~2.4 cm的人参,经综合考虑后,以指纹图谱相似度及人参皂苷Rg1、Re、Rb1含量为指标,蒸制温度(A)、蒸制时间(B)、干燥方法(C)为考察因素,采用 L16(43)正交试验对红参炮制工艺进行优化,因素与水平见表5,试验方案设计与结果见表6,极差及方差分析结果见7、表8。
由表7、表8可知,蒸制温度是红参炮制工艺的主要影响因素(P<0.05),其次为干燥温度、蒸制时间(P>0.05),即对指纹图谱相似度影响大小依次为A>C>B,对人参皂苷Rb1含量因素影响大小依次为A>B>C,即随着蒸制温度的增高,其含量呈上升趋势;人参皂苷Rg1、Re含量因素影响大小依次为B>C>A,即蒸制时间越长含量越低(极差及方差分析结果略)。
2.3.2 最优炮制工艺的确定 正交设计各项试验所得人参皂苷含量均符合2015年版《中国药典》(一部)规定[1],故以指纹图谱相似度(与对照指纹图谱进行比较)为评价指标进行分析。结果,最优炮制工艺为A2B3C3,即100 ℃蒸制150 min,60 ℃干燥至水分在12%以内[2015年版《中国药典》(一部)规定炮制品水分控制在12%以内[1]]。
2.3.3 验证试验 取人参刷洗去泥,约6 kg,分成3份,每份约2 kg,分别按“2.2.2”项下最优炮制工艺进行炮制,得3批最优炮制品(编号:样1~样3),按“2.1”项下方法绘制HPLC指纹图谱,按“2.2”项下定量分析方法测定人参皂苷Rg1、Re、Rb1的含量。结果,3批红参炮制品人参皂苷Rg1、Re、Rb1的含量分别为0.26%~0.29%、0.17%~0.20%、0.47%~0.54%,均符合2015年版《中国药典》(一部)的要求;所得指纹图谱与对照图谱相似度均在0.970以上,详见表9、图4。
2.4 聚类分析
为评价最优炮制工艺的可靠性,以人参皂苷Rg1、Re、Rb1含量及相似度评价数据为变量,采用SPSS 19.0软件,通过Ward联结法以平方Euclidean距离为度量标准区间,对10批红参及3批最优炮制品进行聚类分析,详见图5。结果,13批样品可聚为两类,HS3~HS10聚为一类,样1~样3、HS1、HS2聚为一类。
3 讨论
有研究发现,不同炮制工艺条件对红参的物质组成及含量有显著的影响,但因评价指标不同,使得优选工艺参数具有多样性[8-9,11-13]。人参经炮制后,人参总皂苷含量呈现不同程度的升高,红参中除有与鲜人参、生晒参共有的皂苷类成分人参皂苷Rg1、Re、Rb1外,还有一些含量较低的特有的皂苷类成分,如人参皂苷Rg6、F4、Rk3、Rh4等[14-15]。因此,以人参皂苷类成分的含量结合药材的指纹图谱更能反映人参炮制后红参中的物质组成和变化。
中药指纹图谱作为中药材真伪鉴别及质量控制的有效手段,现已成为国内外常用的中药质量评价模式[16-17]。红参是大宗贵重药材,应用广泛,其质量优劣与临床疗效密切相关[2,14]。本研究建立了红参成分的HPLC指纹图谱,并将其用于红参炮制工艺的质量评价,根据峰面积、指纹图谱相似度的波动情况,提示不同工艺参数对红参炮制品的质量具有一定的影响。本研究经正交试验设计得到最佳炮制工艺为100 ℃蒸制150 min,60 ℃干燥。有工艺研究报道,红参蒸制时间为3~6 h不等[8,11-13],而本研究所得的最优炮制工艺不仅大大缩减了炮制时间、降低了工艺成本,还能有效地保证工艺的稳定,以最优炮制工艺得到的样品与目前市场上的优质红参质量一致(指纹图谱相似度大于0.9)。聚类分析结果显示,10批红参及3批最優炮制品可聚为两类,HS3~HS10聚为一类,3批最优炮制品与HS1、HS2聚为一类,该结果进一步证实指纹图谱技术可用于红参的炮制工艺优化,能表征红参炮制工艺参数波动与药材整体质量变化的相关性,所得最优炮制工艺合理可行。
综上所述,本研究所建指纹图谱可用于红参的炮制工艺优化,所得最优炮制工艺合理可行。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:153-154.
[ 2 ] 楚楚,陈岑,李行诺,等.红参炮制对质量影响的研究进展[J].中药材,2014,37(5):901-905.
[ 3 ] QI LW,WANG CZ,YUAN CS,et al. American ginseng:potential structure-functionrelationship in cancer chemoprevention[J]. Biochem Pharmacol,2010,80(7):947- 954.
[ 4 ] SOHN SH,KIM SK,KIM YO,et al. A comparison of antioxidant activity of Korean white and red ginsengs on H2O2-induced oxidative stress in HepG2 hepatomacells[J]. J Ginseng Res,2013,37(4):442-450.
[ 5 ] 孙娜,徐刚,徐珊,等.人参炮制对其化学成分和药理作用的影响[J].中国药房,2016,27(6):857-859.
[ 6 ] 张颖,郝颖,杨立曼,等.不同蒸制工艺对红参中人参皂苷类成分的影响[J].中国实验方剂学杂志,2013,19(21):16-20.
[ 7 ] 郑重,宋凤瑞,刘淑莹,等.人参、红参皂苷类成分指纹图谱研究[J].质谱学报,2012,33(6):327-333.
[ 8 ] KIM DK,BAIK MY,KIM HK,et al. Standardization of ginseng processing for maximizing the phytonutrients of ginseng[J]. Food Sci Biotechnol,2013,22(1):221-226.
[ 9 ] 王敏,刘永利,段吉平,等.红参药材与饮片质量评价研究[J].中国药事,2017,31(6):647-652.
[10] 国家食品药品监督管理局.中药注射剂安全性再评价质量控制评价技术原则:试行[EB/OL].(2010-10-22)[2019-
05-06]. http://news.pharmnet.com.cn/news/2010/10/22/
308675.html.
[11] 李卓艳,李德坤,周大錚,等.正交试验法优选红参加工工艺[J].中成药,2011,33(6):1005-1007.
[12] 孙慕白,金竺.红参炮制工艺及质量研究[J].长春中医药大学学报,2014,30(4):611-613.
[13] CHOI KH,KWAK YS,RHEE MH,et al. Effects of pH and high temperature treatment on the changes of major ginsenosides composition in Korean red ginseng water extract[J]. J Ginseng Res,2008,32(2):127-134.
[14] 周秋秋,任谓明,王艳红,等.红参的炮制、化学成分及药理活性研究进展[J].上海中医药杂志,2016,50(2):97- 100.
[15] 周琪乐,徐嵬,杨秀伟,等.中国红参化学成分研究[J].中国中药杂志,2016,41(2):233-249.
[16] 刘江,陈兴福,邹元锋.基于中药指纹图谱多维信息的化学模式识别研究进展[J].中国中药杂志,2012,37(8):1081-1088.
[17] LIU MQ,WU YJ,HUANG SS,et al. Spectrum-effect relationship between HPLC fingerprints and hypolipidemic effect of Curcuma aromatica[J]. Biomed Chromatogr,2018. DOI:10.1002/bmc.4220.
(收稿日期:2019-09-29 修回日期:2020-03-07)
(编辑:陈 宏)
