药物临床试验伦理审查质量风险的管理研究
2020-06-09于浩潘岩武志昂薛薇李可欣
于浩 潘岩 武志昂 薛薇 李可欣


中圖分类号 R969.4;R-052 文献标志码 A 文章编号 1001-0408(2020)10-1153-05
DOI 10.6039/j.issn.1001-0408.2020.10.01
摘 要 目的:为提高我国药物临床试验伦理审查质量、保障受试者权益提供参考。方法:以风险管理理论为指导,运用文献研究法、专家意见法和层次分析法对药物临床试验伦理审查流程进行梳理,提取并确定影响伦理审查质量的风险因素及其权重,并对我国药物临床试验伦理审查工作提出改进建议。结果与结论:构建的药物临床试验伦理审查风险指标体系包括5个方面共31个影响因素,其中影响药物临床试验伦理审查质量的5个方面的重要性(权重)排序依次为医学伦理委员会的自身建设(0.263 5)、审查会议的管理(0.251 4)、跟踪审查(0.194 5)、审查申请的受理与处理(0.189 2)、文件档案的管理(0.101 4);权重较高的影响因素包括“讨论投票过程利益冲突人员回避(0.078 7)”“对方案修改、知情同意修改、严重不良事件等情形及时审查或召开会议讨论(0.070 5)”“明确伦理审查工作流程及时间并对外公示(0.059 8)”“统一、规范的审查标准与批准标准(0.052 1)”等。建议可通过讨论投票环节利益冲突人员予以回避,对方案修改、知情同意修改、严重不良事件等情形及时审查或召开伦理会议讨论,明确伦理审查工作流程及时间,建立统一、规范的审查标准和批准标准等方式提高药物临床试验伦理审查的质量。
关键词 药物临床试验;伦理审查;风险管理;层次分析法;专家意见法
Study on Quality Risk Management of Ethical Review of Drug Clinical Trials
YU Hao1,PAN Yan1,WU Zhiang1,2,XUE Wei3,LI Kexin3(1. School of Business Administration, Shenyang Pharmaceutical University, Shenyang 110016, China; 2. Beijing Yidu Zhengkang Health Technology Co., Ltd., Beijing 100055, China;3. Beijing Hospital Clinical Trial Center, Beijing 100083, China)
ABSTRACT OBJECTIVE: To provide suggestions for improving the quality of ethical review of drug clinical trials in China and protecting the rights and interests of subjects. METHODS: Guided by risk management theory, the literature research method, expert opinion method and analytic hierarchy process method were used to sort out the ethical review process of drug clinical trials, extract and determine the risk factors that affect the quality of ethical review, and determine the weight of each risk factor. Suggestions were put forward improving the ethical review of drug clinical trials in China. RESULTS & CONCLUSIONS: Established ethical review risk index system of drug clinical trials included 31 influential factors of 5 aspects; the order of importance (weights) of 5 aspects affecting the quality of ethical review of drug clinical trials was as follows: the construction of the medical ethics committee (0.263 5), the management of review meetings (0.251 4), follow-up review (0.194 5), the acceptance and processing of review applications (0.189 2), and the management of documents and files (0.101 4). The influential factors with high weight included “withdrawal of people with conflict of interest in the discussion and voting process (0.078 7)”“timely review or conference discussion of scheme modification, informed consent modification, serious adverse events, etc. (0.070 5)”“clarification and external exhibition of the work process and time of ethical review (0.059 8)”“unified and standardized review standards and approval standards (0.052 1)”, etc. The quality of ethical review can be improved by avoiding people with conflict of interest in the discussion and voting process, timely reviewing or holding ethics meetings on scheme modification, informed consent modification, serious adverse events, etc., clarifying the working process and time of ethical review, and establishing unified and standardized review standards and approval standards.
KEYWORDS Drug clinical trials; Ethical review; Risk management; Analytic hierarchy process; Expert opinion method
药物临床试验是验证新药安全性和有效性必不可少的步骤,也是新药研发和注册的关键环节。为了证明某种新药的疗效和安全,在经动物实验、机制研究证明有效后,必须要进行人体试验来进一步验证,因此需要相关人员来承担临床试验所造成的风险。为保护临床试验中受试者的安全和权益,我国《药物临床试验质量管理规范》明确指出,需成立独立的医学伦理委员会,试验方案需经该委员会审核通过并签署批准意见后方可实施[1]。由此可见,医学伦理委员会的工作对于保障受试者权益具有重要意义。目前,由于各医学伦理委员会对法规、指导文件的理解不一,缺乏标准的操作规程,审查的尺度和质量存在较大差异[2]。因此,本研究拟在风险管理理论的指导下,通过对医学伦理委员会的伦理审查流程进行梳理,总结提取影响伦理审查质量的风险因素,以期对提高我国药物临床试验伦理审查质量、保障受试者权益提供参考。
1 基本理论、概念与研究方法
1.1 基本理论、概念
1.1.1 基本理论 风险管理始于美国,于1930年由美国管理协会首次在保险相关问题的研讨会上正式提出。之后,美国多所大学开始设立风险管理课程,风险管理遂逐步在全球范围内流行并迅速发展,目前已被广泛应用到政府部门和多个商业领域中,包括保险领域、财务管理领域、药物警戒领域、公共健康领域等。2016年,人用药物注册技术要求指导委员会(ICH)颁布了新版《药物临床试验质量管理规范E6(R2)》,并推荐了采用基于风险管理理论开展临床试验[3]。
风险是指在一定条件下,某个不良事件的预期发生概率与实际结果之间不同的频率分布[4]。风险管理的目的在于识别潜在的风险因素并采取相应措施进行有效控制,降低损失发生的可能性和(或)严重性,其基本过程为风险识别、风险评估和风险控制[5]。其中,风险识别是指运用风险管理工具对风险因素进行系统和全面的识别;风险评估是在对风险识别定性分析的基础上,运用统计分析等技术手段对风险主体发生的风险及概率进行定量分析;风险控制是对可能面临的风险按照其风险发生概率的大小制定相应的风险应对策略,对风险进行防范和控制。
1.1.2 主要概念 本研究涉及的主要概念界定如下——伦理审查质量:伦理审查保障受试者安全和权益的程度;伦理审查质量风险:使得伦理审查质量受损的各种因素。
1.2 研究方法
以风险管理理论为指导,通过文献研究和专家意见法识别影响伦理审查质量的风险,构建风险指标体系;采用Yaahp V12.4软件,应用层次分析法对各风险指标进行评估,结合专家问卷咨询结果,计算各风险指标的权重,进而提出提升伦理审查质量风险管理水平的具体建议。
采用SPSS 22.0软件对调查问卷结果进行数据统计分析,主要包括描述性统计分析、信度分析以及效度分析。
2 临床试验伦理审查风险因素的提取
以“临床试验伦理审查” “质量管理”“风险管理”“Clinical trial ethics review”“Quality management”“Risk management”等为中英文关键词,在中国知网、万方数据、PubMed等数据库进行交叉检索,检索时限均为2009年1月-2019年12月,共检索到相关文献43篇。排除与伦理审查质量相关度不高或无关的文献后获得中文文献12篇、英文文献2篇。运用风险识别分析方法中的流程图分析法,通过文献研读梳理伦理审查工作流程,从医学伦理委员会的自身建设[6-9]、审查申请的受理与处理[10-11]、审查会议的管理[12-14]、跟蹤审查[15-16]和文件档案的管理[17-19]等5个方面初步提取影响药物临床试验伦理审查质量的影响因素,结果见表1。
3 药物临床试验伦理审查风险因素及权重的确定
3.1 问卷调查方案
本研究共开展两轮问卷调查,均通过问卷星平台发放。第1轮采用李克特量表法设计调查问卷,将初步拟定的各风险因素的回答设计为“非常重要”“重要”“一般”“不重要”“非常不重要”等5个选项,并分别以“5、4、3、2、1分”为上述5个选项计分。通过对影响伦理审查质量的风险因素进行专家论证,确定风险因素。第2轮运用风险评估方法中的层次分析法,将专家论证过的各因素进行两两比较,以确定各风险因素的权重。
3.1.1 调查对象 本研究主要选取药品监管部门、医疗机构、医药企业、合同研究组织、临床机构管理组织等从事伦理审查或药物临床试验工作、本科及以上学历并对伦理审查比较了解或非常了解的专家为调查对象。主要包括医学伦理委员会委员、研究者、临床监察员、临床协调员、稽查员等。
3.1.2 问卷样本量的确定 为确保问卷调查具有统计学意义,需要确定问卷调查的样本量大小。样本容量(N)的计算公式为:N=[Z 2P(1-P)]/E 2。式中,Z为统计量,P为概率值,E为采样误差值[20]。
为保证结果的有效性,令P=0.5,则P(1-P)=0.25。设定样本置信区间为90%,抽样误差范围在±15%以内,查询Z统计分布表可得Z=1.65,带入公式得N=30.25,因此本研究需要31份问卷,方可使样本置信度达90%,误差范围小于15%。
3.2 应用专家意见法对风险指标进行确认
第1轮调查共发放问卷79份,回收有效问卷70份,问卷回收率为88.6%。其中,合同研究组织30人(42.9%),医疗机构16人(22.9%),医药企业13人(18.6%),临床机构管理组织7人(10.0%),药品监管部门及其他机构4人(5.7%);本科学历41人(58.6%),硕士学历28人(40.0%),博士及以上学历1人(1.4%)。运用SPSS 22.0软件对问卷进行描述性分析及信效度分析。描述性分析结果显示,所有风险指标的评分均值均大于4,变异系数均小于0.25,说明各风险指标均是影响伦理审查质量的重要风险因素,且各专家对风险指标重要性评价的分歧较小[21]。信度分析结果显示,问卷的Cronbachs α系数为0.956,说明问卷信度良好,具有较高的稳定性和一致性[22]。经分析,删除“参与伦理审查认证体系项目,如美国人体研究保护项目认证协会认证、医学伦理审查委员会能力拓展战略方案认证、中医药研究受试者保护体系评估认证”这项风险指标,问卷的信度得到显著提高,故删除该指标。采用因子分析法计算问卷的效度,结果KMO值为0.824,表明本研究问卷有效性和准确度良好[23]。后又根据专家意见对风险指标进行修正,得到药物临床试验伦理审查质量风险指标体系,详见表2。
3.3 应用层次分析法对风险指标的权重进行分析
3.3.1 层次结构模型构建 采用Yaahp V12.4软件对上述风险指标构建层次结构模型。其中,目标层为药物临床试验伦理审查质量风险,准则层共计5项风险指标,方案层共计31个风险要素。
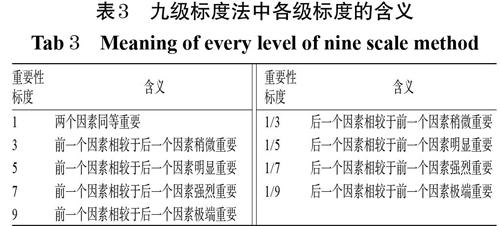
3.3.2 构造判断矩阵 以建立的层次结构模型为依据构造判断矩阵,采用九级标度法,取1、3、5、7、9、1/3、1/5、1/7、1/9共9个等级标度[24],详见表3。邀请专家对上述风险指标的相对重要程度进行评估,计算各风险指标的权重。
3.3.3 各风险因素权重的确定 第2轮调查共发放问卷41份,回收有效问卷33份,问卷回收率为80.5%。其中,合同研究组织 12人(36.4%),医疗机构9人(27.3%),临床机构管理组织5人(15.2%),医药企业4人(12.1%),药品监管部门及其他3人(9.1%);本科学历15人(45.5%),硕士学历17人(51.5%),博士及以上学历1人(3.0%)。将33份专家问卷结果录入到Yaahp V12.4软件中,经软件自动调整一致性后,所有专家问卷均通过了一致性检验。将通过一致性检验的专家问卷输入层次结构模型中,得到各风险因素对总目标的权重,详见表2。
4 分析与讨论
4.1 准则层因素对目标层的权重
药物临床试验伦理审查质量风险各影响因素的重要程度依次为:医学伦理委员会的自身建设>审查会议的管理>跟踪审查>审查申请的受理与处理>文件档案的管理。由此可见,医学伦理委员会的自身建设环节对伦理审查质量具有重要的影响,值得重点关注;文件档案的管理相对其他环节的风险权重最低,反映出目前的伦理审查流程在文件档案管理方面做得相对较好。
4.2 方案层因素对目标层的权重
方案层共31个风险因素,取权重前40%的因素共计12个,重要程度依次为:讨论投票过程利益冲突人员回避>对方案修改、知情同意修改、严重不良事件等情形及时审查或召开会议讨论>明确伦理审查工作流程及时间并对外公示>统一、规范的审查标准与批准标准>制定医学伦理委员会培训制度,定期接受伦理审查知识及相关法律法规培训>确保送审文件的完整性、有效性>加强与受试者交流,重视受试者反馈,建立反馈机制>对伦理审查意见进行充分讨论>制定医学伦理委员会委员及伦理秘书的准入制度以及根据项目类别和风险大小合理选择伦理审查方式>医学伦理委员会委员的独立性>对伦理审查申请的相关事宜作出明确规定,明确送审渠道及送审文件。其中,属于医学伦理委员会自身建设环节的因素有4个,属于审查申请的受理与处理环节的有3个,属于审查会议的管理环节的有3个,属于跟踪审查环节的有2个。这些均为影响伦理审查质量的重要因素,应予以高度重视。此外,文件档案的管理环节各因素风险虽然相对较低,但也不容忽视。
5 建议
5.1 医学伦理委员会的自身建设环节
医学伦理委员会是伦理审查的主体机构,其成功组建是确保伦理审查能够有效开展的基本保障,其中,应特别关注以下问题:(1)规范医学伦理委员会工作流程及时间并对外公示。规范的医学伦理委员会工作流程及时间将有助于伦理审查工作的有序进行并提高审查效率,便于申请人能够及时掌握伦理审查动态,如建立医疗机构医学伦理委员会官方网站,明确告知审查流程及伦理审查文件受理时间、审查时间、审查后发放批件时間等。(2)制定医学伦理委员会培训制度。伦理知识以及伦理审查评价方法都是与时俱进的,医学伦理委员会可根据国际相关指南标准,结合国内实际情况,制定伦理委员的入职培训与继续教育培训相结合的多样化、多层次的培训体系,并在培训完成后进行考核,以了解委员掌握知识的真实状况。(3)制定伦理委员及伦理秘书的准入制度。通过建立统一的任职资格标准,对伦理委员进行资格认证,资质未达要求的人员不予聘任。(4)确保伦理委员的独立性。利益冲突有时无法避免,但可通过优化伦理委员的构成确保委员独立性的最大化。例如,可聘请退休资深专家或机构外权威专业人员担任委员会主席,并保证委员组成比例适当,应既包括本机构的医学专家,也包括机构外医学伦理学、社会学、心理学、法学等相关专家以及社区代表[25]。
5.2 审查申请的受理与处理环节
伦理审查申请的受理与处理是伦理委员对研究项目开展审查的初始阶段,伦理秘书或相关工作人员需确保文件质量并合理选择审查方式,应注意以下几个方面:(1)确保送审文件完整有效。申请人将伦理审核文件送审后,秘书或相关工作人员应依照审查清单逐一核对文件,检查文件的完整性、有效性、合法性;若需补充修改,应立即告知申请人修改内容并明确送审截止日期。(2)合理选择审查方式。伦理审查方式主要包括会议审查、快速审查和紧急会议审查,伦理委员需根据项目类别和风险大小选择会议审查或快速审查的方式,而对于研究过程中出现危及受试者安全的严重问题或其他需紧急处理和决定的情况则需采取紧急会议审查。(3)对伦理审查申请的相关事宜作出明确规定。医学伦理委员会应在事前制定申请人送审操作须知,明确申请文件类型、文件格式要求、送审渠道等,避免申请人因文件准备不充分或格式不符合要求等而反复修改。
5.3 审查会议的管理环节
审查会议时间有限且任务繁重,如何管理好审查会议至关重要。在审查会议过程中需注意以下几个问题:(1)参会委员若与审查项目存在利益冲突应提前声明,讨论投票过程中利益冲突人员应主动回避,保证投票过程的民主与公正。(2)建立统一、规范的审查标准和批准标准。目前我国虽已颁布了一系列法规及指导原则,但如何将其应用到具体的实践操作中,各个医学伦理委员会都有不同的标准。建议应制定研究项目启动前、进行中和结题后各环节的统一、规范的审查标准,使伦理审查过程有据可依,尽量避免因不同医学伦理委员会标准不一所致的审查结果不同的现象。(3)对伦理审查意见进行充分讨论。申请人在汇报研究项目后,会议主持人应组织各委员积极发言;当出现审查意见不一致时,与会委员应积极发表自己的意见,必要时可向相关研究方面的专家进行咨询,确保所提意见被及时讨论解决。
5.4 跟踪审查环节
跟踪审查是指医学伦理委员会根据一定的标准操作规程对通过初始审查的研究项目所进行的持续的监督、审查及评价。跟踪审查需注意以下问题:(1)当出现方案修改、知情同意修改、严重不良事件等情形时,应及时审查或召开伦理审查会议讨论。在临床试验过程中,受多方因素影响,可能会出现试验方案修改、知情同意修改、严重不良事件、受试者退组等情况,医学伦理委员会需建立标准操作规程,及时进行审查,对试验的进展、风险与受益进行持续性评估,保证研究项目安全、有效地开展,并确保受试者的利益不受侵害。(2)建立受试者反馈机制。在美国,医学伦理委员会的一项重要工作任务就是倾听受试者的抱怨、疑惑、担忧等[16]。建议我国可借鉴其经验,构建受试者反馈机制,指派专人负责与受试者沟通交流,了解受试者现状,及时协助其解决问题。
5.5 文件档案的管理环节
档案归档的过程真实地反映了医学伦理委员会的运行情况和伦理审查的经过,档案不仅是试验过程中最真实、最可靠的依据资料,而且也包括受试者的个人信息和隐私。因此,需健全档案资料管理制度,统一规范文件的收集、整理、归档、保存、查阅、销毁等步骤,确保文件安全完整,符合规范。本研究中,该环节总体权重较低,反映了当前文档管理的总体状态良好、风险较低,但从长远来看,该项工作仍应予以持续关注。
6 结语
本研究运用文献研究法和专家意见法确立了药物临床试验伦理审查质量的风险因素,运用层次分析法确定了各风险因素的权重,并对权重较高的因素提出针对性的风险防控建议。本研究所建立的风险指标体系有助于明确伦理审查工作质量的改进重点,有助于风险管理效果的提升。但因笔者调查时间以及人脉资源有限,调查问卷数量相对较少,较难向更多权威专家进行咨询,可能对调研结果造成一定影响,因此所建风险指标体系有待后续实践进一步验证。
参考文献
[ 1 ] 国家食品药品监督管理局.药物临床试验质量管理规范[S].2003-09-01.
[ 2 ] 吕丽娜,熊楠楠,常运立,等.完善医学伦理委员会工作机制的思考[J].医学与社会,2012,25(2):26-28.
[ 3 ] 肖亮,郑高哲,黄瑜敏.临床试验基于风险的管理研究进展[J].中国临床药理学与治疗学,2017,22(8):955-960.
[ 4 ] 王周伟.风险管理[M].北京:机械工业出版社,2012:3.
[ 5 ] 任佳伟,张若明,张象麟.药物临床试验机构备案制对药物Ⅰ期临床试验质量影响的风险管理研究[J].中国新药杂志,2019,28(3):319-324.
[ 6 ] RAVINDRA BG. Institutional review boards:challenges and opportunities[J]. Perspect Clin Res,2014,5(2):60-65.
[ 7 ] 余中光,冯力,李素娟,等.医学伦理审查管理中存在的问题及发展建议[J].中国医学伦理学,2017,30(2):158- 161.
[ 8 ] 武敏,高敬龙.药物临床试验伦理质量管理持续改进实践[J].中国医学伦理学,2015,28(5):769-771.
[ 9 ] 王晨,姚铁男,白彩珍.药物临床试验伦理审查中的风险与防范[J].中华医院管理杂志,2011,27(9):684-688.
[10] 白桦,孙燕,宋亚京,等.影响伦理审查速度的因素分析[J].中国医学伦理学,2016,29(3):465-468.
[11] 胡晋红.医院伦理委员会标准操作规程[M].北京:化学工业出版社,2015:54-57.
[12] 訾明杰,翁维良,高蕊,等.试析伦理审查会议中的常见问题[J].中国医学伦理学,2013,26(5):562-564.
[13] 师明阳,闫冬,任萍.医院伦理委员会会议审查工作实践和启示[J].医学与哲学(A),2018,39(11):15-16、31.
[14] IVOR AP. How do IRB members make decisions: a review and research agenda[J]. J Empir Res Hum Res,2011,6(2):31-46.
[15] 吴柳娟,周建国,柳龚堡.戴明环循环法在医学伦理跟踪审查工作中的应用[J].医学与社会,2018,31(6):43- 45、48.
[16] 張雪,尹梅,刘丹茹.伦理审查委员会跟踪审查制度探析[J].医学与哲学(A),2012,33(4):26-27、51.
[17] 郜翀,李红英.机构伦理委员会文件材料“档案化”管理探讨[J].医学与哲学(A),2018,39(2):32-34、76.
[18] 柴怡,张馥敏,孙宁生,等.浅谈药物临床试验伦理审查中的文件管理[J].中国药物警戒,2011,8(7):413-415.
[19] 苏勃.浅析如何加强伦理审查工作中档案材料的管理[J].兰台世界,2015(17):78-79.
[20] 刘晶晶,武志昂.建立我国药品专利链接制度的专家调查研究[J].中国新药杂志,2016,25(11):1206-1211.
[21] 张丁丁.描述性统计分析及SPSS实现[J].协和医学杂志,2018,9(5):447.
[22] 杨再运.信度分析在环境问卷中的应用研究[J].现代工业经济和信息化,2015,5(21):101-103.
[23] 黄薇,张澜.高中心理健康教育课的实施现状调查量表的编写及应用[J].科技创新导报,2015,12(19):218-220.
[24] 王雷.商业银行操作风险影响性评级模型研究[J].经济问题,2011(7):100-104、126.
[25] 邵蓉,楼洪刚,杨丹丹,等.临床研究伦理审查现状及其问题探讨[J].中国肿瘤,2015,24(10):830-833.
(收稿日期:2020-01-09 修回日期:2020-04-13)
(编辑:孙 冰)
