青藤碱衍生物的合成及其体外抗炎活性研究
2020-06-09李修政赵庆杰卓小斌董家潇严佳栋
李修政,赵庆杰,卓小斌,董家潇,严佳栋*
(1.苏州大学附属张家港医院,江苏 苏州 215000; 2.第二军医大学药学院,上海 200433)
青藤碱(sinomenine,SIN)又名(9α,13α,14α)-7,8-didehydro-4-hydroxy-3,7-dimethoxy-17-methylmorphinan-6-one,是一种从天然植物青风藤或毛青藤的根和茎中提取的有效成分,临床上主要用于治疗风湿及类风湿性关节炎[1],在中国和其它亚洲国家或地区已有一千多年的应用历史。近年来,随着科研人员的不断探索,发现其还具有免疫调节、抗肿瘤、抗心律失常、器官损伤后保护作用等功效[2-5]。然而,青藤碱的诸多缺点,如透皮吸收差、生物利用度低、生物半衰期短、给药剂量大、释放组胺时刺激细胞等,会导致患者用药时产生皮疹、白细胞减少、过敏性休克和胃肠道反应[6-10]等副作用,虽然经过改良的给药剂型可以大大减小副作用,但不能彻底解决生物利用度低和半衰期短的问题[11]。为了改变这一现状,科研人员对天然产物青藤碱的结构进行修饰,并在近几十年取得了丰硕的成果,但对于临床的普遍使用还需进一步的探索发现。
本研究的设计思想是基于计算机辅助系统模拟青藤碱与蛋白活性腔的结合情况[11],发现青藤碱发挥作用的结合位点主要是A环、6位羰基、17位氮甲基等位置(图1)。通过以上模拟的结合位点,以盐酸青藤碱为起始化合物,在A环1位引入疏水性基团,目的是增强青藤碱母核与模拟的蛋白活性腔内的氨基酸位点的范德华力,主要选择一类稳定性较好的芳基基团,进而在芳基上连接不同取代基,旨在增强青藤碱的血脑屏障透过率和与靶蛋白结合的稳定性。基于以上设计思想,作者首先在光和热的条件下使苯环上的自由基发生裂解,所产生的自由离子与引入的芳环上的氢离子结合,得到溴代青藤碱中间体,将该中间体与芳基硼酸发生经典的Suzuki偶联反应,并在引入的芳基上加入各种药效基团,以期增强青藤碱的药理活性。所引入的芳基和青藤碱可以形成稳定的C-C键,使其在进入体内后不易被迅速代谢,从而达到延长半衰期的作用。采用1HNMR、19FNMR、LC-MS等对合成的青藤碱衍生物的结构进行表征,并采用报告基因法研究青藤碱衍生物对NF-κB转录活性的影响。

图1 青藤碱模拟蛋白位点Fig.1 Mimic protein sites of sinomenine
1 实验
1.1 材料、试剂与仪器
薄层层析硅胶(CP),探索平台;薄层层析硅胶板,烟台新诺化工有限公司。
小鼠巨噬细胞系RAW264.7细胞,第二军医大学免疫研究所;脂多糖(LPS)、pGL3.5XκB-Luciferase质粒、pRL-TK-Renilla-Luci-ferase质粒, Sigma-Aldrich中国。
无水K2CO3(AR,批号 20131206),上海沪上试剂有限公司;N-溴代丁二酰亚胺(AR),上海阿拉丁生化科技有限公司;氯仿、二氯甲烷(批号 20170105)、乙醇、石油醚(AR,批号1177673)、乙酸乙酯(AR),上海沃化化工有限公司;氨水,上海麦克林生物技术有限公司;甲苯(批号10022818)、四三苯基膦钯(Pd(PPh3)4,damas-beta)、取代苯硼酸(damas-beta,P1076906)、甲醇(AR,批号20151225),国药集团化学试剂有限公司;青藤碱标准品,上海微晶生物试剂有限公司。
DFY-5L/40型低温恒温反应浴,巩义安宇仪器有限责任公司;2XZ-2型旋片式真空泵,上海维奇真空泵厂有限公司;98-2型磁力搅拌器,上海司乐仪器有限公司;R-3型旋转蒸发仪,Buchi;ME203/02型电子天平,上海阿达玛斯有限公司;KY2360型精密电子天平,上海良平仪器有限公司;85-2型磁力恒温搅拌器,上海志成电器有限公司;分析液相色谱(Reservoir Tray L20304301732 SL),Shimadzu Corporation;OSB-2100型水浴锅、DLSB-H型低温冷却循环泵(-40~-70 ℃)、SHZ-ⅢA型循环水式多用真空泵,上海豫康科教仪器设备有限公司;半制备液相色谱(SPD-10R VP,C2099 42 71354 US),Shimadzu USA Manufacturing Inc;LABCONCO冷冻干燥器,上海实维实验仪器技术有限公司;AS30600BDT型超声波清洗器,上海超声波仪器厂;AC-P300型核磁共振仪、AC-P400型核磁共振仪、AC-P500型核磁共振仪、AC-P600型核磁共振仪,Bruker Spectmspin;ZF-I型三用紫外分析仪。
1.2 青藤碱衍生物的合成
首先通过氨水对盐酸青藤碱(1)进行大量游离,得到青藤碱(2);然后根据文献报道,尝试Wohl-Ziegler 反应,将原料青藤碱与N-溴代丁二酰亚胺(NBS)加热回流6 h,经柱层析纯化,收率仅21%。经改进,将NBS在室温下分两次加入,反应全过程持续6 h,得到收率60%[12]的中间体溴代青藤碱(3),并进行1HNMR确认。将中间体溴代青藤碱(3)和芳基硼酸进行Suzuki偶联反应,最终确定在甲苯-乙醇(1∶1,体积比)、Pd(PPh3)4、K2CO3的条件下反应完全,合成路线见图2。
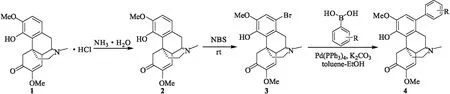
4a~4l,R=3-Me-C6H4,3,5-Me-C6H3,4-CN-C6H4,4-OH-C6H4,3-Ph-C6H4,3,5-tBu-C6H3,2-NH2-C6H4,
1.2.1 青藤碱(2)的合成
称取盐酸青藤碱(1)6.7 g (20 mmol)溶于加有二氯甲烷(DCM)的分液漏斗中,加入适量氨水,将有机相反复萃取3次,合并有机相,经干燥、浓缩,得到白色固体青藤碱(2),收率为97%。
1.2.2 溴代青藤碱(3)的合成
称取青藤碱(2)990 mg(3 mmol)置于100 mL圆底烧瓶中,用20 mL氯仿溶解;加入NBS 293 mg(1.65 mmol),室温搅拌2~4 h,再补加1.65 mmol NBS,全程室温搅拌6 h。经薄层色谱法(TLC)检测反应完全后,加入适量水淬灭反应。用20 mL水反复萃取3次,盐水洗涤,合并有机相,经无水硫酸钠干燥、浓缩,得到褐红色溴代青藤碱粗品。采用干法上样进行柱层析纯化,洗脱剂使用DCM-MeOH(30∶1)从小极性缓慢放大,得到关键中间体溴代青藤碱(3),深黄色粉末,收率为60%。1HNMR(300 MHz,CDCl3),δ:6.94(s,1H),5.45(d,J=1.6 Hz,1H),5.32(s,1H),4.37~4.32(d,J=15.6 Hz,1H),3.84(s,3H),3.52(s,3H),3.31(s,1H),3.10~3.00(m,2H),2.58(dd,J=20.4 Hz、9.1 Hz,2H),2.48(s,3H),2.08 (d,J=4.4 Hz,1H),1.98(d,J=3.3 Hz,2H)。
1.2.3 1-苯甲基青藤碱(4a)的合成
称取溴代青藤碱(3) 200 mg(0.5 mmol)和Pd(PPh3)458 mg(0.05 mmol)置于50 mL单口反应管中,用10 mL甲苯将其溶解,然后将芳基硼酸82 mg(0.6 mmol)(以3-甲基苯硼酸的操作步骤为例,其它芳基硼酸操作步骤相同,但反应时间和催化剂用量适时调整)的乙醇(10 mL)溶液加入到混合液中,最后加入1.1 eq.的K2CO3,回流20 h,整个反应在氮气保护下进行,TLC监测反应完成,加入饱和NaHCO3淬灭,DCM反复萃取3次,无水硫酸钠干燥,合并有机相,浓缩后进行柱层析,用DCM-MeOH(50∶1)洗脱,得到淡黄色固体4a173 mg,收率为82.4%。
同法制备目标化合物4b~4l,包括引入空间位阻较大的芳基,例如萘环、菲环、芘环等。共合成12个青藤碱衍生物。
2 结果与讨论
2.1 青藤碱衍生物的结构表征
采用1HNMR、19FNMR和LC-MS等对目标化合物4a~4l进行结构表征,其收率及表征数据如下:
化合物4a:收率82.4%。1HNMR (400 MHz,CDCl3),δ:7.32~7.28(dd,J=10.6 Hz、4.4 Hz,1H),7.18~7.17(d,J=7.6 Hz,1H),6.98 ~ 6.95(m,2H),6.58(s,1H),5.46~5.45(d,J=1.6 Hz,1H),4.45~4.41(d,J=15.5 Hz,1H),3.80(s,3H),3.55(s,3H),3.39~3.33(d,J=22.2 Hz,2H),2.86~2.83(d,J=11.2 Hz,1H),2.76~2.63(m,2H),2.57~2.53(d,J=15.6 Hz,1H),2.45(s,3H),2.40 (m,3H),2.32~2.25(td,J=11.8 Hz、4.4 Hz,1H),2.13(dt,J= 23.6 Hz、7.9 Hz,2H),2.29 (td,J=11.8 Hz、4.4 Hz,1H),2.18~2.07(dt,J=23.6 Hz、7.9 Hz,2H);LC-MS,m/z:420.71[M+H]+。
化合物4b:收率79.4%。1HNMR(500 MHz,CDCl3),δ:7.00(s,1H),6.79(s,2H),6.56(s,1H),5.47(d,J=1.8 Hz,1H),4.45~4.42(d,J=15.5 Hz,1H),3.79(s,3H),3.55(s,3H),3.29~3.21 (d,J=40.1 Hz,2H),2.77~2.73(m,2H),2.60~2.51(m,2H),2.40(s,3H),2.36(s,6H),2.27~2.17(m,1H),2.10~2.01(m,2H);LC-MS,m/z:434.61[M+H]+。
化合物4c:收率61.6%。1HNMR (400 MHz,CDCl3),δ:7.72~7.70 (d,J=8.2 Hz,2H),7.33~7.31(d,J=8.1 Hz,2H),6.53(s,1H),5.47(d,J=1.7 Hz,1H),4.44~4.40 (d,J=15.5 Hz,1H),3.82 (s,3H),3.55(s,3H),3.27 (s,1H),3.19 (s,1H),2.76~2.65(m,1H),2.64~2.54(m,2H),2.52 (s,1H),2.37 (s,3H),2.16 (td,J=11.5 Hz、4.6 Hz,1H),2.05 (d,J=2.5 Hz,2H);LC-MS,m/z:431.68[M+H]+。
化合物4d:收率39.7%。1HNMR(500 MHz,CDCl3),δ:7.03~7.02(d,J=8.4 Hz,2H),6.87~6.85(d,J=8.4 Hz,2H),6.56(s,1H),5.48 (d,J=1.8 Hz,1H),4.45~4.42(d,J=15.6 Hz,1H),3.80(s,3H),3.53(s,3H),3.20~3,19 (d,J= 3.8 Hz,1H),3.09(s,1H),2.74 (d,J=18.7 Hz,1H),2.64 (dd,J=11.9 Hz、2.5 Hz,1H),2.56~2.47(m,1H),2.36 (s,1H),2.18 (td,J=12.2 Hz、3.3 Hz,1H),2.03(d,J=12.0 Hz,1H),1.97(dd,J=12.6 Hz、4.3 Hz,1H);LC-MS,m/z:422.31[M+H]+。
化合物4e:收率51.3%。1HNMR(400 MHz,CDCl3),δ:8.51(s,1H),8.09~8.05(t,J=9.1 Hz,2H),7.56~7.37(m,4H),7.29~7.26(d,J=8.4 Hz,2H),6.63(s,1H),5.3 (s,1H),4.51~4.47(d,J=15.6 Hz,1H),3.76(s,3H),3.55(s,3H),3.15(s,1H),3.00(s,1H),2.79~2.77(d,J=11.0 Hz,1H),2.59~2.55(d,J=15.6 Hz,1H),2.39(t,J=10.8 Hz,2H),2.29(d,J=19.0 Hz,1H),2.18(d,J=12.6 Hz,1H),2.11(s,3H),2.04(s,1H);LC-MS,m/z:482.31[M+H]+。
化合物4f:收率59.2%。1HNMR(400 MHz,CDCl3),δ:7.42(s,1H),7.02(s,2H),6.62(s,1H),5.44~5.43(d,J=1.5 Hz,1H),4.45~4.41(d,J=15.5 Hz,1H),3.81(s,3H),3.52(s,3H),3.28~3.20(d,J=28.8 Hz,2H),2.79~2.74(m,2H),2.56~2.52(d,J=15.7 Hz,1H),2.50~2.45(m,1H),2.41(s,3H),2.3~2.2 (td,J=11.7 Hz、3.9 Hz,1H),2.11~2.01(m,2H),1.35(s,18H);LC-MS,m/z:518.31[M+H]+。
化合物4g:收率81%。1HNMR(500 MHz,CDCl3),δ:7.20~7.16(td,J=7.8 Hz、1.5 Hz,1H),6.85~6.73(m,2H),6.55~6.54(d,J=6.4 Hz,2H),5.54~5.43(m,1H),4.44~4.35(dd,J= 31.2 Hz、15.6 Hz,1H),3.80~3.78(t,J=4.5 Hz,3H),3.53~3.49(m,3H),3.37(s,1H),3.20~3.08(m,1H),3.03~3.00(m,1H),2.77~2.6 (dd,J=61.7 Hz、18.7 Hz,1H),2.57~2.52(m,2H),2.47~2.38(m,1H),2.27(s,2H),2.18~2.07(m,1H),2.03 (dd,J=21.0 Hz、7.6 Hz,1H),1.92(ddd,J=16.7 Hz、10.3 Hz、3.6 Hz,1H);LC-MS,m/z:482.31[M+H]+。
化合物4h:收率47.4%。1HNMR(400 MHz,CDCl3),δ:7.87(d,J=23.6 Hz,1H),7.65(d,J=18.9 Hz,2H),6.52(s,1H),5.50(s,1H),4.41~4.37(d,J=15.7 Hz,1H),3.79(s,3H),3.47(d,J=21.0 Hz,3H),3.13(s,1H),3.00(s,1H),2.60~2.56(d,J=18.8 Hz,2H),2.48~2.44(d,J=15.7 Hz,1H),2.38~2.32(dd,J=18.1 Hz、4.9 Hz,1H),2.29(s,3H),2.03(d,J=8.6 Hz,1H),1.99(d,J=13.0 Hz,1H),1.94~1.86(m,1H);19FNMR(376 MHz,CDCl3),δ:-62.81(s);LC-MS,m/z:542.21[M+H]+。
化合物4i:收率68.0%。1HNMR(400 MHz,CDCl3),δ:7.38~7.36(d,J=8.3 Hz,2H),7.13~7.11(d,J=8.2 Hz,2H),6.51(s,1H),5.47(s,1H),4.43~4.40(d,J=15.5 Hz,1H),3.79(s,3H),3.53(s,3H),3.11~3.10(d,J=3.8 Hz,1H),3.00 (s,1H),2.67~2.62(d,J=18.5 Hz,1H),2.56~2.52(m,2H),2.43~2.37(dd,J=18.5 Hz、5.3 Hz,1H),2.29(s,3H),2.06~2.00(m,2H),1.89(td,J=12.6 Hz、4.3 Hz,1H);LC-MS,m/z:444.1[M+H]+。
化合物4j:收率80.8%。1HNMR(500 MHz,CDCl3),δ:8.80~8.73(m,2H),7.94~7.88(m,1H),7.72~7.64(m,4H),7.54~7.49(m,1H),7.43~7.40(d,J=7.6 Hz,1H),6.72~6.70(d,J=8.5 Hz,1H),5.41~5.38(dd,J=13.0 Hz、1.7 Hz,1H),4.52~4.47(dd,J=15.4 Hz、6.6 Hz,1H),3.80~3.79(d,J=6.8 Hz,3H),3.62~3.55(d,J=33.8 Hz,3H),3.07~3.06(m,2H),2.74(ddd,J=36.3 Hz、11.9 Hz、2.6 Hz,1H),2.66~2.50(m,1H),2.39(ddd,J=12.9 Hz、9.9 Hz、3.8 Hz,1H),2.26(s,1H),2.15(s,1H),2.05(dd,J=12.5 Hz、4.2 Hz,1H);LC-MS,m/z:506.7[M+H]+。
化合物4k:收率62.2%。1HNMR(400 MHz,CDCl3),δ:8.26~8.20(m,2H),8.16~8.14(d,J=7.9 Hz,1H),8.11(s,2H),8.03~8.00(m,1H),7.89~7.86(dd,J=11.9 Hz、8.6 Hz,1H),7.70~7.66(t,J=7.3 Hz,1H),7.47~7.45(d,J=9.1 Hz,1H),6.76~6.73(d,J=9.8 Hz,1H),5.37(s,1H),4.51~4.47(d,J=15.6 Hz,1H),3.82~3.80(d,J=7.0 Hz,3H),3.67(s,2H),3.55(s,1H),3.24~3.21(d,J=12.5 Hz,1H),3.11~3.08(d,J=13.5 Hz,1H),2.88~2.76(dd,J=39.6 Hz、11.3 Hz,1H),2.60~2.56(d,J=15.5 Hz,1H),2.50~2.38(dt,J=28.6 Hz、14.2 Hz,2H),2.27(d,3H),2.19~2.14(m,2H),2.10~2.09(d,J=3.8 Hz,1H);LC-MS,m/z:530.3[M+H]+。
化合物4l:收率74.5%。1HNMR(300 MHz,CDCl3),δ:8.61~8.47 (m,2H),7.56~7.52 (dt,J=7.8 Hz、1.9 Hz,1H),7.39~7.34 (dd,J=7.8 Hz、4.9 Hz,1H),6.55 (s,1H),5.45~5.45 (d,J=2.0 Hz,1H),4.45~4.40(d,J=15.5 Hz,1H),3.81(d,J=3.2 Hz,2H),3.52(s,1H),3.46(s,1H),3.27(d,J=23.5 Hz,1H),2.74(d,J=11.4 Hz,1H),2.66~2.57(m,1H),2.53(d,J=15.6 Hz,1H),2.38(s,1H),2.26~2.14(m,1H),2.06(dd,J=9.4 Hz、3.5 Hz,1H);LC-MS,m/z:407.21[M+H]+。
2.2 青藤碱衍生物的体外抗炎活性
相关药理学研究表明,青藤碱通过抑制核转录因子(NF-κB)的结合活性来降低TNF-α在mRNA上的表达,在NF-κB参与的炎症反应中起到积极作用,而NF-κB转录因子家族与炎症环境中众多基因的表达调控密切相关[11]。采用报告基因法研究青藤碱衍生物对NF-κB转录活性的影响,将RAW264.7细胞转染pGL3.5XκB-Luciferase报告基因24 h后,将预先加入药物青藤碱及其衍生物(5 μL、10 μL·mL-1)处理3 h后,加入LPS(1 μL·mL-1)刺激6 h,可见LPS显著增强NF-κB转录活性,同时设立空白对照组和只加入LPS的对照组。采用荧光素酶检测法(Luciferase Assay)进行检测,记录并分析数据。最后用TK报告基因校正,进行数据处理,结果见表1。
由表1可知,所合成的青藤碱衍生物对NF-κB的转录活性均有一定的体外抑制作用。
表1 青藤碱衍生物对LPS诱导的NF-κB转录活性的影响

Tab.1 Effect of sinomenine derivatives on the transcription activity of NF-κB induced by LPS
2.3 讨论
从最初的计算机与蛋白P50的活性腔模拟位点入手,发现青藤碱与蛋白结合不稳定(图3a),这可能是青藤碱存在诸多缺点的原因之一。我们成功设计并合成了一系列新型青藤碱衍生物,并初步评价了其对LPS诱导的NF-κB转录活性的抑制作用,与青藤碱相比,合成的青藤碱衍生物均在不同程度上提高了青藤碱的抗炎活性。化合物4b和4h的抗炎活性高于其它衍生物(表1),且都是在苯硼酸的间位取代,结合课题组之前的研究,推测在间位取代时青藤碱衍生物可能更容易与蛋白作用靶点结合,或者该衍生物发挥作用时与靶点结合更加稳定。为了解释这个结果,课题组将间位取代的衍生物与蛋白P50进行对接模拟(图3b),结果显示,青藤碱结构骨架与蛋白活性腔的氨基酸主要集中在精氨酸(Arg-154、Arg-161)、谷氨酸(Glu-157)、酪氨酸(Tyr-163)区域,而间位取代的青藤碱衍生物与Tyr-163有较稳定的结合,形成π-π共轭体系,使整体结构更加稳定,从而提高生物活性,延长半衰期。另外,通过化合物4j、4k,并结合之前的研究发现,在1位引入大基团,青藤碱衍生物的抗炎活性不断降低,表明空间位阻对该结构有一定的影响。通过其它衍生物的性质可以发现,芳环上所连接的电子基团的性质,对药物的脂水分配系数、与靶点形成氢键的能力等都密切相关。在后续研究中,可以更加清楚地探讨炎症与取代基之间的构效关系,为青藤碱的广泛应用和机制研究提供参考。

图3 修饰前(a)后(b)结合位点对照图Fig.3 Comparison map of binding sites before(a) and after(b) modification
3 结论
通过计算机辅助系统,模拟青藤碱与蛋白P50活性腔周边对接情况,以盐酸青藤碱为起始化合物,先发生Wohl-Ziegler反应,再通过钯催化的Suzuki偶联反应对其进行修饰,得到12个新型青藤碱衍生物,其结构经1HNMR、19FNMR、LC-MS等表征;采用报告基因法研究青藤碱衍生物对NF-κB转录活性的影响。12个青藤碱衍生物对NF-κB的转录活性均有一定的抑制作用,且抗炎活性优于青藤碱对照品。对青藤碱A环1位进行修饰可以提高抗炎活性,证明该作用靶点可进行深入探讨研究。
