非达霉素的HPLC快速检测方法
2020-06-09王海燕高月麒任风芝李晓露张雪霞
林 旸,王 月,王海燕,高月麒,任风芝,李晓露,张雪霞
(华北制药集团新药研究开发有限责任公司 微生物药物国家工程研究中心河北省工业微生物代谢工程技术研究中心,河北 石家庄 050015)
非达霉素(Fidaxomicin)是一种十八元环结构的新型大环内酯类抗生素,属于窄谱型抗菌药物[1-2]。其抗菌作用机理新颖,通过抑制RNA聚合酶对抗艰难梭菌,能针对性地杀灭艰难梭菌,使肠道菌群恢复正常,从而降低艰难梭菌感染复发率[3]。与治疗艰难梭菌感染的传统药物万古霉素相比,非达霉素具有更强的疗效和更低的复发率,而且该药物交叉耐药性低,不良反应少,目前临床试验中尚无非达霉素耐药性的报道[4-6]。
非达霉素通过桔橙指孢囊菌发酵而得,属于B类台勾霉素,主要通过微生物发酵生产[7]。在菌种选育、发酵提取过程中,往往有大量样品需要检测,而中国药典(2015年版)和美国药典(USP 40)尚未将非达霉素收载。因此,建立快速、准确、精密的分析方法对于非达霉素菌种选育和工艺研究尤为重要。近年来,国内也有少量关于非达霉素定性分析方面的研究报道[8-9],如江宏磊等[9]以甲醇-0.1%甲酸水溶液为流动相进行等度洗脱,非达霉素出峰时间在16~17 min,整个色谱采集周期为30 min,分析时间较长,不能满足大批量样品的处理,而且其线性范围取值较窄,无法准确测定后续样品的含量。基于此,作者采用HPLC法测定非达霉素含量,拟为非达霉素菌种选育、发酵、提取过程样品的含量及相关物质分析提供一种简便、快速、高效的方法。
1 实验
1.1 试剂与仪器
非达霉素发酵液,华北制药集团新药研究开发有限责任公司;非达霉素标准品(含量99.2%)、去离子水,自制;乙腈(色谱纯),美国Merck公司;其它试剂均为国产分析纯。
高效液相色谱仪(SPD-M20A 型紫外检测器,LC-20AT型泵,SIL-20A型自动进样器,CTO-10AS型柱温箱),日本Shimadzu公司;TGL-16G型高速离心机,上海安亭科学仪器厂。
1.2 溶液的配制
1.2.1 标准溶液
精密称取非达霉素标准品25 mg,置于50 mL容量瓶中,乙醇溶解并定容,摇匀,制成0.5 mg·mL-1的非达霉素标准溶液,冰箱内保存,备用。
1.2.2 发酵液供试溶液
发酵液真空抽滤后,得到非达霉素菌丝体。将乙醇加入菌丝体中至发酵液体积,振荡浸泡1 h,离心,浸提液经0.45 μm微孔滤膜过滤,即得发酵液供试溶液。非达霉素为胞内产物,菌丝体中所占比例大于95%,故所测浸提液单位可以视为发酵液中的非达霉素含量。
1.3 色谱条件
Unitary C18色谱柱(4.6 mm×150 mm,5 μm),流动相为乙腈-0.05%乙酸水溶液(55∶45,体积比),流速1.0 mL·min-1,检测波长230 nm,柱温35 ℃,进样量10 μL,进样时间10 min。
2 结果与讨论
2.1 检测波长的确定
称取非达霉素标准品适量,加入甲醇溶解,制成含非达霉素20 μg·mL-1的供试溶液,用紫外分光光度计在200~800 nm范围内扫描,结果如图1所示。

图1 非达霉素的紫外吸收光谱Fig.1 Ultraviolet absorption spectrum of Fidaxomicin
由图1可知,非达霉素在230 nm、266 nm处均有较大吸收峰,其中266 nm处的吸收较弱。因此,选择230 nm作为检测波长。
2.2 检出限和定量限
将非达霉素标准溶液进行逐步稀释后,进样10 μL进行测定。检出限色谱峰信噪比S/N≈3,定量限色谱峰S/N≈10。测得非达霉素的检出限为20 ng(相当于进样量的0.4%),定量限为60 ng(相当于进样量的1.2%)。
2.3 系统适用性
分别精密量取10 μL非达霉素标准溶液、发酵液供试溶液,进样测定,结果见图2。
由图2可知,在该色谱条件下,发酵液供试溶液与非达霉素标准溶液出峰时间一致,峰型良好,表明非达霉素与有关物质可以达到基线分离。
2.4 方法学验证
2.4.1 标准曲线和线性关系
精密称取非达霉素标准品100 mg,置于50 mL容量瓶中,乙醇溶解并定容至刻度,摇匀,然后逐级稀释为浓度0.05 mg·mL-1、0.10 mg·mL-1、0.20 mg·mL-1、0.50 mg·mL-1、1.0 mg·mL-1、2.0 mg·mL-1的非达霉素标准溶液,按1.3色谱条件分别进样,测定峰面积。以峰面积为纵坐标(y)、进样浓度(x,mg·mL-1)为横坐标绘制标准曲线,得回归方程为y=22973.2456x+480175.4222,相关系数R2=0.9991,截距1.0%。表明,非达霉素浓度在0.05~2.0 mg·mL-1范围内与峰面积线性关系良好。
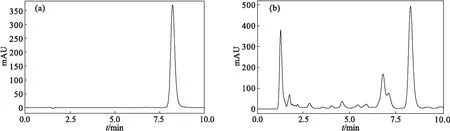
图2 非达霉素标准溶液(a)、发酵液供试溶液(b)的高效液相色谱Fig.2 HPLC spectra of Fidaxomicin standard solution(a) and fermentation broth test solution(b)
2.4.2 重复性
精密吸取同一批次发酵液,按1.2.2方法平行制备6份发酵液供试溶液,按1.3色谱条件进行测定,测得非达霉素峰面积RSD为0.4%。表明该方法重复性好。
2.4.3 精密度
精密吸取同一批次发酵液,按1.2.2方法平行制备6份发酵液供试溶液,由不同分析人员使用不同仪器,连续进样6次,按1.3色谱条件进行测定,测得非达霉素峰面积RSD为0.75%。表明该方法精密度良好。
2.4.4 耐用性
通过微调整柱温、流速、流动相中乙酸含量、波长(表1),考察非达霉素测定结果不受影响的程度。要求不同色谱条件参数下,RSD≤2.0%。
表1色谱条件的变动范围
Tab.1 Range of variation of chromatographic conditions
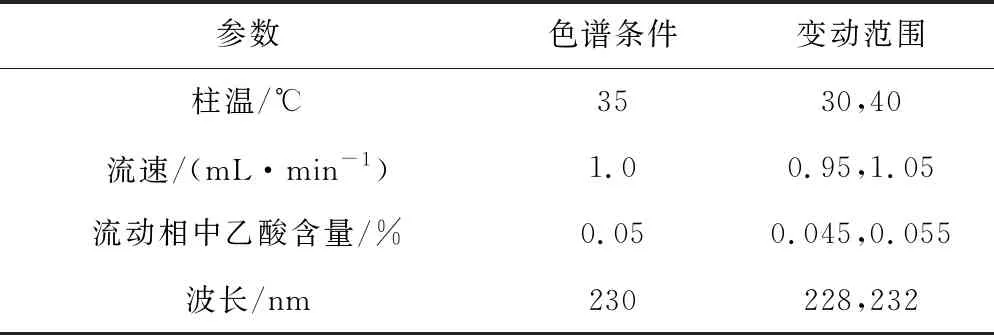
参数色谱条件变动范围柱温/℃3530,40流速/(mL·min-1)1.00.95,1.05流动相中乙酸含量/%0.050.045,0.055波长/nm230228,232
结果发现,改变以上色谱参数时,所测样品浓度几乎不变,柱温、流速、流动相中乙酸含量、波长变化时,RSD分别为0.83%、1.6%、1.6%、1.2%,均符合要求。表明该方法在对色谱参数做微小变动时,非达霉素测定结果所受影响较小。
2.4.5 稳定性
取发酵液供试溶液于室温下保存,每隔2 h取10 μL进行测定,考察供试溶液在24 h内的稳定性。测得非达霉素峰面积RSD为0.27%,表明供试溶液室温下放置24 h稳定。
2.4.6 加标回收率
分别精密称取非达霉素标准品25 mg、50 mg、75 mg各3份,分别置于50 mL容量瓶中,用已知含量的浸提液溶解,各进样10 μL,测定峰面积,结果见表2。
表2非达霉素的加标回收率
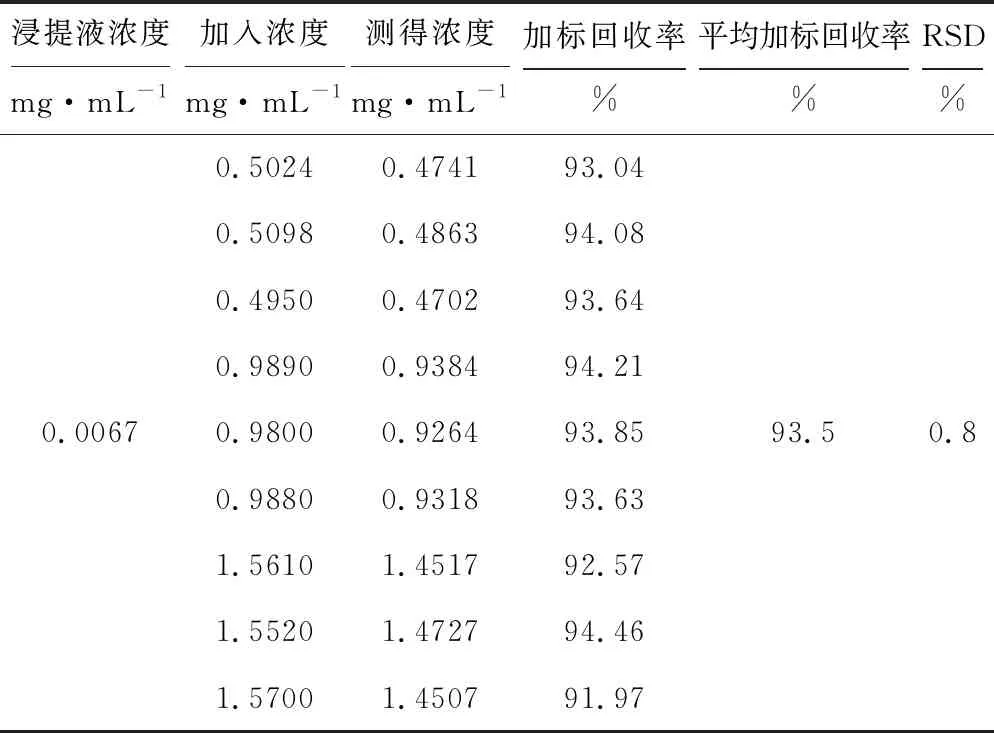
Tab.2 Adding standard recovery of Fidaxomicin
由表2可知,样品平均加标回收率为93.5%,RSD为0.8%。
2.5 非达霉素含量的测定
取3批发酵液供试溶液于样品瓶中,按1.3色谱条件进行测定,发酵液中非达霉素的出峰时间与标准品吻合,与其它有关物质能有效分离。按外标法以峰面积计算非达霉素含量,结果见表3。
表3发酵液中非达霉素含量/(mg·mL-1)

Tab.3 Content of Fidaxomicin in fermentation broth/(mg·mL-1)
3 结论
建立了快速检测非达霉素含量的HPLC方法,并对其进行了方法学验证。结果表明,非达霉素浓度在 0.05~2.0 mg·mL-1范围内与峰面积呈良好的线性关系,相关系数R2=0.9991;样品平均加标回收率为93.5%,RSD为0.8%。该方法精密性、重复性、稳定性、耐用性良好,且操作简单,快速有效,回收率良好,适用于含非达霉素样品的检测,解决了微生物发酵法产生大量样品而检测速度慢的问题,为进一步优化非达霉素生产工艺奠定了基础。
