ROCK通过抑制PI3K/Akt通路促进高糖诱导的心肌细胞凋亡*
2020-06-09朱菊茹韩忠丽杨晓敏
白 雪, 于 慧, 朱菊茹, 韩忠丽, 杨晓敏△
(1包头医学院研究生院,内蒙古包头014040;2包头医学院第二附属医院,内蒙古包头014030)
由Rullber等[1]学者首次于1972年通过尸检证实的糖尿病心肌病(diabetic cardiomyopathy,DCM)是一种独立于高血压、冠心病之外的特异性心肌病,是糖尿病患者心力衰竭高发生率和高死亡率的因素之一[2]。DCM的发病机制复杂,高血糖在DCM的发生进展中起着重要的作用[3-4],不论是在糖尿病的动物模型或糖尿病临床研究中,都证实了糖尿病会增加心肌细胞的凋亡[5-6]。但高糖诱导的心肌细胞凋亡的具体分子机制研究尚不明确。
最新的研究发现,Rho相关卷曲螺旋激酶(Rhoassociated coiled-coil kinase,ROCK)与心肌损伤、心肌细胞的凋亡及心力衰竭相关[7]。在糖尿病动物模型实验或体外心肌细胞研究中,抑制Rho激酶的激活或者下调ROCK的表达,都会抑制病理刺激下的心肌细胞的凋亡[8-9]。有研究报道,DCM的发病进程与蛋白激酶B(protein kinase B,PKB/Akt)信号通路的失活有关[10-11]。激活磷酯酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/Akt信号通路可以保护心肌细胞对抗高糖引起的氧化应激和炎症因子刺激,从而提高细胞存活率[12]。ROCK 与 PI3K/Akt信号通路之间是否存在相应的调控机制从而介导高糖诱导的心肌细胞凋亡将是本研究的重点。
材料和方法
1 实验动物及主要仪器和试剂
Wistar大鼠乳鼠(出生1~3 d)购自北京华阜康生物科技股份有限公司,许可证号为[SCXK(京)2014-0004];低糖DMEM培养液、胎牛血清、Ⅱ型胶原酶和5-溴脱氧尿嘧啶核苷(5-bromodeoxyuridine,BrdU)购自Gibco;抗α-横纹肌肌动蛋白(α-sarcomeric actin,α-SCA)免疫组化试剂盒购自武汉博士德;葡萄糖和DMSO购自Sigma;MTT购自北京博奥拓;TRIzol试剂购自Invitrogen;逆转录试剂和RT-qPCR试剂购自TaKaRa;引物由上海生工合成;ROCK抑制剂Y27632购自MCE;AnnexinV-FITC细胞凋亡检测试剂盒购自BD;蛋白裂解液和蛋白酶抑制剂购自Thermo;兔抗大鼠 ROCK1、ROCK2、cleaved caspase-3、Bcl-2、Bax、PI3K、Akt和p-Akt抗体及山羊抗兔Ⅱ抗购自Cell Signaling Technology;ECL发光液购自Thermo。多功能台式高速离心机5805R购自Eppendorf;二氧化碳培养箱购自Thermo;酶标仪购自Bio-Rad iMark;紫外分光光度计TU-1900购自北京普析通用仪器有限责任公司;CantoⅡ流式细胞仪购自BD;ABI7500实时荧光定量PCR仪购自Applied Biosytems;小型垂直电泳仪和XRS+S化学发光凝胶成像仪购自Bio-Rad。
2 方法
2.1 原代心肌细胞的培养及鉴定 取出生1~3 d的Wistar乳大鼠10只,雌雄不限,无菌操作取出心脏在不含血清的低糖DMEM培养基中洗3次,取心脏靠近心尖部的2/3部分,并剪成1 mm×1 mm×1 mm大小的组织块。采用单一胶原酶短时多次消化法消化心肌细胞,即使用0.6 g/L的Ⅱ型胶原酶4.5 mL消化10 min,在37℃水浴锅中共消化10次弃去首次消化液,用含15%胎牛血清的低糖DMEM培养液终止消化。收集细胞悬液,800 r/min离心5 min,弃掉上清,加入10%胎牛血清的DMEM培养液,经200目细胞筛网过滤后,置于37℃、5%CO2培养箱中差速贴壁90 min。差速贴壁去除成纤维细胞之后以5~8×105密度铺于24孔中,或者以每孔1.5~2.0×106密度铺于6孔板中,进行后续实验。铺板时每孔需加入0.1 mmol/L的BrdU抑制成纤维细胞的生长,24 h后换液。心肌细胞免疫组化的鉴定采用横纹肌肌动蛋白兔来源抗体。细胞铺板前放置细胞爬片,细胞在含10%胎牛血清的DMEM中培养48 h后,取出爬片,1×PBS洗去残留的血清及培养基,用预冷的4%多聚甲醛固定20 min,1×PBS漂洗,0.1%的Triton X-100通透15 min,后经内源性过氧化物酶灭活,5%BSA液封闭,α-SCAⅠ抗以1∶100孵育,湿盒4℃过夜后加羊来源的Ⅱ抗孵育,最后DAB显色,苏木素复染,封片后显微镜拍照。
2.2 心肌细胞高糖模型的制备及培养条件 细胞在含10%胎牛血清的低糖DMEM中培养48 h后,换成含1%胎牛血清的DMEM饥饿24 h,之后分别采用含糖5.5、33和40 mmol/L的DMEM继续培养48 h后进行MTT实验、RT-qPCR、流式细胞术监测和Western blot实验。为了进一步验证ROCK对PI3K/Akt信号通路的调控作用,将培养48 h后的原代心肌细胞分为正常糖(normal glucose,NG)对照组(含5.5 mmol/L葡萄糖的DMEM培养基处理细胞)、高糖(high glucose,HG)组(含葡萄糖33 mmol/L)和HG+Y27632组(心肌细胞在浓度为10μmol/L的Y27632培养30 min后,换为含葡萄糖33 mmol/L的DMEM培养基)。3组细胞继续培养48 h后进行RT-qPCR及Western blot检测相关基因mRNA和蛋白水平的变化。
2.3 MTT法检测心肌细胞活力 心肌细胞消化好后计数,稀释后以每孔200μL的体积加入到96孔板中,保证细胞数量在103~104之间,空白调零孔只加不含细胞的基础培养基,每组设置5个复孔,每个孔中加入5 g/L的MTT溶液20μL,继续培养4 h后,小心吸去孔中所有液体,吸干净后,加入150μL DMSO,室温摇床摇10 min,使结晶充分溶解,酶标仪测490 nm处吸光度(A)。细胞相对活力(%)=(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。
2.4 流式细胞术检测细胞凋亡率 弃去各组原有培养液,用预冷的1×PBS洗涤后收集细胞,再用不含EDTA的胰酶消化收集上述3组细胞,用含15%胎牛血清的低糖DMEM培养液终止消化,收集各组孔板所有液体1 000 r/min离心5 min,弃掉上清后用1×PBS洗涤细胞2次,再加入500μL 1×binding buffer重悬细胞,之后加入Annexin V-FITC 5μL染色15 min,上机前加入PI染液5μL染色5 min,最后在流式细胞仪上机检测。
2.5 RT-qPCR检测ROCK1和ROCK2的mRNA表达 每组细胞造模后(每组设置3个平行孔),采用TRIzol直接裂解法提取每组细胞的总RNA。使用紫外分光光度计检测总RNA的纯度和浓度,待测RNA的A260/A280比值在1.8~2.0之间,使用相对定量比较Ct法对ROCK1和ROCK2的表达水平进行定量。采用TaKaRa的PrimeScriptTMRT Master Mix(Perfect Real Time)逆转录试剂将RNA逆转录为cDNA,按照产品说明书步骤操作,采用20μL反应体系:5×Prime-Script RT Master Mix 4μL,总RNA不超过1 000 ng,最后加RNase-free dH2O至20μL。反应条件为:37℃ 15 min、85℃ 5 s,置于4℃。逆转录产物的实时荧光定量扩增采用TaKaRa的TB GreenTMPremix Ex TaqTMⅡ(Tli RNaseH Plus)试剂,以β-actin作为内参照。ROCK1的上游引物序列为5′-TATGAAGTAGTAAAGGTAATCGGCAGAG-3′,下游引物序列为 5′-CTGGTGGATTTATGCCTTACCAA-3′;ROCK2 的 上游引物序列为5′-AATCAAATCAGCATCCTTCTTTAAGAAT-3′,下 游 引 物 序 列 为 5′-CTGGAGCTGCCGTCTCTCTTAT-3′[13];β-actin 的上游引物为 5′-TAAAGACCTCTATGCCAACACAGT-3′,下 游 引 物 为CACGATGGAGGGGCCGGACTCATC-3′。 按 照 说 明书采取20μL反应体系:TB Green Premix Ex TaqⅡ(Tli RNaseH Plus 2×)10 μL,PCR Forward Primer(10μmol/L)0.8μL,PCR Reverse Primer(10μmol/L)0.8 μL,ROX Reference DyeⅡ(50×)0.4 μL,DNA模板2μL,灭菌水6μL。置于ABI 7500实时荧光定量PCR仪中进行扩增,反应条件为:95℃30 s、95℃ 5 s、60℃ 34 s;95℃ 15 s、60℃ 1 min、95℃ 15 s,40个循环。实验重复3次,采用2-ΔΔCt法计算ROCK1和ROCK2的相对表达量[14]。
2.6 Western blot检测蛋白表达水平 弃去6孔板细胞原有的培养基,用预冷的1×PBS洗1遍,按照细胞量每孔加入200μL的M-PER哺乳动物细胞总蛋白裂解液(Thermo),冰上摇晃裂解10 min,收集裂解液以14 000×g离心力离心10 min,收集上清,用BCA法测定蛋白浓度,取20μg进行SDS-PAGE分离蛋白,然后进行PVDF膜湿转(100 V、90 min),5%脱脂奶粉溶液封闭2 h,分别加入待测蛋白和内参照β-actin的I抗,4℃过夜,1×TBST洗3次,加入II抗,室温孵育2 h,1×TBST洗3次,凝胶成像仪中曝光拍照,ImageJ软件分析蛋白灰度值,计算蛋白的相对表达量。
3 统计学处理
采用SPSS 19.0软件进行统计分析。本实验数据属于完全随机设计的计量资料,结果以均数±标准差(mean±SD)表示。组间比较采用单因素方差分析,两两比较采用Bonferroni校正t检验,以P<0.05为差异有统计学意义。
结 果
1 原代心肌细胞形态
倒置显微镜下观察可见,细胞培养24 h后已基本贴壁,培养48 h后细胞搏动明显,平均每分钟搏动85±7次,呈典型的梭型状,细胞有伪足生出,部分细胞呈团簇状生长,立体感十分明显,收缩强劲有力。如图1所见,免疫组化原代心肌细胞纯度达95%。
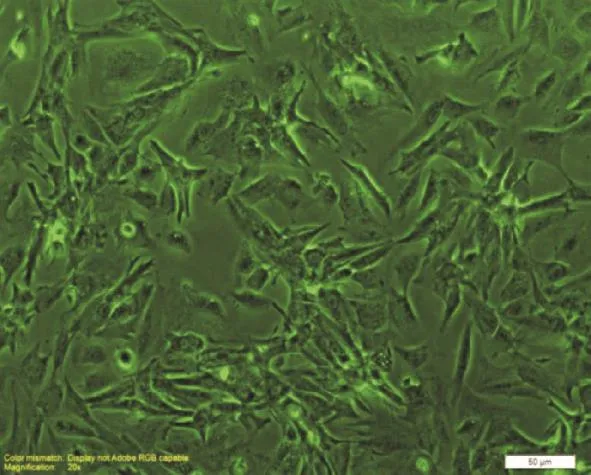
Figure 1.Micrograph of rat neonatal cardiomyocytes cultured for 48 h.The scale bar=50μm.图1 培养48 h后的原代心肌细胞形态
2 MTT检测不同组细胞活力的结果
按5.5 mmol/L组的细胞活力为100%,则33 mmol/L组的细胞相对活力为(79.71±2.43)%,40 mmol/L组的细胞相对活力为(68.41±7.49)%,较5.5 mmol/L组显著降低(P<0.05),见图2。
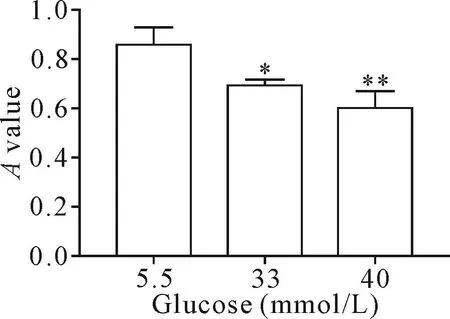
Figure 2.The changes of the A value in the cardiomyocytes exposed to high glucose for 48 h measured by MTT assay.Mean±SD.n=5.*P<0.05,**P<0.01 vs 5.5 mmol/L group.图2 不同组细胞48 h后细胞活力的变化
3 流式细胞术检测每组细胞凋亡率的结果
33和40 mmol/L高糖刺激细胞48 h后,细胞凋亡率较对照组显著增加(P<0.05),见图3。
4 RT-qPCR检测ROCK1和ROCK2的mRNA表达
33和40 mmol/L高糖刺激48 h后,ROCK1和ROCK2的mRNA表达较对照组显著增加(P<0.05),见图4。
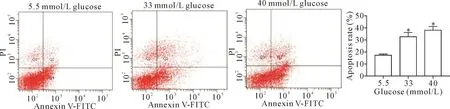
Figure 3.The changes of apoptotic rates in the cardiomyocytes exposed to high glucose for 48 h were detected by flow cytometry.Mean±SD.n=3.*P<0.05 vs5.5 mmol/L group.图3 高糖作用48 h后细胞凋亡率的变化
5 Western blot检测蛋白水平的变化
33和40 mmol/L高糖作用48 h后,ROCK1和ROCK2蛋白表达较对照组显著升高(P<0.05),见图5。
与对照组相比,33和40 mmol/L高糖作用48 h后原代心肌细胞的凋亡蛋白cleaved caspase-3的水平显著升高(P<0.05),Bcl-2蛋白的表达显著降低(P<0.05),见图6。
33和40 mmol/L高糖作用48 h后,PI3K与Akt蛋白水平较对照组比较差异无统计学显著性,p-Akt的蛋白水平则较对照组显著降低(P<0.05),表明高糖可使Akt的活化受到抑制,见图7。

Figure 4.The mRNA expression of ROCK1 and ROCK2 in the 3 groups was detected by RT-qPCR.Mean±SD.n=3.*P<0.05 vs5.5 mmol/L group.图4 高糖作用48 h后ROCK 1与ROCK 2的mRNA表达变化
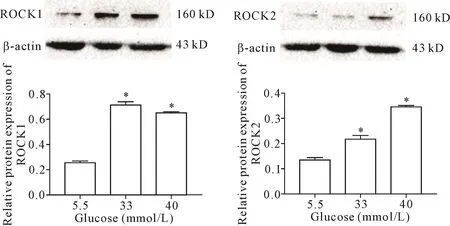
Figure 5.Western blot was used to determine the protein expression of ROCK1 and ROCK2 in the cardiomyocytes exposed to high glucose for 48 h.Mean±SD.n=3.*P<0.05 vs5.5 mmol/L group.图5 高糖作用48 h后ROCK1和ROCK2蛋白表达的变化
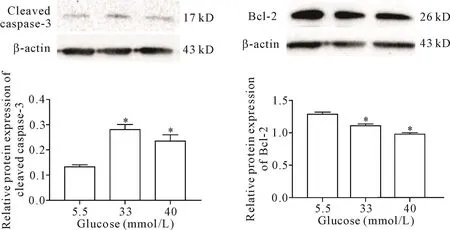
Figure 6.Western blot was used to determine the protein levels of cleaved caspase-3 and Bcl-2 in the cardiomyocytes exposed to high glucosefor 48 h.Mean±SD.n=3.*P<0.05 vs5.5 mmol/L group.图6 高糖作用48 h后cleaved caspase-3和Bcl-2蛋白表达的变化
此外,在ROCK抑制剂实验部分,与对照组相比,高糖组ROCK1和ROCK2蛋白的表达增高(P<0.05),HG+Y27632组的ROCK1和ROCK2蛋白不表达,见图8;3组间PI3K与AKT蛋白水平的差异无统计学显著性(P>0.05),而与对照组相比,高糖组p-Akt蛋白表达降低(P<0.05),HG+Y27632组p-Akt的蛋白水平较高糖组显著增加(P<0.05),见图9。
讨 论

Figure 7.Western blot was used to determine the protein levels of PI3K,Akt and p-Akt in the cardiomyocytes exposed to high glucose for 48 h.Mean±SD.n=3.*P<0.05 vs5.5 mmol/L group.图7 高糖作用48 h后PI3K、Akt和p-Akt蛋白水平的变化

Figure 9. Western blot analysis was used to deternmine the protein levels of PI3K,Akt and p-Akt in the cardiomyocytes.Mean±SD.n=3.*P<0.05 vs NGgroup;#P<0.05 vs HGgroup.图9 ROCK抑制剂对PI3K、Akt和p-Akt蛋白水平的影响
越来越多的研究表明,高血糖在DCM的发病中扮演了重要角色,但高血糖诱导心肌细胞损伤的分子机制尚不清楚。ROCK属于丝氨酸/苏氨酸蛋白激酶家族,活化的ROCK通过与肌球蛋白轻链的磷酸化而活化促进细胞收缩和附着以增加肌球蛋白ATP酶的活性[15],通过调控信号元件,如Bcl-2的激活,死亡受体的激活,caspase的活化等诱导多种细胞的凋亡[16-17]。近年来有研究证实,冠心病引起的心力衰竭伴随心肌细胞凋亡的发生[18],有研究显示糖尿病患者的心肌细胞凋亡数量是健康人群的85倍,心肌细胞的凋亡是DCM的重要发病机制[19-20]。过度活化ROCK会诱导心肌细胞凋亡,阻断ROCK的表达亦可抑制细胞凋亡的发生[21]。ROCKs可以被caspase-3激活,介导心肌细胞的凋亡,ROCK是活化的caspase-3的直接裂解产物,激活的ROCK又反馈激活caspase-3,形成一个恶性循环[22]。
本研究发现,高糖作用48 h后,cleaved caspase-3蛋白量增加,且细胞凋亡率增加。cleaved caspase-3蛋白为一对分子量为17 kD的caspase-3活性亚单位,一般认为,当细胞被凋亡信号激活时,无活性的caspase-3酶原被裂解为有活性的cleaved caspase-3,标志着凋亡过程进入不可逆转阶段[23]。RT-qPCR和Western blot分别对ROCK1和ROCK2 mRNA和蛋白进行检测发现,与对照组相比,高糖组ROCK1和ROCK2的mRNA和蛋白表达显著增加,证明高糖作用激活了ROCK1和ROCK2的表达,可能参与了心肌细胞凋亡的发生,这与之前的研究结果一致[24-25]。
PI3K/Akt通路是PI3K始动的生物信号转导通路,在细胞增殖、细胞周期调控、凋亡启动、血管生成等方面发挥着关键作用。PI3K/Akt信号通路通过调节Bcl-2家族成员的活性和表达量在促进细胞存活方面具有重要作用[26-27]。第10号染色体同源缺失性磷酸酶-张力蛋白(phosphatase and tensin homolog deleted on chromosome 10,PTEN)是一种能够使蛋白质和磷酸肌醇底物去磷酸化的磷酸酶,它是PI3K上游的一个负性调节蛋白,它可以使三磷酸磷脂酰肌醇脱磷酸生成二磷酸磷脂酰肌醇,进而下调PI3K/Akt通路蛋白的表达加速细胞凋亡,抑制细胞生存[28-29]。我们的研究结果发现与对照组相比,高糖可使Akt磷酸化水平及Bcl-2的表达降低,说明高糖引起PI3K/Akt信号通路的抑制,使抗凋亡蛋白表达降低,促进细胞凋亡。
为了进一步证实ROCK对PI3K/Akt信号通路的调控作用,我们在高糖作用的细胞中,加入ROCK抑制剂Y27632。Western blot检测发现,与对照组相比,高糖组ROCK1和ROCK2表达显著增高,高糖组加Y27632组,ROCK1/2表达被抑制,同时,p-Akt的蛋白水平显著升高。
有研究证实,ROCK的过表达可磷酸化PTEN直接使其激活,增加了PTEN的活性及其蛋白的稳定性。因此,我们认为,高糖可能是通过激活ROCK,导致PTEN活性增强,进一步通过抑制Akt蛋白磷酸化,抑制了PI3K/Akt信号通路的活性,引起下游一系列凋亡蛋白的表达增加,最终导致心肌细胞凋亡。针对缺血缺氧模型的研究显示,ROCK在缺氧状态下被激活,凋亡也随之发生,在缺氧状态下,PI3K/Akt信号通路的表达是失活的[30]。Yu 等[31]的研究发现姜黄素可通过激活PI3K/AKT信号保护心肌细胞对抗高糖高脂诱导的心肌细胞凋亡,均与我们的研究结果一致。
综上所述,ROCK1/2参与了高糖诱导的心肌细胞凋亡的过程,其机制可能是抑制Akt的磷酸化,从而抑制PI3K/Akt信号通路的激活,引起下游一系列凋亡蛋白增加有关。
