Streptomyces TOR3209 介导盐碱地金花葵 根际的生态效应
2020-06-09刘雅辉孙建平彭杰丽王占武
马 佳,刘雅辉,孙建平,李 颖,胡 栋,彭杰丽,王占武
(1.河北省农林科学院 遗传生理研究所/河北省植物转基因中心重点实验室/农业部农产品质量安全风险评估实验室,河北 石家庄 050051;2. 河北省农林科学院 滨海农业研究所,河北 唐山 063299)
盐碱地的改良主要有物理、化学和生物3 大类方法[1],目前常用的生物改良法主要有种植耐盐植物和利用耐盐微生物。肖克飚等[2]在内陆盐碱地连续3 年种植耐盐植物柽柳(Tamarix chinensis Lour.)、苇 状 羊 茅(Festuca arundinacea Schreb.)、 油 葵(Helianthus annuus Linn.),发现其能够有效降低土壤全盐含量,改善土壤肥力水平,同时将土壤微生物数量增加了4.1 ~7.0 倍。Muhammad 等[3]利用两株假单胞菌(Pseudomons)与肥料结合提高了玉米(Zea mays L.)在盐渍土中的生长及耐受性;侯景清等[4]利用微生物复合制剂能有效降低盐碱地的pH并增加养分含量,同时可增加土壤中的放线菌数量,降低病原微生物数量,对盐碱地的改良具有良好效果。Wang 等[5]发现黄河三角洲地区,盐碱土中的优势野生植株,柽柳、芦苇(Phragmites australis)、碱蓬(Suaeda salsa)等根部都有丛枝菌根(Arbuscular mycorrhizae,AM)真菌侵染,说明微生物促进了侵染植株优势地位的建立。目前,利用根际有益微生物与耐盐植物结合联合改良盐碱地的研究还鲜有报道。金花葵(Hibiseu manihot L.)是一年生草本锦葵科秋葵属植物,适应性较强,较耐寒、耐热、喜湿、耐盐碱,能耐40 ℃高温和-10 ℃低温[6],是改良和利用盐碱地的理想植物之一。由本实验室筛选获得的根际有益微生物链霉菌TOR3209,具有显著促生、降解根系毒素、提高植物耐盐、耐旱能力和预防土传病害等多种功能,其根际生态效应十分显著[7]。
冀东滨海盐碱区主要包括唐山及秦皇岛沿海地区,其中土壤盐渍化较为严重的是唐山曹妃甸区,境内80%的土地为盐碱地,南部地区土壤全盐含量0.4%~1.8%,pH 值7 ~8[8],土壤盐渍化问题严重制约着河北滨海区域的发展。本研究以高效耐盐植物金花葵和优良根际益生菌TOR3209 为材料,尝试植物微生物联合改良盐碱地实施效果,在金花葵始蕾期和成熟期两个时期,测定土壤理化性状以及土壤酶活性等生态指标的变化,同时采用磷脂脂肪酸(Phospholipid fatty acid, PLFA)方法检测土壤微生物的群落结构与多样性。通过植物—微生物联合改良盐碱地以期揭示根际生态效应机制,为盐碱地的高效改良与利用提供方法和理论依据。
1 材料与方法
1.1 材料
链霉菌属Streptomyces TOR3209 为本实验室的保存菌种,具有显著促生、防病和提高植物抗性作用;制备成液体菌剂,有效活菌含量为3×109cfu/mL。
1.2 试验田处理
试验于2017 年4 月下旬于河北省农林科学院滨海农业研究所天旭基地进行。地理位置位于东经118°50’03”,北纬39°25’13”,属于温带半湿润季风气候,土质为滨海盐土,全盐含量1%左右。播种前试验田浇水保墒,待能下地后,按每公顷375 kg的用量撒施45%氮磷钾三元素复混肥,旋耕2 次后分区,起垄,每小区长6 m,宽3.5 m。试验共设置3 个处理(表1),每处理3 次重复,共设9 个小区,随机排列。每小区播种8 垄,垄宽40 cm。采用垄上播种,每垄两头各留15 cm,按照株距30 cm 穴播,每垄21 穴,每穴播3 粒种子,完全出苗后间苗,每穴1 株苗。菌剂的施用采用穴施方法,处理组每穴施用清水稀释150 倍的菌液200 mL,待菌液下渗后,与穴边和底部田土混合均匀,播种,覆土。对照组每穴浇清水200 mL 之后的田间管理保持一致,采用滴灌浇水,保证每小区灌水量一致。
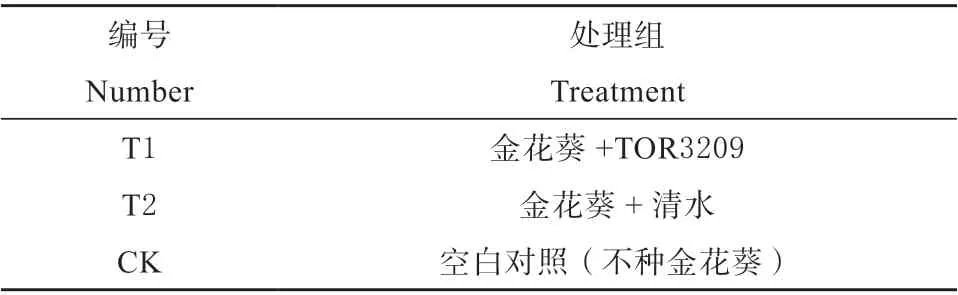
表1 TOR3209 在盐碱地金花葵上的应用处理设置Table 1 The impact of TOR3209 on Hibseu manihot growth in saline-alkali soil
1.3 土壤样品采集
分别于2017 年7 月8 日金花葵始蕾期和9 月20 日金花葵成熟期采集金花葵根际和根围土壤。每处理随机选取3 株金花葵,取距离根系0.5 ~3 cm的土壤作为根围土,用于检测土壤理化指标和酶活性。整株挖出后,抖落粘在根系上的大颗粒土壤,用无菌毛刷轻轻刷取粘在根系上的土壤作为根际土,用于检测根际微生物群落。将采集的土样装入无菌拉锁袋中并即刻做冷藏处理。根际土于4 ℃冷藏保存,24 h 内用于PLFAs 检测。根围土壤自然风干后,过0.25 mm 筛,取20 g 细用于土壤酶活性和理化指标的检测。
1.4 检测方法
土壤理化性质的测定[9]:土壤有机质采用重铬酸钾氧化法(外加热法);土壤全氮采用凯氏定氮法;土壤全磷采用NaOH 熔融–钼锑抗比色法;土壤全钾采用火焰光度法;土壤速效磷采用碳酸氢钠浸提-钼锑抗比色法;土壤速效钾采用乙酸铵浸提-原子吸收法;土壤碱解氮采用碱解扩散法;土壤电导率(EC)和pH 的测定分别按照5∶1 和2.5∶1 和的水土比进行浸提,用电导仪和酸度计测定。
植株生物量:在成熟期,每小区分别取金花葵3 株,进行植株生物量的测定。
酶活性测定:蔗糖酶活性测定采用3,5-二硝基水杨酸比色定糖法(DNS)法[10];脲酶活性测定采用苯酚钠法[11];碱性磷酸酶活性测定采用磷酸苯二钠比色法[12]。
PLFAs 检测主要参照修正的 Blight-Dyert 方法[13]。在气相色谱仪(GC 7890B,Agilent) 上采用 MIDI 软件系统进行分析,测定磷脂脂肪酸各组分的含量。
1.5 土壤微生物 PLFAs 的命名与计算
PLFA 的总量和单个 PLFA 的量用内标19: 0进行计算。细菌的量用下列脂肪酸总和表征:i14: 0,i15: 0,a15: 0,15: 0,i16: 0,16: 1ω9,16: 1ω7t,i17: 0,a17: 0,17: 0,cy17: 0,18: 1ω7,cy19: 0[14];真菌的量用18: 2ω6c 表征;革兰氏阴性菌(G-)的量用16: 1ω7t、16: 1ω7c、cy17: 0、18: 1ω7 和 cy19: 0 表征;革兰氏阳性菌(G+)的量用i15: 0、a15: 0、i16: 0、i16: 1、i17: 0、a17: 0表征[15],放线菌的量用10Me16: 0 和10Me17: 0表征。
1.6 数据分析方法
采用 Excel 2016、SPSS 软件及 CANOCO 4.5 软件进行数据处理和统计分析,采用单因素方差分析和最小显著差异法比较不同数据组间的差异,用主成分分析法(Principal component analysis,PCA)分析磷脂脂肪酸的原始数据。微生物菌群与土壤理化性质之间的关系用冗余法(Redundancy analysis,RDA)进行分析。引入群落生态学Simpson 优势度指数、Shannon 多样性指数、Pielou 均匀度指数和Margalef 丰富度指数,分析不同处理土壤微生物群落的多样性[16]。
2 结果与分析
2.1 不同处理对土壤理化性质的影响
链霉菌TOR3209 介导盐碱地金花葵根际后,植株生长茂盛,根系发达,须根提高2 倍以上,全株生物量提高了113.22%,差异达极显著。由表2 可见,盐碱地栽培金花葵后,与盐碱裸地CK 比较,T1 和T2 土壤电导率明显下降,pH 值升高,碱解氮、速效磷和速效钾的含量提高。TOR3209 介导处理,无论在始蕾期还是成熟期,各项指标的变化幅度增加,在两个时期,与T2 相比,T1 碱解氮含量分别提高了21.88%和33.18%,速效磷分别提高了101.27%和102.26%,速效钾提高了14.59% 和35.95%;与CK 相比,T1 碱解氮含量分别提高了60.52%和72.34%,速效磷分别提高了153.31%和197.18%,速效钾提高了5.10% 和37.08%。根围土壤电导率分别下降 31.39 %和49.57%,pH 值略有提高。由此可见,TOR3209 介导金花葵根际后,金花葵的耐盐能力提高,根系活力增强,根围土壤被活化,特别是速效磷的浓度提高了一倍以上,而盐浓度明显下降,为金花葵的正常生长提供了良好的理化条件。
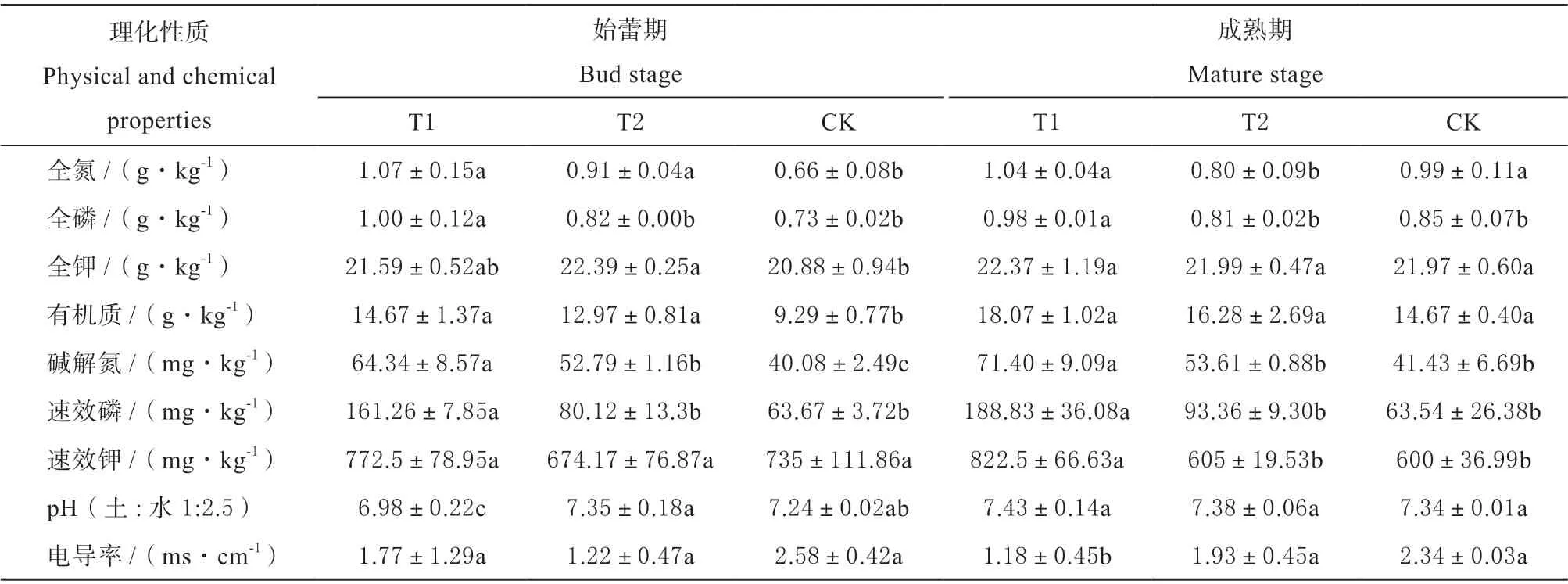
表2 不同处理对根围土壤理化性质的影响Table 2 Comparison of chemical and physical properties of different treatments
2.2 土壤酶活性的变化
检测了金花葵始蕾期和成熟期3 个处理的土壤蔗糖酶、碱性磷酸酶和脲酶的活性,结果如图1 所示。以标准葡萄糖溶液和DNS 反应后的吸光光度值为纵坐标,以葡萄糖浓度为横坐标绘制标准曲线,得出土壤蔗糖酶活性回归方程y=0.347x+0.048 2,R2=0.996 1。土壤的蔗糖酶活性分别按照回归方程计算获得。结果显示,金花葵始蕾期和成熟期,T1 处理土壤蔗糖酶活性最高,分别为12.22 和10.518;T2 处理次之,分别为8.28 和8.64,各处理土壤蔗糖酶活性均高于CK。

图1 不同处理土壤蔗糖酶和碱性磷酸酶活性Fig.1 Soil invertase and alkaline phosphatase activities of different treatments in two stages
以光密度为纵坐标,浓度为横坐标,绘制成酚工作液的标准曲线。得出土壤碱性磷酸酶活性回归方程y=0.165 8x+0.031 4,R2=0.988 7。结果显示,各处理金花葵始蕾期土壤碱性磷酸酶活性均高于成熟期,其中T1 处理前期活性最高,为11.58,高于对照185.22%。以标准溶液浓度为横坐标,以吸光光度值为纵坐标绘制NH3-N 标准曲线,得出土壤脲酶活性回归方程y=216.7x+0.018 8,R2=0.996 2。结果显示,各处理金花葵始蕾期土壤脲酶活性均高于成熟期,其中T1 处理前期活性最高,为0.045,高于对照309.09%(图2)。
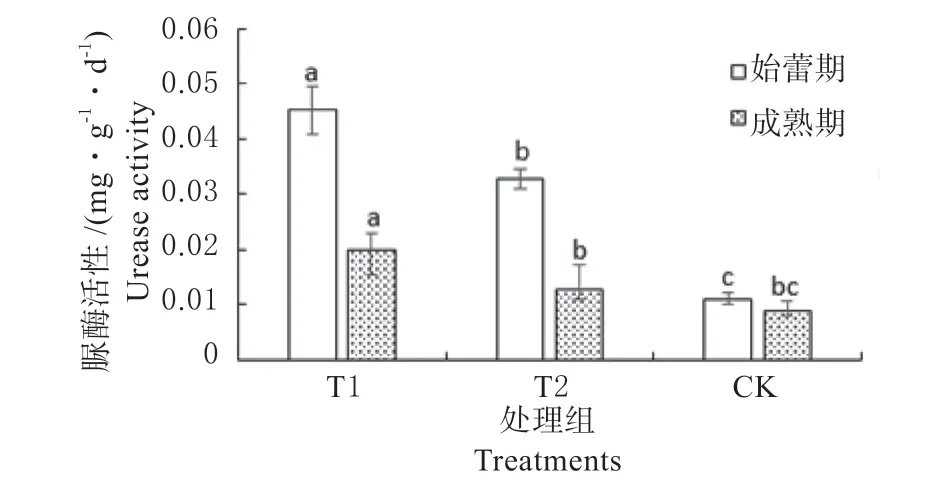
图2 不同处理土壤酶活性Fig.2 Soil urease activities of different treatments in the two stages
以上结果表明,TOR3209 介导后,显著提高了金花葵根围土壤各种酶的活性,提高了养分的利用率,这与理化性状的分析结果是一致的。
2.3 根际微生物群落结构及绝对含量的变化
由图3 可见,在金花葵始蕾期,T1 处理的微生物总量最高为434 nmol/g,显著高于T2 和CK,分别提高了67.84% 和80.27%。各处理土壤细菌总量均显著高于真菌和放线菌总量,是土壤微生物的主要类群,其中革兰氏阴性菌的含量与细菌总量在各处理下的变化趋势相似,含量大小顺序为T1>CK>T2,且T1 显著高于各处理。各处理土壤微生物中放线菌占比较大,含量大小顺序为T1>T2>CK,且T1 显著高于各处理。真菌数量顺序为T1>T2>CK,,这与表2 结果是一致的。各处理群落中AM 真菌含量大小顺序为T1>T2>CK,且T1显著高于各处理。在金花葵成熟期,T1 处理的微生物总量最高为1 295.92 nmol/g,而CK 最低,为827.25 nmol/g。成熟期各处理微生物总量均显著高于始蕾期。表明,TOR3209 介导金花葵根际后,能诱导金花葵根际其他微生物的扩繁,使根际微生物总量、多样性以及菌根真菌等有益微生物明显提高,根际生物活性得到改善。
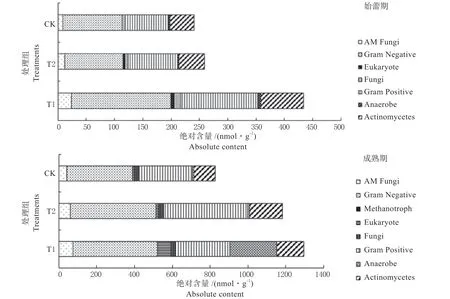
图3 金花葵不同时期微生物群落结构及绝对含量Fig.3 Microbial community structure and their amount of the different stages of Hibiseu manihot
如图4 所示,土壤B/F 在金花葵始蕾期和成熟期表现为CK 最高,T2 处理次之,T1 处理最低,呈递减趋势,且成熟期比值低于始蕾期,说明T1 处理使土壤生态系统趋向稳定。G+ /G-在金花葵前期和成熟期均表现为T2 最高,CK 次之,T1 最低,说明T1 处理提高了根际碳源水平,这与根际生物活性提高,根系分泌物增多有关。
分析不同处理对金花葵土壤微生物群落多样性的影响(表3),发现T1 处理的Simpson 值、Shannon 值和Margalef 值最高,均显著高于CK,但其均匀度指数Pielou 值最低。
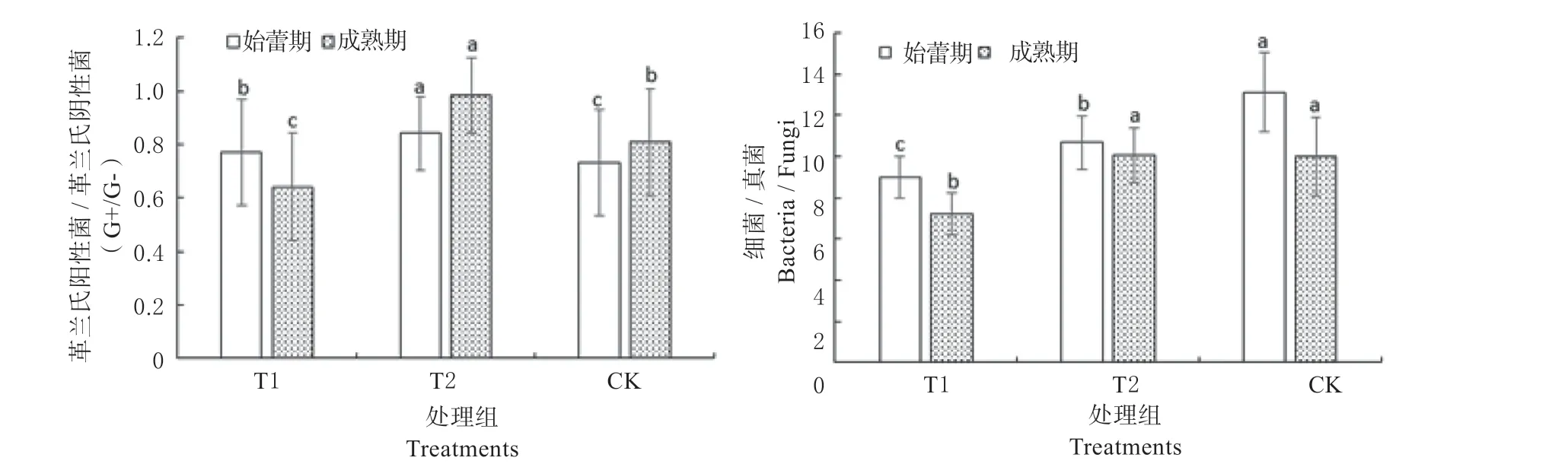
图4 不同处理下细菌/真菌和革兰氏阳性菌/革兰氏阴性菌的比值Fig.4 The values of bacteria /fungi and G+ /G- in soils under different treatments

表3 各处理土壤微生物菌群多样性指数Table 3 Shannon indexes of soil microbial flora of each treatment
2.4 主成分分析
由PLFA 主成分分析可知(图4),金花葵始蕾期根际土壤36 种脂肪酸可以分为PC1 和PC2 两个主要类型,两个主要类型之和达到土壤微生物群落结构组成的98.7%。表明,这两个主成分是土壤微生物群落变异的主要贡献者。
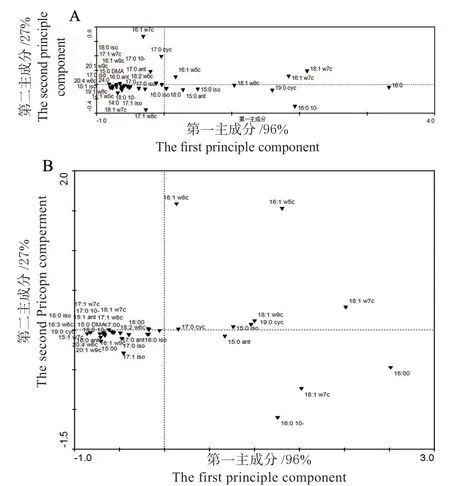
图5 不同生长期金花葵各处理PLFA 主成分分析Fig.5 Principal component analysis of different treatments at different stages
其中PC1 主成分正方向中,16:1ω7c、16:0、18:1ω7c、19:0 cyc、16:0 10-methyl、16:1ω7c DMA、18:1ω9c 得分较高,主要代表细菌和G-。金花葵成熟期供试土壤的34 种脂肪酸可以分为两个主要类型,PC1 的贡献率为78.8%,PC2 的贡献率为20.9%,累积贡献率为99.7%。其中PC1 主成分正方向中,16:1ω7c、16:0、18:1ω7c、19:0 cyc、16:0 10-methyl、16:1ω7c DMA、18:1ω9c 得 分较高,主要代表细菌和G-;PC2 主成分正方向中18:1ω7c、19:0 cyc、18:1ω9c、15:0 iso 得分较高,主要代表细菌和G-。
2.5 土壤微生物群落与土壤理化性质之间的关系
运用CANOCO 软件进行RDA 分析,结果如图5 所示,并利用SPSS 软件进行相关性分析(表4)。在金花葵始蕾期,各处理土壤中细菌、真菌、放线菌、革兰氏阳性菌和革兰氏阴性菌之间关系最为密切,五者与土壤全氮(TN)、全磷(TP)、全钾(TK)、有机质(OM)、碱解氮(AN)、速效磷(AP)、速效钾(AK)呈正相关关系,其中碱解氮与真菌呈显著正相关。EC 值、pH 值与B/F 呈显著正相关关系,有机质与B/F 呈显著负相关关系,pH 值与土壤微生物群落之间存在显著负相关关系。
在金花葵成熟期,各处理土壤中微生物群落与土壤理化性质之间的变化趋势一致,除全氮和电导率以外,土壤理化性质与微生物群落均呈正相关关系。其中pH 值与细菌呈极显著正相关,与电导率呈显著负相关;全钾与G-呈显著正相关。除细菌和B/F 外,全氮与各微生物群落呈负相关;除G+和G+/G-外,电导率与各微生物群落数量呈负相关关系。除G+/G-外,生物量与微生物群落呈正相关关系。

图6 不同生长期各处理微生物群落与理化因子及酶活性的RDA 分析Fig.6 RDA analysis of microbial communities and environmental factors of Hibiseu manihot at different stages
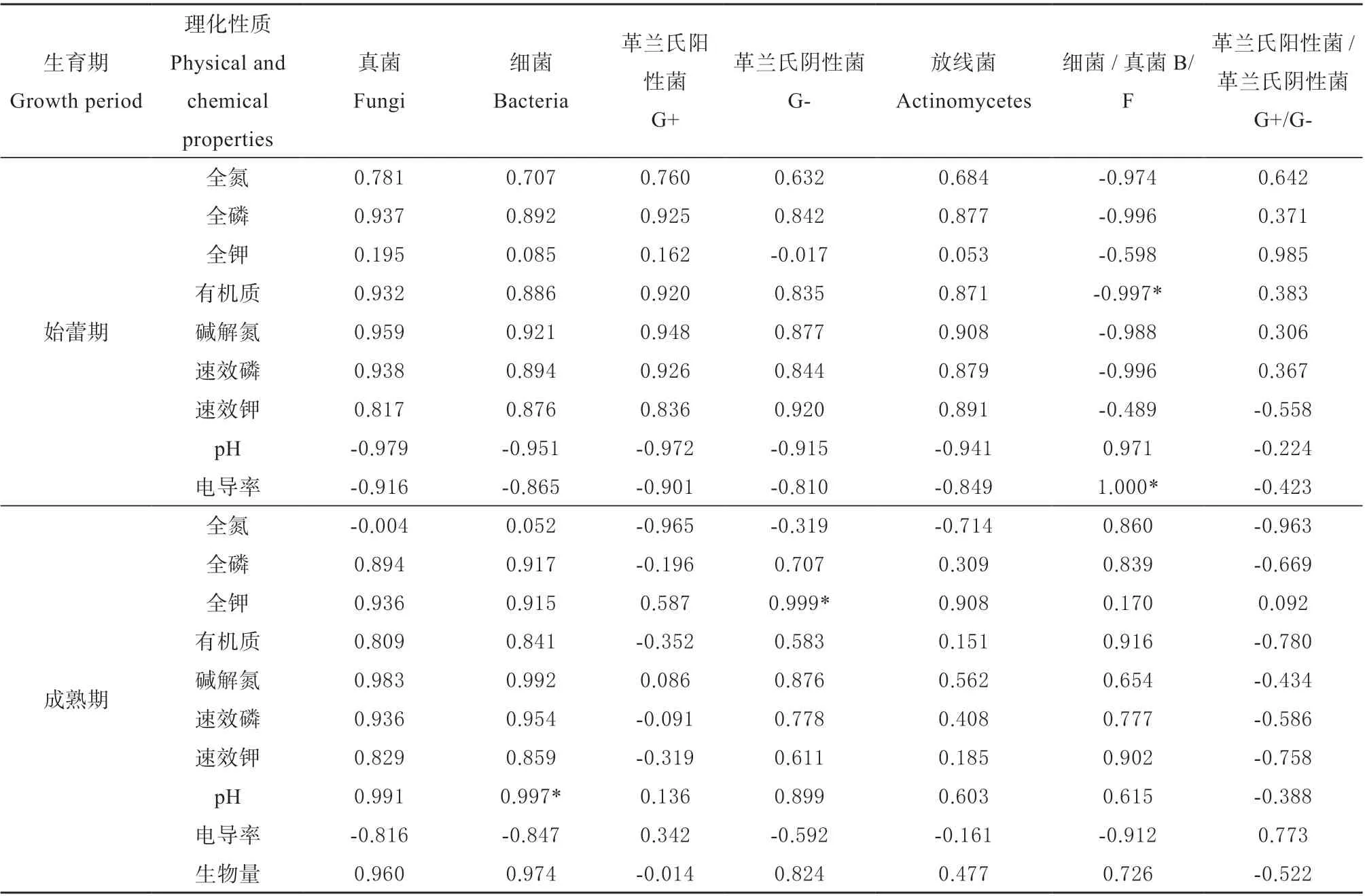
表4 金花葵不同生育期微生物群落与土壤理化性质及酶活的相关性分析Table 4 Correlative analysis of microbial community and soil properties
3 讨论
3.1 金花葵对盐碱地土壤环境的影响
有研究表明,植物种类对土壤微生物组成和多样性具有显著影响[17],本研究中在盐碱地种植金花葵(T2),土壤电导率显著下降,碱解氮、速效磷和速效钾的含量显著提高(P<0.05);土壤酶活活性提高,微生物数量与多样性增多。这与秦忠立利用滴灌种植药用甘草提高盐碱地土壤微生物数量,改善土壤理化性质的研究结果相似[18]。B/F 与G+/G-是反映土壤稳定性与营养状况的两个指标,B/F 值越低,土壤生态系统越稳定,G+/G-越大,表示营养胁迫越强,T2 处理中,B/F 低于对照,但是G+/G-却高于对照,说明随着金花葵生长,到成熟期土壤营养状况却越贫乏[19]。由此说明,金花葵作为单一生物改良措施在短期内能够一定程度的改良盐碱地,但长期应用要关注金花葵自身和土壤养分以及土壤微生物群落的三方均衡状态。
3.2 TOR3209 介导金花葵根际后对盐碱地土壤环境的影响
植物益生菌TOR3209 介导金花葵根际后(T1),可以显著提高金花葵的耐盐能力,表现为金花葵生长旺盛,根系发达,全株生物量提高了113.22%,更显著的提高土壤的理化性质与土壤酶活性。该结果与贺学礼等[20]的研究结果一致。郑舜怡[21]等通过在有机基质中添加AM 真菌,显著增加了其中的细菌、放线菌和真菌数量及微生物总量,与本研究结果一致。TOR3209 的介入促进了根际微生物的繁殖,各微生物总量均显著提高,土壤微生物 Shannon 指数、Simpson 指数和Margalef 指数显著改善(P<0.05)。且两时期B/F 和G+/G-比值均显著降低(P<0.05),不同于T2 处理的G+/G-高于对照,T1 处理的G+/G-低于对照,且成熟期值均低于始蕾期,说明土壤状况由贫瘠转向丰富,生态系统更稳定。
土壤微生物群落的动态变化影响着土壤的理化性质[22]。与单一金花葵处理相比,TOR3209 的介入可显著提高土壤放线菌和AM 真菌的数量。赵卉琳等[23]研究认为土壤中有效N 和有效P 含量与放线菌的数量和种类呈显著正相关。AM 真菌是众多植物根系的生理性共生真菌,根际AM 真菌数量明显增多,这对根系发育和养分供应非常有利,对提高植物抗逆性和磷的利用率至关重要。
TOR3209 能提高金花葵根际土壤酶活性,其中蔗糖酶活性最强,蔗糖酶活性与土壤中有机质、氮、磷含量直接相关。脲酶可将土壤中的尿素分解为CO2、H2O 和NH4+,NH4+通过细菌作用转化为NO3-并释放出H+,在影响土壤pH 的同时可提供氮源[24],脲酶活性的提高可增加土壤碱解氮的含量。此外,TOR3209 促进根系分泌物中有机酸的产生,有机酸可以活化土壤中的矿物钾,增加植物对钾的利用[25],提高土壤中速效钾的含量。同时,TOR3209 自身能代谢产生更多的分泌物,并与金属离子结合,活化更多的磷、钾养分元素。
3.3 微生物群落结构与土壤理化性质的相关性
本研究发现,不同处理方式、不同时期根际土壤微生物种群数量不同,但并不改变微生物群落结构,数量排序:细菌>放线菌>真菌,且变化趋势一致,均为T1>T2>CK,说明TOR3209 处理的金花葵根际土壤更适合微生物的生存[26]。
土壤微生物与土壤理化性质的冗余分析和相关性分析结果显示,土壤微生物对碱解氮、速效磷、有机质、pH 和电导率影响较大,是影响根际微环境的重要因子。其中碱解氮、速效磷、有机质与土壤微生物群落呈显著正相关,pH 值和电导率与土壤微生物群落之间存在显著负相关关系。王瑾等[27]研究发现,接种丛枝菌根真菌对矿区扰动土壤微生物群落有促进作用,且细菌、真菌与速效磷、碱解氮显著或极显著正相关,与有机质呈正相关,与本研究结果一致。范富[28]等人研究发现,盐碱地土壤微生物与pH 大多呈正相关关系,说明TOR3209 与金花葵结合可以改善土壤的pH 值。元炳成等[29]研究发现,种植紫花苜蓿对草甸盐土有显著的改良效果,电导率下降,微生物活性增强,微生物群落与电导率之间极显著 (P<0.01) 负相关,与本研究结果一致。说明TOR3209 介导金花葵根际能提高盐碱地土壤的微生态环境。
