马铃薯块茎病原真菌拮抗菌株筛选及优良拮抗菌株鉴定
2020-06-08陈星伊崔凌霄杨成德
陈星伊 崔凌霄 杨成德

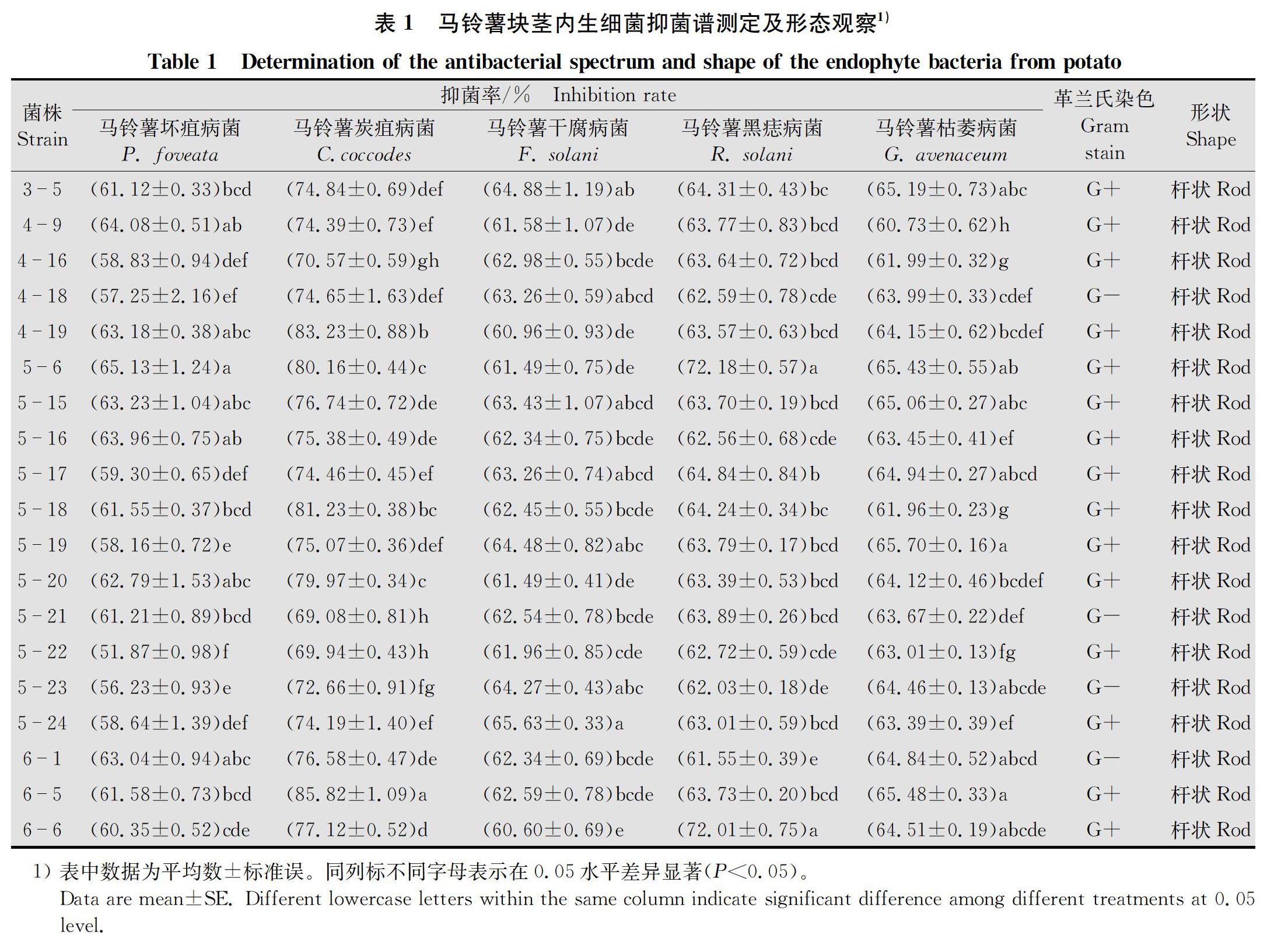

摘要 从马铃薯块茎上分离内生细菌,以块茎病原真菌为指示菌,采用平板对峙法筛选拮抗菌株,并利用形态学特征和 16S rDNA 基因序列分析对优良拮抗菌株进行鉴定。结果表明,从定西马铃薯块茎中共分离得到72株内生细菌,其中19株对5种块茎病原真菌的抑菌率均高于51.87%,特别是内生细菌6-5和5-6分别对马铃薯炭疽病菌Colletotrichum coccodes和马铃薯黑痣病菌Rhizoctonia solani的抑菌率达85.82%和72.18%,且具有固氮和产吲哚乙酸(IAA)功能,其产IAA量分别为3.37 mg/L和19.25 mg/L;根据形态特征及16S rDNA基因序列将菌株5-6鉴定为萎缩芽胞杆菌Bacillus atrophaeus,菌株6-5鉴定为贝莱斯芽胞杆菌Bacillus velezensis。
关键词 马铃薯块茎; 内生细菌; 分离; 抑菌功能; 鉴定
中图分类号: S 476 文献标识码: A DOI: 10.16688/j.zwbh.2019017
Abstract In this study, endophytic bacteria were isolated from potato tubers, and tuber pathogenic fungi were used as indicator fungi. Antagonistic strains were screened by using tablet confrontation method, and excellent antagonistic strains were identified by morphological characteristics and 16S rDNA sequence analysis. The results showed that 72 endophytic bacteria were isolated from Dingxi potato tubers, and 19 of them had an inhibition rate of higher than 51.87% against 5 tuber pathogenic fungi; particularly, endophytic bacteria 6-5 and 5-6 had a bacteriostatic rate of 85.82% and 72.18% against Colletotrichum coccodes and Rhizoctonia solani, respectively. They had nitrogen fixation and IAA function, with an IAA yield of 3.37 mg/L and 19.25 mg/L, respectively. Based on morphological characteristics and 16S rDNA sequence, 5-6 and 6-5 were identified as Bacillus atrophaeus and Bacillus velezensis, respectively.
Key words potato tuber; endophytic bacteria; isolation; antibacterial function; identification
內生细菌 (endophyte)是指其生活史某一阶段或全部阶段生活于健康植物组织或器官的细胞间隙或细胞内的一类细菌,其可通过组织学方法从严格表面消毒的植物组织中分离获得[1]。内生细菌可以通过抑菌、诱导产生次生代谢物、固氮、溶磷及产吲哚乙酸等多方面的有益生物功能,增强宿主植物抗病虫害能力及生长竞争能力等[2-3]。内生细菌作为生防因子具有巨大优势,是微生物资源开发应用中的又一资源库。马铃薯是我国仅次于水稻、小麦和玉米的第四大农作物,且种植区域广泛。2016年农业部又将马铃薯作为主粮作物进行产业化开发,使其已成为我国主要粮食作物和经济作物。随着马铃薯种植面积的扩大,其病害的发生也愈发严重,由于生物防治有诸多优点,因此利用内生细菌对马铃薯病害进行生物防治已成为目前研究的热点之一,如杨成德等[4]从醉马草中分离出6株对马铃薯炭疽病菌和马铃薯坏疽病菌有拮抗作用的内生细菌,且同时具有固氮和产吲哚乙酸(IAA)能力,崔月贞等[5]从矮生蒿草中分离出内生细菌264AY1对马铃薯炭疽、坏疽及枯萎病具有防病促生作用,郭海等[6]报道了高寒草地牧草内生细菌对马铃薯炭疽病菌具有防病作用,畅涛等[7]也报道了珠芽蓼内生细菌对马铃薯晚疫病有防病促生作用。
但是,内生细菌的种类、数量及功能会因地区和宿主植物不同而有差异[8]。甘肃省定西市干旱少雨,这种特殊生境马铃薯块茎内生细菌对块茎病原真菌是否有抑菌能力以及抑菌能力如何尚不清楚,因此,本研究对甘肃省定西市马铃薯块茎内生细菌进行分离,筛选块茎病原真菌的拮抗菌株,并对优良拮抗菌株进行鉴定,以期为马铃薯内生细菌的开发利用奠定基础,也为马铃薯块茎病害生物防治提供菌种资源。
1 材料与方法
1.1 材料
供试马铃薯内生细菌:分离自甘肃省定西市马铃薯块茎。
供试病原菌:马铃薯黑痣病菌Rhizoctonia solani、马铃薯干腐病菌Fusarium solani、马铃薯坏疽病菌Phoma foveata、马铃薯炭疽病菌Colletotrichum coccodes和马铃薯枯萎病菌Fusarium avenaceum等,均由甘肃农业大学植物保护学院植物病原细菌及生物多样性实验室提供。
培养基:马铃薯葡萄糖琼脂(potato dextroseagar,PDA)培养基,用于马铃薯炭疽病菌、坏疽病菌、黑痣病菌、干腐病菌和枯萎病菌培养及对峙培养; 肉汁胨(BPA)培养基[9],用于马铃薯内生细菌的分离及活化。阿须贝无氮培养基[10],用于测定内生细菌固氮功能。Pikovaskaias(PKO)培养基[11],用于测定内生细菌溶磷功能。金氏培养基[10],用于测定内生细菌产IAA能力。
1.2 马铃薯块茎内生细菌的分离和纯化
将马铃薯块茎用自来水冲洗干净,依次用75%乙醇表面消毒4 min和10%次氯酸钠表面消毒1 min,再用无菌水漂洗块茎3次;将消毒块茎表面与固体平板接触3~5 min,后放置于28℃的恒温箱中培养3~5 d,若平板中无菌落生长,说明表面灭菌彻底,否则分离结果不可用;用打孔器(直径=10 mm)从薯块取出样品,用无菌手术刀切取10 mm,置于研钵中研磨,加无菌水10 mL,静置30 min后,梯度稀释到浓度为10-1~10-4,取200 μL涂布于BPA平板,每浓度涂平板3个,置于28℃恒温箱中培养,培养3~5 d后,挑取不同形态的菌落重新于固体平板上划线纯化,编号和保存,备用。内生细菌编号以马铃薯样本号-内生细菌分离号表示,例如菌株6-5,6为马铃薯样本编号,5为内生细菌分离编号。
1.3 拮抗菌株筛选
采用平板对峙培养法筛选拮抗菌株。将供试病原菌于PDA培养基上活化培养后,在菌落边缘菌丝生长旺盛处打取直径为0.6 cm的菌饼,接种在PDA培养基中央,再取经过48 h在BPA培养基中活化培养的拮抗菌点接于距菌饼3 cm处,每平板4点,3次重复,以只接种供试病原菌为对照,置于25℃生化培养箱中培养5~7 d,用十字交叉法测量菌落直径,统计数据并计算抑菌率。
抑菌率=(对照真菌菌落直径-受抑制真菌菌落直径)/(对照真菌菌落直径-0.6)×100%。
1.4 优良拮抗菌株生物功能测定
1.4.1 固氮能力测定
将优良拮抗内生细菌接种于阿须贝无氮平板和液体培养基内,以无菌水为对照,3次重复,平板置于28℃培养箱培养,液体培养基置于120 r/min振荡培养,第7天平板上有菌落和液体培养基变浑浊者为阳性。
1.4.2 溶磷能力测定
将优良拮抗内生细菌点接于Pikovaskaias(PKO)培养基上,28℃培养14 d后观察解磷圈,3次重复;根据解磷圈与菌落直径比值大小确定其溶磷能力。
1.4.3 产IAA能力测定
定性测定:将优良拮抗内生细菌分别接种于含100 mg/L色氨酸和不含色氨酸的金氏培养液中,以加等量无菌水为对照,于28℃、120 r/min恒温振荡培养12 d,取50 μL加入等量比色液(PC比色液或S2比色液),室温静置15 min后,观察显色反应,3次重复均变红色表示能分泌IAA。
定量测定:将培养12 d的菌悬液和对照离心(4℃,10 000 r/min,10 min),取4 mL上清液加入等量比色液,黑暗静置30 min后测定OD530,重复测3次,以加比色液的空白对照调零。根据标准曲线计算优良拮抗内生细菌分泌IAA量。
1.5 优良拮抗细菌的鉴定
1.5.1 菌落形态特征观察
在 BPA 固体培养基上划线,置于28℃培养箱,48 h后观察内生细菌菌落形态特征并描述和照相。
1.5.2 菌体形态观察
将优良拮抗内生細菌在BPA 平板上培养18~24 h后革兰氏染色,观察菌体颜色和形态,并显微拍照。
1.5.3 16S rDNA序列分析
提取优良拮抗内生细菌的基因组DNA并进行PCR扩增。利用gyrB基因引物:UP1S(5′GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3′),UP2R(5′-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT-3′)[11],采用50 μL 扩增反应体系:Taq Mixture 25 μL、引物UP1S和引物UP2R各 2 μL、DNA 模板 2 μL、ddH2O 19 μL。扩增条件:95℃ 预变性 3 min;94℃变性30 s,55℃退火45 s,72℃延伸1 min,35个循环;最后在 72℃ 下延伸10 min,终止反应。经检测具特异性条带的PCR扩增产物送西安擎科基因生物有限公司测序,所测序列与 GenBank 数据库中序列进行同源性对比,采用 Clustal 1.8 软件和 MEGA 7.0 软件构建系统发育树,确定其系统发育学地位。
1.6 数据分析
运用 Excel 2007和SPSS 19.0 统计分析软件处理数据。
2 结果与分析
2.1 内生细菌的分离纯化
选取6个马铃薯样本,从平板上依据菌落形状、光泽、颜色和大小等挑取不同单菌落,多次划线纯化后共获得72株内生细菌,编号保存备用;对照没有细菌菌落长出,说明表面消毒彻底,所得细菌均为内生细菌。
2.2 拮抗菌株筛选
经对峙培养,72株内生细菌中有19株对5种供试病原菌的抑菌率在51.87%以上,占分离总数的26.38%,其中菌株6-5和5-6对5种指示菌均有较好拮抗作用,分别对马铃薯炭疽病菌和马铃薯黑痣病菌抑菌率达85.82%和72.18%(图1和表1)。故本试验对其进行了下一步研究。
2.3 生物功能测定
5-6和6-5菌株不具有溶磷能力,具有固氮和产IAA能力,其中产IAA量分别为19.25 mg/L和3.37 mg/L。
2.4 内生细菌的鉴定
2.4.1 菌落形态
5-6菌株:菌落直径1.5 mm,边缘不规则,表面褶皱,呈火山状突起,不透明,乳白色(图2)。
6-5菌株:菌落直径2.5 mm,边缘不规则,表面黏稠无光泽,中间云雾状散开,不透明,乳白色(图2)。
2.4.2 菌体形态
19株拮抗内生细菌均为杆状,4株为革兰氏阴性菌,15株为革兰氏阳性菌,其中5-6和6-5菌株均为革兰氏阳性菌(表1和图3)。
2.4.3 16S rDNA基因序列鉴定
通过测序,并与GenBank数据库中序列比对和构建系统发育树,5-6及6-5菌株分别与芽胞杆菌属的 Bacillus atrophaeus(JQ916085)和Bacillus velezensis(LC191187)的一致性在99%以上,且在系统发育树上聚在一起(图4),初步将菌株5-6鉴定为萎缩芽胞杆菌Bacillus atrophaeus,菌株6-5鉴定为贝莱斯芽胞杆菌Bacillus velezensis。
3 结论与讨论
植物内生细菌是一个庞大的微生物类群, 种类繁多, 分布于宿主植物的不同部位[13],可以诱导植物产生抗病性和促进植物生长,目前已经有许多内生细菌成功应用于植物病害防治[14]。本试验从马铃薯块茎中分离出72株内生细菌,与崔林等[9]从8个不同来源3个马铃薯品种块茎中分离到240个内生菌株的结果相比较,本试验分离数量较少,这可能与本试验仅选用了一个地区一个品种的马铃薯有关,也可能是化学消毒剂杀死部分内生细菌,导致内生细菌数量和种类减少[15],也与植株的生育期和栽培季节等有关[16]。
分离自马铃薯块茎的72株内生细菌中有19株对5种病原真菌拮抗作用在51.87%以上,占总数的26.4%,与崔林等[9]报道的拮抗菌株占总数22.9%的结论相似。内生细菌的抑菌机制是其能产生多种不同的具有抗菌、抗病毒、杀虫、免疫抑制、抗氧化和降糖等活性的代谢产物[17],此外,内生细菌还可以增加植物对生物或者非生物胁迫的耐受性[18],但本试验仅对菌株5-6与6-5的抑菌能力进行了测定,其代谢产物及抑菌机制等还需进一步研究。
目前已经鉴定的内生细菌超过50个属[20], 其中许多文献报道从植株上分离出具有良好拮抗作用的芽胞杆菌[21-23],其通过竞争营养和空间位点、产生抗菌物质、溶菌作用和诱导植物抗病性等方面来发挥其防病促生作用[24-26]。本试验中,内生细菌对5株病原真菌均有良好的抑制作用,其中5-6与6-5均为芽胞杆菌,说明芽胞杆菌是内生细菌中主要拮抗细菌。
本试验筛选的菌株5-6和6-5具有良好的抑菌作用,且具有固氮能力和产IAA能力,为马铃薯块茎真菌病害的生物防治提供了菌种资源,也为马铃薯块茎内生细菌资源的开发奠定了基础。
参考文献
[1] 方珍娟,张晓霞,马立安.植物内生菌研究进展[J].长江大学学报(自然科学版),2018,15(10):41-45.
[2] PROMPUTTHA I, LUMYONG S, DHANASEKARAN V, et al. A phylogenetic evaluation of whether endophytes become saprotrophs at host senescence [J]. Microbial Ecology, 2007, 53(4): 579-590.
[3] GUO B, WANG Y, SUN X, et al. Bioactive natural products from endophytes: A review [J]. Applied Biochemistry and Microbiology, 2008, 44(2):136-142.
[4] 杨成德,王颖,王玉琴,等.东祁连山高寒草地几株醉马草内生细菌的生物功能评价及鉴定[J].草业学报,2014,23(5):249-255.
[5] 崔月贞,姚玉玲,杨成德,等.矮生嵩草内生细菌264AY1的鉴定及其生物功能测定[J].中国草地学报,2016,38(2):98-102.
[6] 郭海,杨成德,姚玉玲,等.高寒草地牧草内生细菌262AG6拮抗功能测定及鉴定[J].西北农业学报,2017,26(10):1529-1536.
[7] 畅涛,杨成德,薛莉,等.珠芽蓼內生菌ZA1对马铃薯的防病促生研究[J].草业学报,2015,24(12):83-91.
[8] 叶雷,付雨,张笑萍,等.块菌(松露)宿主可培养内生菌群落结构与多样性研究[J].微生物学杂志,2018,38(2):21-28.
[9] 崔林,孙振,孙福在,等.马铃薯内生细菌的分离及环腐病拮抗菌的筛选鉴定[J].植物病理学报,2003,33(4):353-358.
[10] 崔月贞,杨小利,杨成德,等.拮抗马铃薯晚疫病菌的高寒草地牧草内生细菌的鉴定及其生物功能测定[J].植物保护学报,2016,43(5):789-795.
[11] 黄达明,李倩,管国强,等.一株解磷细菌的筛选、鉴定及其溶磷培养条件的优化[J].生物技术通报,2015,31(2):173-178.
[12] YAMAMOTO S, HARAYAMA S. PCR amplification and direct sequencing of gyrB genes with universal primers and their application to the detection and taxonomic analysis of Pseudomonas putida strains [J]. Applied Environmental Microbiology, 1995, 61(3): 1104-1109.
[13] 吴道军,谭兴晏,万涛.内生细菌生防作用及机理简述[J].绿色科技, 2016(23):5-6.
[14] 李俊州,文才艺.植物病害生防细菌研究进展[J].河南农业科学,2015,44(10):1-7.
[15] 李艳琴,申泉,刘彬彬,等.番茄内生菌分离及其ERIC-PCR指纹图谱分析[J].微生物学通报, 2003, 30(5):89-93.
[16] 黎起秦,罗宽,林纬,等.内生菌B47的定殖能力及其对番茄青枯病的防治作用[J].植物保护学报,2006(4):363-368.
[17] 黄敬瑜,张楚军,姚瑜龙,等.植物内生菌生物抗菌活性物质研究进展[J].生物工程学报, 2017, 33(2):178-186.
[18] PURI A, PADDA K P, CHANWAY C P. Nitrogen-fixation by endophytic bacteria in agricultural crops: Recent advances [M] Nitrogen in Agriculture-Updates, 2018.
[19] 易龙,马冠华,肖崇刚.烟草根黑腐病拮抗内生细菌的筛选及其抑菌作用[J].微生物学通报, 2012, 39(10):1464-1470.
[20] BAIS H P, FALL R, VIVANCO J M. Biocontrol of Bacillus subtilis against infection of Arabidopsis roots by Pseudomonas syringae is facilitated by biofilm formation and surfactin production [J]. Plant Physiology, 2004, 134(1):307-319.
[21] JULKOWSKA D, OBUCHOWSKI M, HOLLAND I B, et al. Comparative analysis of the development of swarming communities of Bacillus subtilis 168 and a natural wild type: critical effects of surfactin and the composition of the medium[J]. Journal of Bacteriology, 2005, 187(1):65-76.
[22] 馬佳,李颖,胡栋,等.芽胞杆菌生物防治作用机理与应用研究进展[J].中国生物防治学报, 2018(4):639-648.
[23] 宋利沙,蒋妮,缪剑华,等.肿节风炭疽病拮抗细菌的筛选与鉴定[J].植物保护,2018,44(6):61-65.
[24] 杨定祥,林巧玲,卢乃会,等.拮抗辣椒疫霉菌海洋细菌菌株SH-27的筛选鉴定及其防病促生作用[J].微生物学通报,2018,45(1):54-63.
[25] 魏立娟,王玉琴,杨成德,等.青海省海晏县线叶嵩草内生细菌的生物功能鉴定及测定[J].草地学报,2018,26(3):764-769.
[26] 程怀月,石先阳,弗赖森.草螺菌RE3-3合成生长素及其促生作用的研究[J].微生物学杂志,2017,37(5):20-26.
(责任编辑: 田 喆)
