云南省汉族人群LMP基因多态性与结核病易感性的关联性研究*
2020-06-08刘楠楠刘舒媛王辉张新文李传印史荔张淑琼
刘楠楠, 刘舒媛, 王辉, 张新文, 李传印, 史荔, 张淑琼**
(1.中国医学科学院 & 北京协和医学院 医学生物学研究所 & 云南省重大传染病疫苗研发重点实验室, 云南 昆明 650118; 2.昆明市第三人民医院, 云南 昆明 650118)
结核病(tuberculosis,TB)是由结核分枝杆菌引起的感染性疾病,是危害人类健康的主要传染病之一[1]。据WHO《2019年全球结核报告》显示,TB的患病率和死亡率一直高居不下。目前全球约有25%的人口感染了结核分枝杆菌,但只有5%~10%的感染者会发展成为有临床症状的TB患者,表明TB的发生还与个体的遗传因素相关[2-3],研究发现宿主遗传因素对TB的发生发展具有重要的作用。低相对分子量蛋白酶体(low molecular weight proteasome,LMP)又称为β蛋白酶体亚单位(proteasome subunit beta,PSMB),位于6号染色体MHC-Ⅱ类基因座区域,由LMP2(PSMB9)和LMP7(PSMB8)组成[4]。LMP2和LMP7是蛋白酶体β亚基家族的成员,编码蛋白酶体复合物的催化亚基,参与内源性或外源性抗原的降解[5]。LMP可将抗原水解为合适的肽段,水解后的肽段经抗原相关转运体(TAP)转运后与MHCⅠ类分子连接,表达于细胞表面供CD8+T细胞识别[6]。因此LMP基因位点的突变可能会导致LMP基因表达异常从而影响自身免疫应答。目前已有多项研究发现LMP基因的单核苷酸多态性(single nucleotide polymorphism,SNP)与感染性疾病[7-8]、自身免疫性疾病[9]和癌症[10-13]相关。本研究选取LMP2基因的3个SNP位点rs1351383、rs17587、rs2127675和LMP7基因的1个SNP位点rs2071543,并分析LMP基因多态性与云南汉族人群TB病的相关性,报告如下。
1 资料与方法
1.1 样本收集
根据知情同意原则,选取2018-2019年在昆明市第三人民医院就诊并确诊为TB的449例患者作为病例组。病例组的纳入标准:(1)国家肺TB诊断标准(WS288-2017)标准,根据患者的临床表现、结核抗酸染色和影像学检查确诊为TB;(2)无合并感染或其他疾病;(3)临床资料完整。根据我国TB分类标准(WS196-2017)将病例组再分为肺结核组和肺外结核组,肺TB指病变发生在肺、气管、支气管或胸膜等部位,肺外TB指病变发生在肺以外的部位;根据治疗史,将病例组再分为初治组和复治组。选取同期参加体检的367例健康人群作为对照组。对照组的纳入标准:(1)经痰涂片结核抗酸检查为阴性的个体;(2)既往无TB史;(3)无其他疾病;(4)临床资料完整。所有受试者均为居住于云南地区的无亲缘关系的汉族个体。
1.2 方法
1.2.1样本DNA提取 采集研究对象静脉血5 mL(EDTA抗凝),使用全血基因组DNA提取试剂盒(QIAamp DNA Blood Mini Kit,德国QIAGEN公司,货号 51106)提取外周血基因组DNA,超微量紫外可见分光光度计 (Multiskan GO,美国ThermoFisher Scientific公司)检测DNA的浓度及纯度后于-20 ℃保存备用。
1.2.2LMP基因SNPs位点的选择 结合文献报道和Ensemble数据库(http://asia.ensembl.org/index.html)查询,纳入在东亚洲人群中最低等位基因频率>0.1的位点进行研究。
1.2.3LMP基因SNP检测 设计SNP位点特异性的扩增引物和延伸引物,扩增引物和延伸引物信息见表1。扩增体系为模板DNA (25 ng)、上下游引物(10 μmol/L)各2 μL、TSINGKE金牌Mix 45 μL,总反应体系50 μL。PCR扩增反应条件:98 ℃预变性 2 min,98 ℃变性10 s、60 ℃退火10 s、72 ℃延伸10 s(共30个循环)。PCR产物经SAP消化(37 ℃ 1 h、75 ℃ 15 min)后进行单链延伸,延伸体系:SAP消化后模板 2 μL、ABI SnapShot multiplex Mix 2 μL、SNP对应引物1 μL;延伸反应条件:98 ℃ 10 s、50 ℃ 5 s、60 ℃ 30 s(25个循环)。经测序仪(Applied Biosystems,3730XL)检测后通过峰的移动位置确定该延伸产物对应的SNP位点,根据峰的颜色可得知渗入的碱基种类,从而确定该样本的基因型。LMP2和LMP7基因的扩增引物和延伸引物信息见表1。
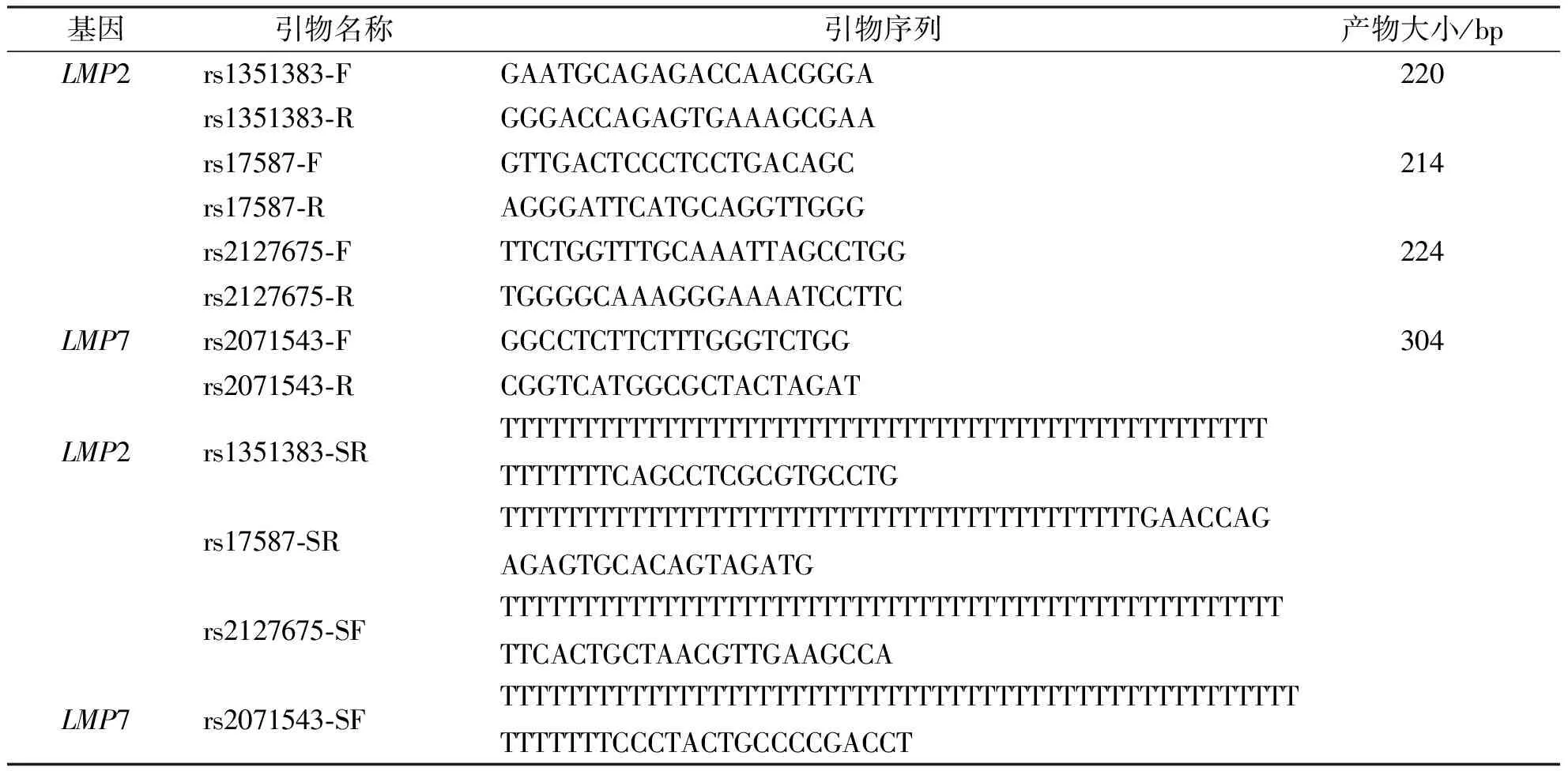
表1 LMP2和LMP7基因的引物序列Tab.1 Primer sequences for LMP2 and LMP7 genes
1.3 统计学方法
使用SPSS 23.0软件进行统计学分析,分别采用t检验和χ2检验对病例组和对照组中的年龄和性别的分布进行比较,哈迪-温伯格平衡用goodness-of-fitχ2检验进行计算。病例组和对照组间各SNP的等位基因、基因型频率差异用χ2检验进行比较。使用SHEsis[14]在线软件计算各SNP位点间的连锁不平衡,根据连锁不平衡(linkage disequilibrium, LD)结果构建单倍型,两位点间的LD关系用D′表示,D′>0.8认为位点间强连锁。病例组和对照组间的单倍型分布差异用χ2检验进行比较。采用SNPStats[15]在线软件对LMP基因的SNP位点进行遗传模式分析,根据赤池信息量准则(akaike information criterion,AIC)和贝叶斯信息准则(bayesian information criterions,BIC)的数值来确定每个位点的最优遗传模式,即具有AIC、BIC最小值的遗传模式。用于分析的遗传模式共包括5种:共显性遗传模式(codominant model)、显性遗传模式(dominant model)、隐性遗传模式(recessive model)、超显性遗传模式(overdominant model)及加性遗传模式(log-additive model)。统计学结果当P<0.05时具有统计学意义;多重比较的统计学结果使用Bonferroni校正,设定P<0.05/n(n=4)具有统计学意义。
2 结果
2.1 病例及对照组基本信息
本研究病例组共纳入TB患者449例,对照组纳入健康对照367例,病例组与对照组的性别和年龄比较差异无统计学意义(P=0.095、0.340)。纳入研究对象的基本特征见表2。
2.2 纳入研究的位点及Hardy-Weinberg平衡检验
本研究纳入LMP2基因的3个SNP位点rs1351383(A>C)、rs17587(G>A)、rs2127675(A>G)和LMP7基因1个SNP位点rs2071543(G>T);各SNPs位点信息见表3。4个SNP的基因型在病例组(P=0.843、0.394、0.864和0.827)和对照组(P=0.433、0.531、0.994和0.941)中的分布均符合Hardy-Weinberg 平衡检验(P>0.05),说明本研究所选取的样本是具有群体代表性的随机样本。
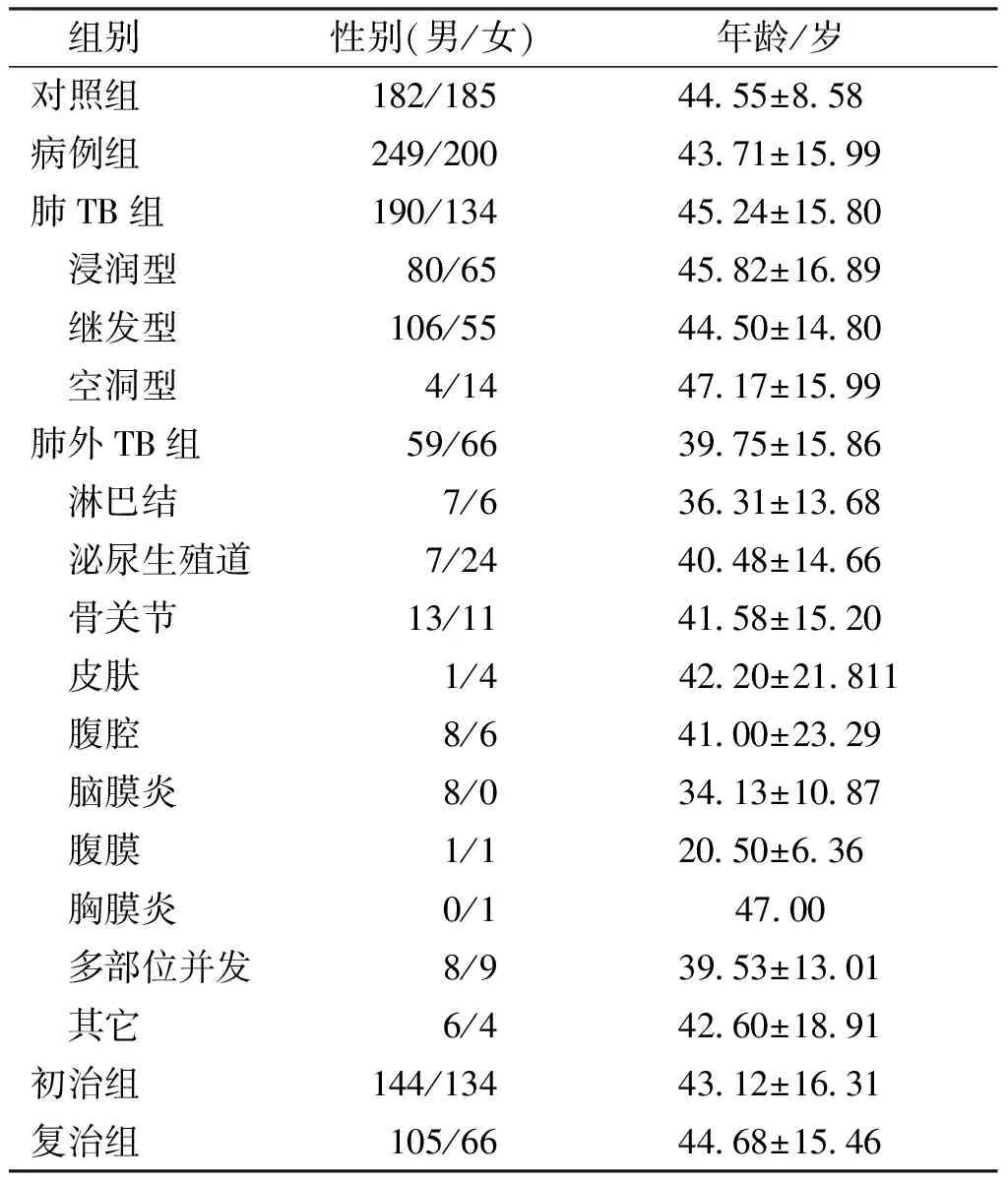
表2 研究对象基本特征Tab.2 Basic characteristics of the subjects

表3 LMP基因4个SNPs的位点信息Tab.3 The information of 4 SNPs of LMP gene
2.3 等位基因和基因型频率
结果显示,4个SNP位点的等位基因和基因型频率在病例组与对照组间比较,差异经Bonferroni校正后均无统计学意义(P>0.012 5)。见表4。
2.4 遗传模式分析
共显性遗传模式、显性遗传模式、隐性遗传模式、超显性遗传模式和加性遗传模式分析结果显示:4个SNP位点在其最优遗传模式下差异均无统计学意义(P>0.0125)。见表5。
2.5 LMP基因4个SNP构建的单倍型分析
对LMP基因的4个SNP位点进行连锁不平衡分析,结果显示4个位点间存在强连锁(D′>0.8),构建rs1351383-rs17587-rs2127675-rs2071543单倍型并分析频率>3%的单倍型在病例组和对照组中的分布差异,单倍型C-G-G-G在病例组中的频率显著高于对照组(P=0.004,OR=1.671,95%CI为1.176~2.372)。见表6。
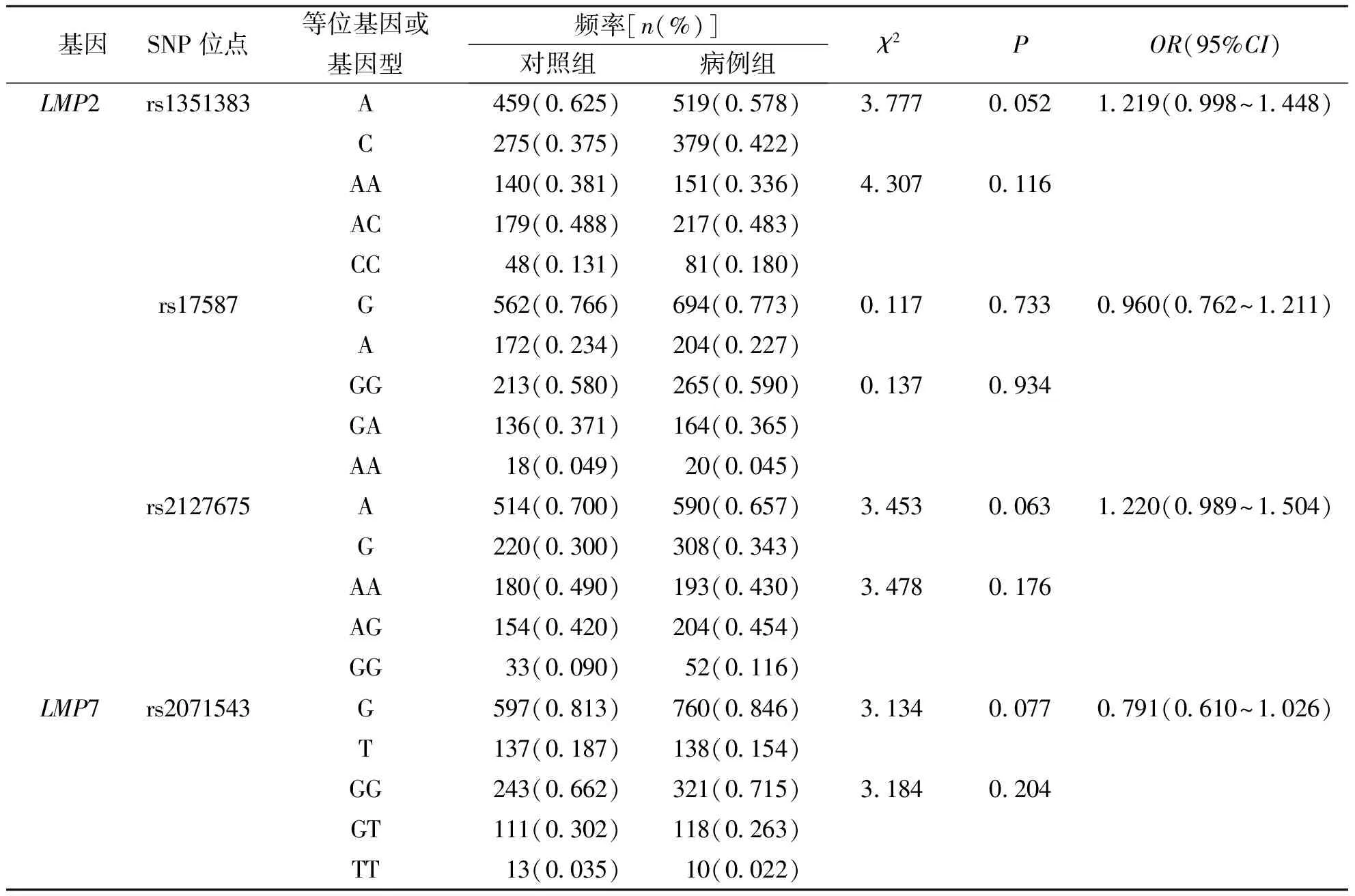
表4 病例组和对照组LMP基因的4个SNP位点的等位基因和基因型频率比较Tab.4 The frequencies of alleles and genotypes of 4 SNPs of LMP gene in TB group and control group
注:经Bonferroni校正后,当P<0.012 5时差异具有统计学意义。
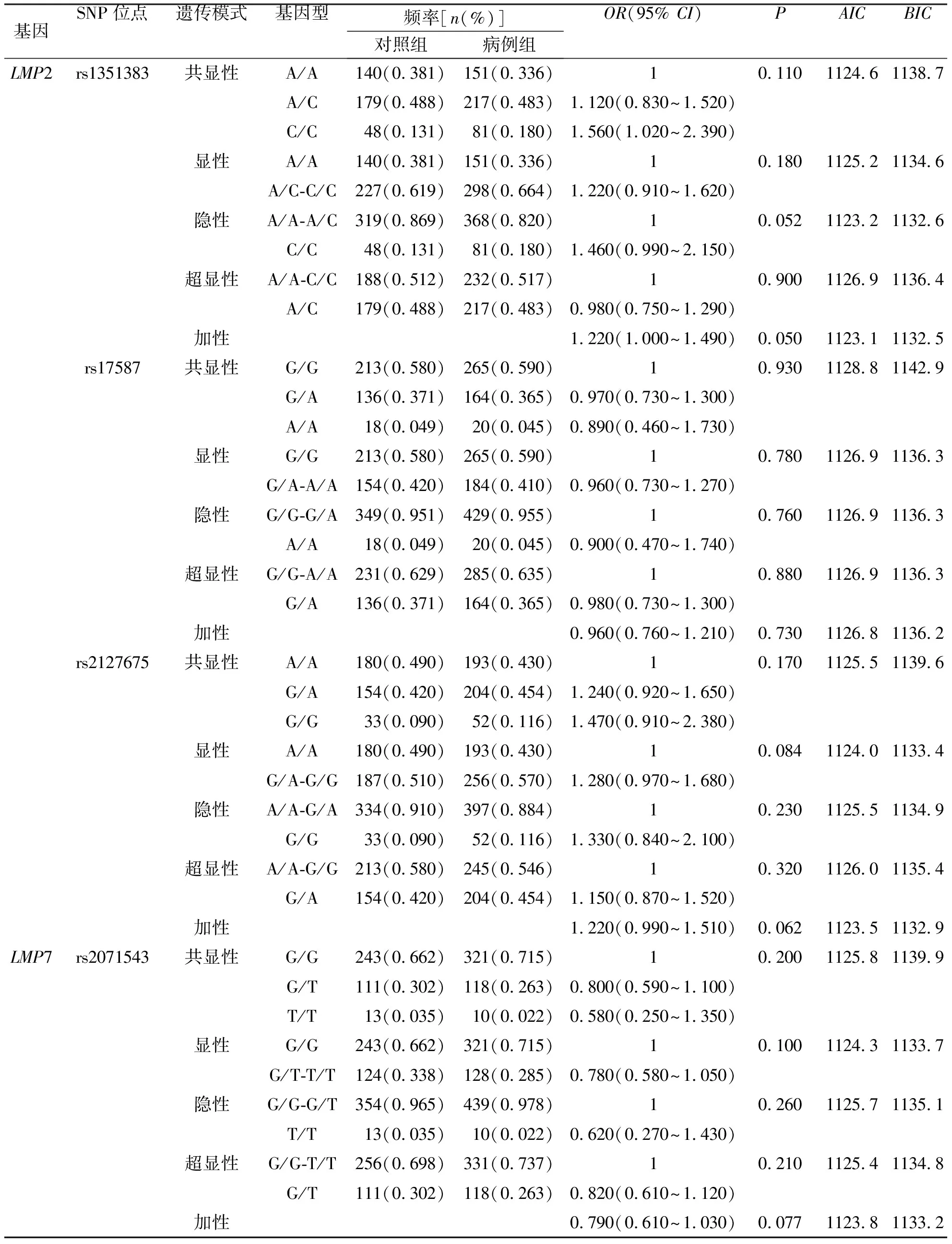
表5 病例组和对照组中4个SNP位点的遗传模式分析Tab.5 Analysis of inheritance models of 4 SNPs in TB group and control group
注:加性遗传模式表示TT×2+GT的基因型与GG基因型进行比较(多态性位点如为G>T的变异),经Bonferroni校正后,设置P<0.012 5有统计学意义。
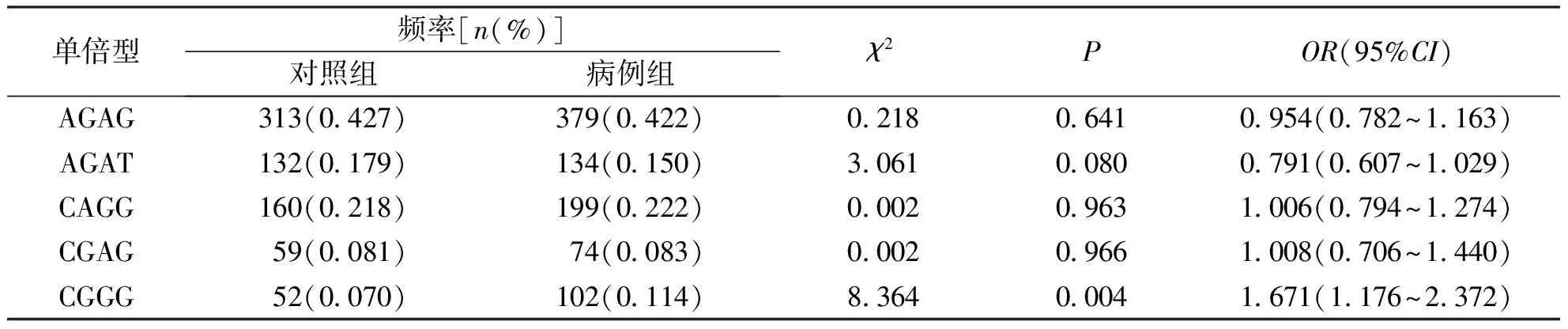
表6 病例组和对照组 LMP基因4个SNP位点单倍型频率比较Tab.6 Comparison of haplotypic frequency of 4 SNPs of LMP gene in TB group and control group
注:经Bonferroni校正后,当P<0.01有统计学意义。
2.6 分层分析
将病例组又分为肺结核组、肺外结核组、初治组和复治组进行分层分析。运用逻辑回归模型校正性别和年龄差异后结果显示:rs1351383的C等位基因在肺外结核组的频率显著高于对照组,2组间等位基因频率分布具有统计学意义(P=0.010,OR=1.377, 95%CI为 1.030~1.841);在最优遗传模式——加性遗传模式下,rs1351383的基因型分布差异具有统计学意义(P=0.008,OR=1.520,95%CI为1.120~2.080)。复治组与对照组、复治组与初治组的4个SNP等位基因和基因型频率差异均无统计学意义(P>0.05),见表7。构建LMP2基因的单倍型分析结果显示:rs1351383-rs17587-rs2127675-rs2071543单倍型C-G-G-G在肺外结核组中的频率(0.131)显著高于对照组中的频率(0.070)(P=0.003,OR=1.982,95%CI为1.246~3.154),经Bonferroni校正后,差异具有统计学意义(P<0.01)。
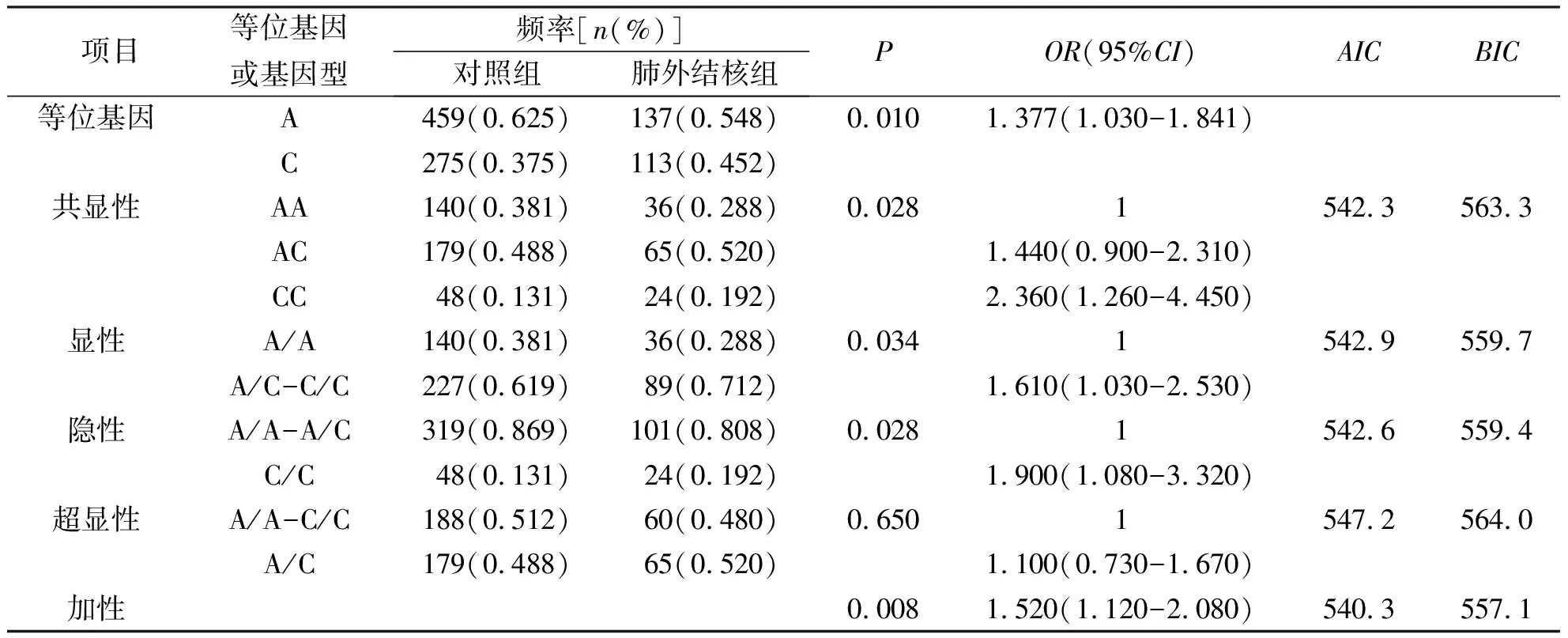
表7 肺外结核组和对照组中rs1351383的等位基因、基因型频率比较Tab.7 The frequencies of alleles and genotypes of rs1351383 in EPTB group and control group
注:经Bonferroni校正后,当P<0.0125有统计学意义。
3 讨论
LMP是1982年Monaco在分析鼠MHC-Ⅱ类分子的免疫沉淀复合物时得到的产物,因其分子量较MHC-Ⅰ、Ⅱ类分子低而得名[16]。基因敲除小鼠实验证明了LMP2和LMP7的作用,在LMP2基因突变小鼠的CD8+T淋巴细胞水平降低至野生型小鼠的60%~70%[17];在LMP7基因敲除小鼠中,细胞表面MHC Ⅰ类分子的表达水平适度降低至正常水平的55%~90%[18]。这些结果均表明LMP在抗原提呈过程中起着重要作用,LMP可以识别细胞内感染,降解内源性抗原肽,产生合适的C-端氨基酸残基[5],并通过MHC Ⅰ类分子和细胞毒性T淋巴细胞在人体免疫监测中发挥关键作用,因此LMP基因多态性可能会影响其自身功能的完整性,从而影响抗原的加工提呈,最终导致疾病的发生[19]。
有研究发现LMP基因多态性与TB的发生发展具有关联性,因此,本研究对LMP基因4个SNP位点的多态性与云南汉族人群TB病的发生发展的相关性进行研究,结果发现4个SNP位点的等位基因及基因型频率在病例组和对照组中的差异均无统计学意义,进行分层分析时发现,rs1351383的C等位基因频率在肺外结核组中的频率显著高于对照组,在加性遗传模式下携带rs1351383的C等位基因的有增加患肺外TB发生风险的趋势。进一步的单倍型分析显示rs1351383-rs17587-rs2127675-rs2071543单倍型C-G-G-G在病例组、肺外结核组中的频率均显著高于对照组。有研究报道,rs1351383的CC基因型显著增加了黑色素瘤的患病风险(CC vs AA:P=1.93×10-3,OR=1.590,95%CI为1.190~2.120),rs1351383可能参与并影响转录因子的结合和LMP2基因的表达,从而影响黑色素瘤的易感性[20]。Wang等[21]在黎族人群肺TB的研究显示:rs2071543的AA(P=0.002,OR=3.770,95%CI为1.600~8.890)和AC(P=0.0001,OR=2.970,95%CI为1.800~4.900)是肺TB发生的风险性因素。在rs2071543与癌症风险相关性的荟萃分析中发现AA基因型的个体比具有CC基因型的个体患癌症的风险高2.6倍(AA vs CC:P= 0.001,OR= 2.602,95%CI为 1.780~0.803),并在亚洲人群中观察到罹患癌症风险显著增加,但在白种人群中未发现rs2071543与癌症的相关性[13]。rs17587的多态性可影响LMP2基因的功能也在青少年高血压、多发性硬化症、糖尿病和结核杆菌感染的研究中均有报道[20]。LMP在抗原提呈过程中发挥着重要作用,LMP基因突变将导致MHCⅠ类分子不能负载抗原肽,使MHC I类分子表达下调[4]。已知LMP2基因rs17587和LMP7基因rs2071543是错义突变位点,研究表明rs17587和rs2071543的多态性会导致LMP的功能改变,从而削弱抗原加工能力,使细胞表面MHC I类分子和细胞毒性T淋巴细胞的表达水平降低,影响自身免疫应答导致机体免疫监测失败进而影响机体对疾病的易感性[12,19],因此LMP的异常表达会导致多种疾病和恶性肿瘤的发生。但本研究中未发现rs17587和rs2071543的基因型与TB病相关。造成上述各研究结果差异的原因可能是多态性位点的等位基因频率在不同人群中的分布差异所导致,也可能与纳入研究的样本量或疾病类型有关。
综上所述,云南汉族人群中LMP2基因的rs1351383-C等位基因及其构建的单倍型rs1351383-rs17587-rs2127675-rs2071543单倍型C-G-G-G可能增加肺外TB的患病风险。进一步扩大样本量研究及功能验证,将为TB病的治疗及预后提供新的依据。
