异搏定通过抑制TXNIP介导的细胞凋亡和炎症减轻高脂喂养小鼠的糖尿病前期神经病变
2020-06-08阿克拜尔乌普岳薇薇
叶 婷 阿克拜尔·乌普 岳薇薇 马 丽
糖尿病是一种由于胰岛素分泌异常而引起高血糖的代谢性疾病,是并发症最多的一种疾病,主要症状为多饮、多食、多尿、体重下降,长期高血糖会导致严重的心脏、脑、肾脏、眼以及神经系统的病变[1]。糖尿病患者中约有10%在初次诊断时就已经伴有神经损伤,包括触觉、温觉、痛觉等损伤[2]。并且已有研究表明糖尿病前期也会出现神经病变[3]。但是临床上并没有有效的方式来治疗糖尿病前期神经病变,因此寻找有效的糖尿病前期神经病变治疗药物对于糖尿病的治疗至关重要。异搏定又称维拉帕米是用于治疗心血管疾病的有效药物,目前已有临床研究表明异搏定能够增强胰岛素的分泌,或可用于糖尿病的治疗[4]。但其对糖尿病前期神经病变的影响及机制尚未报道。本研究探究了异搏定对高脂喂养小鼠的糖尿病前期神经病变的影响,旨在为糖尿病前期神经病变治疗提供帮助。
材料与方法
1.材料:C57BL/6小鼠,高脂饲料(卡文斯实验动物有限公司);链脲佐菌素(STZ)(索莱宝生物科技有限公司);维拉帕米片(广东华南药业集团有限公司);TNF-α、IL-1β、IL-6检测试剂盒(福麦斯生物技术有限公司);ACCU-CHEK Advantage血糖仪、血糖试剂条(德国罗氏公司);TUNEL凋亡试剂盒(美国Solarbio公司);反转录试剂盒、qPCR检测试剂盒(爱必梦生物技术有限公司);GAPDH、TXNIP、NLRP3抗体、山羊抗兔二抗(武汉三鹰生物技术有限公司)。
2.糖尿病前期神经病变小鼠造模及给药:4周龄C57BL/6小鼠分为对照组、模型组和异搏定组,对照组给予正常饮食,模型组和异搏定组小鼠给予高脂饮食,每两周尾静脉采血,利用血糖仪检测血糖变化;与对照组比较,模型组和异搏定组小鼠首次出现显著高血糖时检测模型组小鼠坐骨神经传导速度,选定神经传播速度显著降低的小鼠作为糖尿病前期神经病变模型。对照组选用10只健康的C57BL/6,模型组和异搏定组各选10只糖尿病前期神经病变小鼠,异搏定组小鼠灌胃给予异搏定,剂量为0.5g/kg,2次/天,对照组和模型组小鼠给予等体积的0.9%氯化钠溶液,给药30天,每5天检测各组小鼠血糖水平。
3.坐骨神经传导速度的测定:给药结束后,腹腔注射水合氯醛麻醉小鼠,使用生理记录仪检测坐骨神经传导速度(MNCV),在右侧坐骨切迹插入刺激电极,在踝部(远端)和左足底第2趾间分别插入记录电极,记录双通道复合动作电位,以两对记录电极间距离S(mm)除以两通道复合动作电位潜伏期之差△t(ms)来计算 MNCV。每间隔1min,重复电刺激 3 次,取其平均值,计算MNCV。
4.HE染色检测各组小鼠坐骨神经病理变化:给药结束后,解剖小鼠取坐骨神经组织,于组织固定液中固定24h,固定后将组织用梯度乙醇脱水、透明、石蜡包埋后制成组织切片,然后将石蜡切片进行透明水化,经过苏木精-伊红染色、封片后于显微镜下拍照,观察组织病理变化。
5.Elisa检测各组小鼠血清炎性因子TNF-α、IL-1β、IL-6水平:给药结束后,各组小鼠眼眶取血,室温静置1h后,3500r/min,4℃离心15min,取上层血清,按照Elisa试剂盒方法检测血清炎性因子TNF-α、IL-1β、IL-6水平,主要步骤为铺好一抗的96孔板内加入40μl待测样品和10μl生物素标记抗体后,再加入100μl辣根过氧化物酶标记抗体,37℃孵育75min,清洗96孔板后加入显色剂显色,终止后于450nm波长处测吸光度,根据标准曲线计算血清TNF-α、IL-1β、IL-6含量。
6.原位缺口末端转移酶标记法(TUNEL)检测各组小鼠坐骨神经细胞凋亡:给药结束后,解剖小鼠取坐骨神经组织,于组织固定液中固定24h后制备石蜡切片,将制备好的石蜡切片经常规二甲苯及各梯度乙醇脱蜡至水,然后蒸馏水水化5min后,用0.1mol/L枸橼酸缓冲液(pH 6.0)中进行热修复,分别经过3%H2O2甲醇液、0.1%TritonX-100、20%牛血清、TUNEL 反应混合液、POD 转化剂孵育及PBS冲洗后,DAB 溶液显色,并在显微镜下观察,终止后用迈耶苏木精染核,PBS 冲洗后,甘油封片剂封片,显微镜下观察并计算坐骨神经凋亡细胞数目。
7.RT-qPCR检测各组小鼠坐骨神经组织中TNF-α、IL-1β、IL-6表达:给药结束后,取各组小鼠坐骨神经组织,立刻置于液氮中保存。取液氮保存小鼠坐骨神经组织加入Trizol研磨至组织完全裂解,取研磨液加入200μl氯仿,静置5min后,于12000×g,4℃离心15min,转移上层水相,加入500μl异丙醇,12000×g,4℃离心10min,去上清,1ml 75%乙醇清洗RNA沉淀后,20μl RNA-free水重悬RNA沉淀,55℃水浴10min,即为总RNA。使用primer premier5.0软件设计TNF-α、IL-1β、IL-6引物,按照cDNA合成试剂盒和RT-qPCR试剂盒进行反转录和RT-qPCR,采用ΔΔCT法计算TNF-α、IL-1β、IL-6表达量。
8.Western blot法检测各组小鼠坐骨神经组织TXNIP和 NLRP3表达水平:取各组小鼠坐骨神经组织,加入Trizol研磨均匀,然后加入1.5ml的异丙醇,12000×g,4℃离心10min,去上清,用蛋白清洗液清洗3次后,用1%的SDS溶液重悬沉淀,即为总蛋白。BCA蛋白定量后进行SDS-PAGE凝胶电泳,转膜,用5%的脱脂牛奶对PVDF膜封闭2h,然后以稀释后的GAPDH、TXNIP、NLRP3一抗4℃孵育过夜,TBST洗膜后二抗室温孵育1.5h,再用TBST洗膜后按照ECL试剂盒说明书配置发光液,并将PVDF膜浸入发光液中反应0.5min,曝光并拍照,用Image J软件曝光结果进行定量分析。

结 果
1.给药期间各组小鼠血糖变化:模型组小鼠血糖水平显著高于对照组小鼠血糖水平(P<0.05),异搏定组小鼠血糖水平显著低于模型组小鼠血糖水平(P<0.05),详见图1。
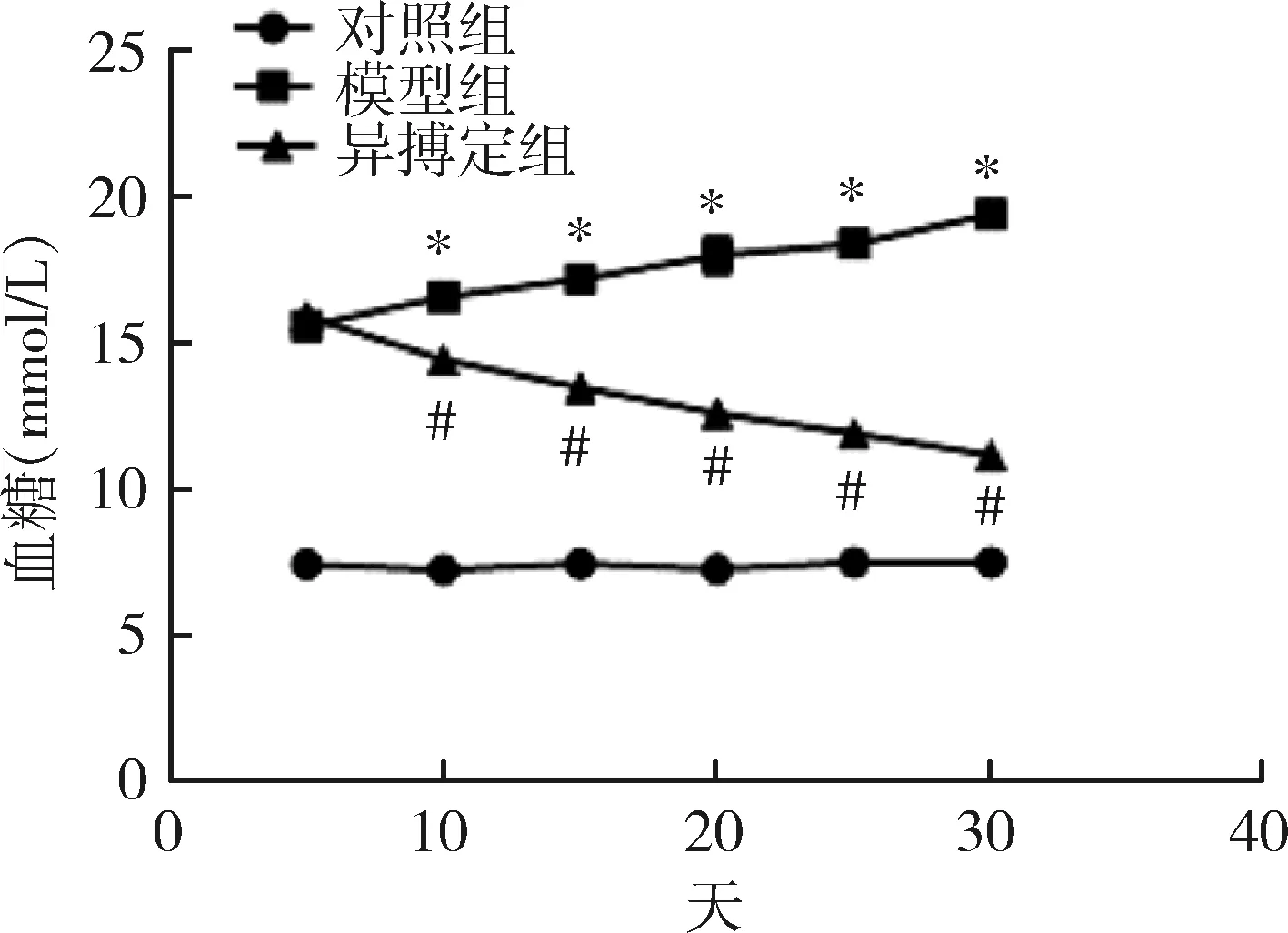
图1 给药期间各组小鼠血糖变化与对照组比较,*P<0.05;与模型组比较,#P<0.05
2.异搏定对糖尿病前期神经病变小鼠坐骨神经传导速度的影响:给药后各组小鼠坐骨神经传导速度检测结果详见表1,与对照组比较,模型组小鼠坐骨神经传导速度显著下降(P<0.05);而异搏定组小鼠坐骨神经传导速度显著高于模型组(P<0.05)。
表1 给药后各组小鼠MNCV检测结果
与对照组比较,*P<0.05;与模型组比较,#P<0.05
3.异搏定对糖尿病前期神经病变小鼠坐骨神经组织病理变化影响:根据HE染色结果,对照组小鼠坐骨神经纤维排列整齐,组织结构完整,纤维形状规则,髓鞘颜色均匀,没有病理变化;模型组小鼠坐骨神经结构紊乱,纤维细胞排列不均匀,髓鞘显著变薄且分布不均匀,轴索变细甚至收缩,病理变化显著;异搏定组小鼠坐骨神经组织病变显著缓解,纤维细胞排列较整齐,组织结构损伤显著缓解,髓鞘颜色均匀(图2)。
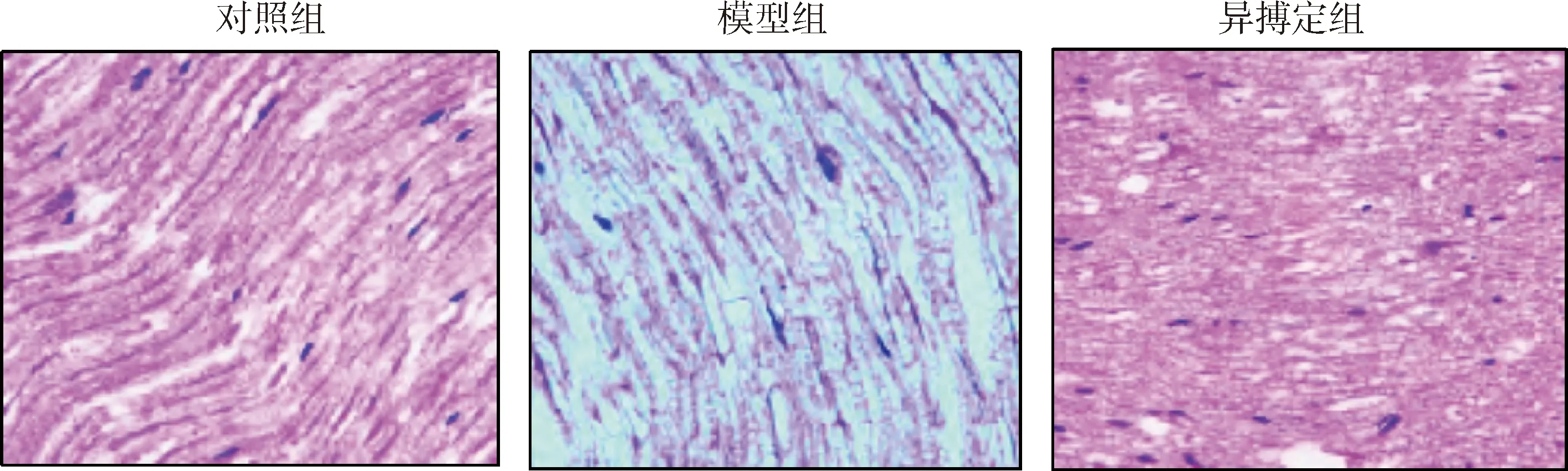
图2 各组小鼠坐骨神经组织HE染色结果(×200)
4.异搏定对糖尿病前期神经病变小鼠血清炎性因子的影响:Elisa检测各组小鼠血清炎性因子结果显示,模型组小鼠血清炎性因子TNF-α、IL-1β、IL-6显著高于对照组(P<0.05);而与模型组比较,异搏定组小鼠血清炎性因子TNF-α、IL-1β、IL-6显著下降(P<0.05,表2)。
表2 给药后各组小鼠血清炎性因子TNF-α、IL-1β、IL-6水平比较
与对照组比较,*P<0.05;与模型组比较,#P<0.05
5.异搏定对糖尿病前期神经病变小鼠坐骨神经细胞凋亡的影响:TUNEL法检测各组小鼠坐骨神经组织细胞凋亡结果显示,与对照组比较,模型组小鼠坐骨神经细胞凋亡显著增加(P<0.05);与模型组比较,异搏定组小鼠坐骨神经细胞凋亡显著缓解(P<0.05,表3)。
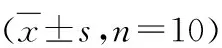
表3 给药后各组小鼠坐骨神经细胞凋亡率比较
与对照组比较,*P<0.05;与模型组比较,#P<0.05
6.异搏定对糖尿病前期神经病变小鼠坐骨神经组织炎性因子表达影响:RT-qPCR检测结果显示,与对照组比较,模型组小鼠坐骨神经组织中TNF-α、IL-1β、IL-6表达水平显著上调(P<0.05);与模型组比较,异搏定组小鼠坐骨神经组织中TNF-α、IL-1β、IL-6表达水平显著下调(P<0.05,表4)。

表4 给药后各组小鼠坐骨神经组织炎性因子TNF-α、IL-1β、IL-6表达水平比较
与对照组比较,*P<0.05;与模型组比较,#P<0.05
7.异搏定对各组小鼠坐骨神经组织TXNIP、NLRP3表达影响:Western blot法检测结果显示,模型组小鼠坐骨神经TXNIP、NLRP3表达量显著上升(P<0.05),而异搏定组小鼠坐骨神经组织TXNIP、NLRP3表达量显著降低(P<0.05,图3,表5)。

图3 各组小鼠坐骨神经组织TXNIP、NLRP3表达结果
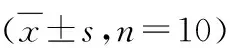
表5 各组小鼠坐骨神经组织TXNIP、NLRP3表达水平比较
与对照组比较,*P<0.05;与模型组比较,#P<0.05
讨 论
糖尿病是一种由于胰岛素分泌缺陷或胰岛素作用障碍所致的代谢性疾病,并且长期高血糖会引发多种糖尿病并发症,导致多器官衰竭及糖尿病晚期神经系统严重病变,发生率可达85%,主要临床表现为肢端麻木、感觉异常、痛觉过敏、触觉异常、腱反射减弱或消失等[5,6]。目前临床上的治疗方法主要为控制血糖、阵痛治疗以及提供神经营养物质等,但治疗效果并不显著。近年来,逐渐有研究表明,糖尿病在发病初期就已经伴随着神经病变[7]。若在糖尿病发病初期就能采取治疗,抑制神经病变的发展,对于糖尿病并发症的治疗至关重要。异搏定是一种用于心血管疾病治疗的药物,但是逐渐有研究报道异搏定可用于糖尿病的预防和治疗[8]。然而异搏定对糖尿病前期神经病变的影响尚无明确报道,本研究通过构建糖尿病前期神经病变小鼠模型,发现异搏定能够显著缓解糖尿病小鼠高血糖以及坐骨神经损伤。
炎性反应与糖尿病密切相关[9]。“糖尿病炎症学说”认为,糖尿病患者中的胰岛素分泌缺陷和胰岛素抵抗是由组织炎症所引起的[10]。并且大部分糖尿病患者均伴有体内严重的炎性反应[11]。有研究指出控制体内炎症可缓解糖尿病的进程,并且炎性反应也会引起神经系统结构的破坏,神经组织炎性因子浸润会引起剧烈疼痛,尽管糖尿病前期神经病变不严重,但经过长期的积累会造成严重的神经组织病变,从而加重糖尿病并发症[12,13]。所以在糖尿病前期治疗过程中,神经系统炎性反应的控制也是至关重要的。本研究发现,异搏定能够显著减低糖尿病小鼠血清中的炎性因子以及坐骨神经组织中炎性因子的表达,说明异搏定能够通过抑制炎性反应来控制糖尿病以及糖尿病前期神经病变。
神经细胞凋亡是糖尿病前期神经病变的主要病理特征之一,神经细胞凋亡是引起神经系统病变的主要因素[14]。细胞凋亡受多种基因共同调控,在糖尿病发病过程中,各器官组织均高表达TXNIP[15]。并有研究表明,高血糖和高游离脂肪酸均能够引起TXNIP的高表达。TXNIP在病理刺激下会与NLRP3炎性小体结合促进IL-1β分泌增多,加重炎性反应,进而导致细胞凋亡增加[16,17]。本研究发现,糖尿病前期神经病变小鼠坐骨神经组织中TXNIP和NLRP3表达量显著上调,并且坐骨神经组织中细胞凋亡率显著上升,说明糖尿病前期神经病变与神经组织炎症和细胞凋亡密切相关,而异搏定给药后小鼠坐骨神经组织中TXNIP和NLRP3表达量显著下调,且凋亡率显著下降,说明异搏定能够通过抑制神经组织TXNIP的表达而缓解糖尿病前期神经病变。
综上所述,异搏定能够显著缓解糖尿病小鼠前期神经病变,其机制可能是通过抑制TXNIP的表达而减轻炎症和细胞凋亡。
