突变型与野生型胃肠道间质瘤基因筛选及信号通路分析
2020-06-08何毅刚于建平张亚男刘宏斌陈为凯
何毅刚 石 鑫 于建平 王 婧 张亚男 刘宏斌 陈为凯
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是胃肠道最常见的间质肿瘤之一,约占所有软组织肉瘤的20%[1]。GIST起源于Cajal的间质细胞并可发生在胃肠道的任何部位,最常见的是胃约占GIST的50%~60%,其次是小肠约30%~35%、结肠和直肠约5%,最后是食管约<1%[2]。近年来,随着KIT和PDGFRA基因被证实为GIST的可靠分子标志物,确诊为GIST的患者数量逐年增加。研究表明,约85%~90%的GIST存在KIT或PDGFRA突变即突变型GIST(MUT-GIST),余下为未发生KIT/PDGFRA突变的GIST即为野生型GIST(WT-GIST)[3]。目前,伊马替尼作为小分子选择性酪氨酸激酶抑制剂,已被广泛应用于GIST的综合治疗中。诸多研究表明,伊马替尼治疗GIST的疗效取决于KIT/PDGFRA的基因突变,而对WT-GIST患者疗效不佳,且关于WT-GIST患者遗传改变的相关研究鲜有报道[4]。本研究通过对3个基因表达矩阵进行联合生物信息学分析,将WT-GIST与MUT-GIST样本进行对比,旨在探索调控WT-GIST发生、发展的关键基因,寻找诊断、治疗WT-GIST的潜在分子标志物及靶点,为WT-GIST的诊断及治疗提供新依据。
材料与方法
1.材料:基因表达数据来源于GSE17743、GSE20708和GSE132542 3个基因芯片,下载于美国国家生物技术中心(National Center for Biotechnology Information,NCBI)的基因表达综合数据库(Gene Expression Omnibus Database,GEO),且均基于GPL570平台(Affymetrix Human Genome U133 Plus 2.0 Array; Thermo Fisher Scientific, Inc., Waltham, MA, USA)。其中GSE132542数据集包含29个GIST样本,均为KIT基因突变样本,由Amirnasr等[5]于2019年提交;GSE17743数据集包含29样本,其中15个KIT基因突变样本,11个PDGFRA基因突变样本,3个WT-GIST样本,由Ostrowski等[6]于2009年提交;GSE20708数据集包含22个GIST样本,其中13个KIT基因突变样本,5个PDGFRA基因突变样本,4个WT-GIST样本,由Astolfi等[7]于2010年提交。本研究将3个基因表达矩阵合并后共得到80个样本的RNA表达数据,将MUT-GIST设为对照组共73个样本,将WT-GIST设为实验组共7个样本。
2.基因表达数据预处理:3个芯片的原始数据下载后,将所得的CLE文件转换为基因表达矩阵,并利用R软件(3.4.4版本)的Affy包中的Robust多阵列平均算法对合并矩阵进行归一化处理;应用Sva包去除批次效应;应用pamr包绘制批次矫正前后基因密度图及Q-Q plot图;应用prcomp函数对矩阵进行主成分分析并应用ggplot2包对分析结果进行可视化处理;下载源自官方网站的Affymetrix Human Genome U133 Plus 2.0 Array最新版注释文件HG-U133_Plus_2,将表达矩阵的探针名称转换为基因名称。如果一个基因被多个探针匹配,则计算该基因的平均表达值。
3.差异基因筛选:应用R软件(3.4.4版本)的limma包进行MUT-GIST和WT-GIST的DEGs筛选,并对fold change(FC)值进行log2FC计算,以校正后P<0.05和|log2FC|>1为筛选标准,得到两组间的DEGs,并利用R软件的pheatmap包绘制DEGs表达热图。
4.GO分析及KEGG富集分析:应用DAVID数据库(6.8版本,https:∥david.ncifcrf.gov/)以P<0.01为筛选标准对DEGs进行GO分析,并应用Cytoscape软件的BiNGO插件进行可视化网络的绘制。应用KOBAS数据库(3.0版本,https:∥kobas.cbi.pku.edu.cn/download.php)以P<0.01为筛选标准对DEGs进行KEGG分析[8,9]。
5.蛋白互作网络绘制及子网络筛选:应用SRING数据库(https:string-db.org)对DEGs进行PPI绘制,对可信指数(confidence scores)≥0.4的网络进行筛选,并应用Cytoscape软件进行可视化绘制(图6),利用cytoHubba插件中的MCC算法,选取前25个基因为HUBs。以默认设置(degree cutoff=2, node score cutoff=0.2, k-core=2, max. depth=100)为筛选标准,应用MCODE插件进行PPI子网络的筛选。以MCODE评分≥6且节点数≥6为筛选标准筛选子网络,并将筛选后的子网络组成基因纳入HUBs。最后,利用DAVID和KOBAS数据库对HUBs进行GO分析和KEGG分析。
结 果
1.数据预处理与差异基因的筛选:批次效应处理前后所有基因的表达量均符合正态分布。主成分分析 (PCA分析) 结果表明,数据质量可靠,可进行生物信息学分析(图1A)。根据筛选标准,与MUT-GIST组比较,WT-GIST组中共鉴定出628个DEGs,其中226个上调基因和402个下调基因,绘制DEGs的火山图(图1B)及热图(图2)。
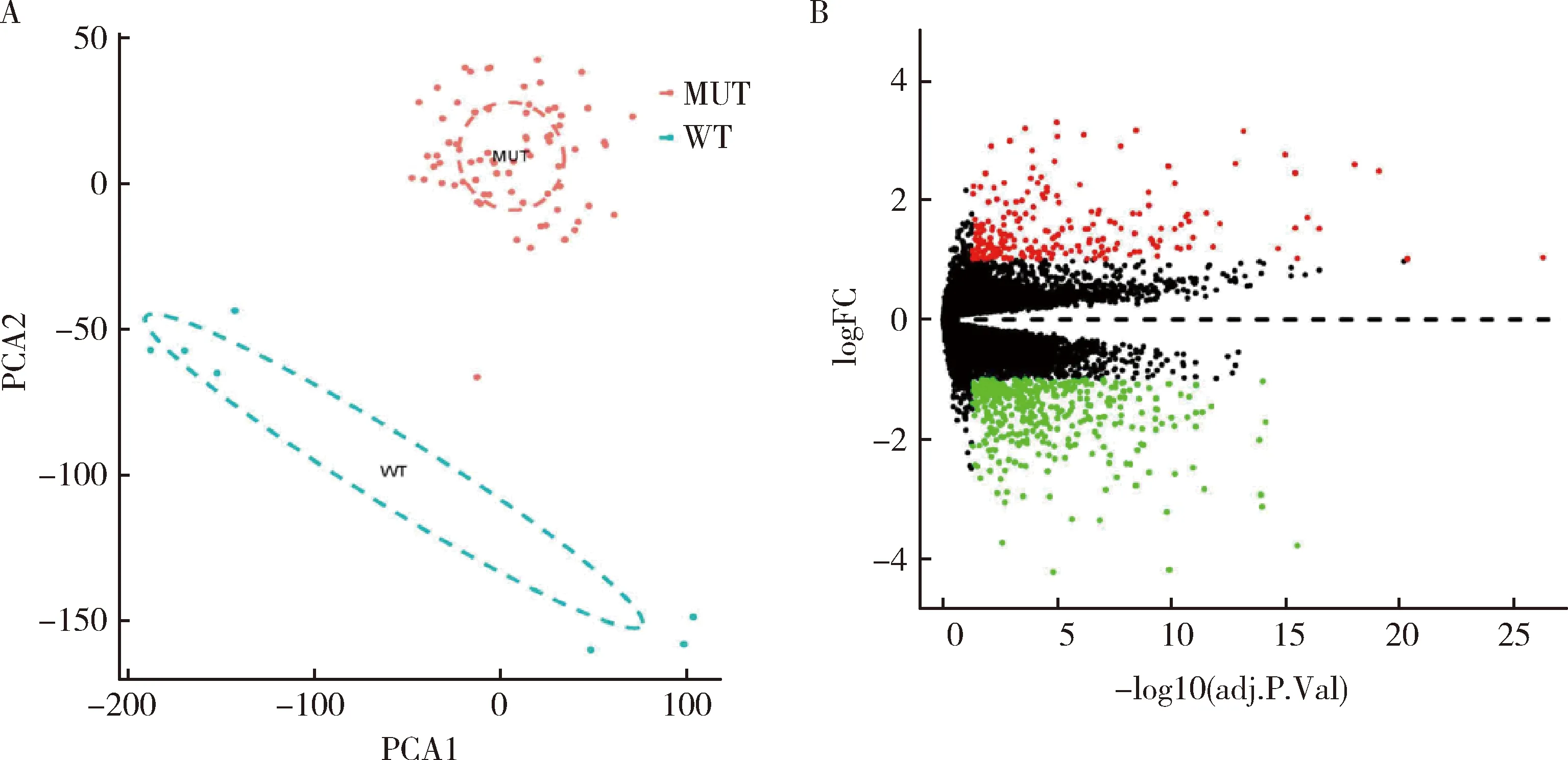
图1 主成分分析及差异基因火山图A.主成分分析是通过聚类分析表明样本之间的相似程度,不同样本在空间上距离越近,则说明样本间的差异越小。所有的样本可根据WT-GIST组和MUT-GIST组基本分开,说明两组的样本有可比性;B.MUT-GIST样本与WT-GIST样本基因分布的火山图比较,红色节点表示上调的DEGs,绿色节点表示下调的DEGs(log2FC≥1和P<0.05),黑色节点代表没有显著表达变化的基因

图2 差异基因层次聚类热图A.肿瘤中差异高表达的基因热图;B.肿瘤中差异低表达的基因热图。水平轴表示样本,垂直轴表示基因名,红色代表上调的差异基因,绿色代表下调的差异基因
2.DEGs的GO分析:对226个上调基因和402个下调基因分别进行GO分析。结果显示,差异基因主要富集于细胞黏附、质膜细胞黏附分子的异嗜性等生物过程,细胞表面、细胞外间隙、细胞外小体等细胞组成以及肝素结合、钙离子结合、整合素结合等分子功能(图3)。


图3 差异表达基因的GO分析结果A.基于3个亚分类差异基因的GO聚类分析,不同颜色代表不同类别的功能聚类,绿色代表生物进程(biological process),蓝色代表细胞组分(cellular component),紫色代表细胞功能(molecular function)(P<0.01);B.基于P值差异基因的GO聚类分析,横坐标为聚类基因数目,纵坐标为具体GO聚类注释,颜色代表P值,红色表示最小P值(P<0.01)
3.DEGs的KEGG分析:DEGs主要富集于细胞黏附分子(CAMS)、PI3K-Akt信号通路、疟疾、神经活性配体-受体相互作用、黑色素瘤、局灶性黏附、ECM-受体相互作用、肌动蛋白细胞骨架调控、cAMP信号通路、Rap1 信号通路、多巴胺能突触、胆碱能突触、癌症通路、百日咳、长期抑郁、酗酒、NF-κB 信号通路、安非他明成瘾、内分泌抵抗、RAS信号通路、催乳素信号通路、可卡因成瘾、胰岛素抵抗、醛固酮合成和分泌、磷脂酶D信号通路、调节脂肪细胞脂解、谷氨酸能突触、前列腺癌、血小板活化、催产素信号通路、AMPK 信号通路、胶质瘤、昼夜节律、色氨酸代谢、膀胱癌、孕酮介导的卵母细胞成熟、雌激素信号通路、代谢通路、逆行内源性大麻素信号转导、系统性红斑狼疮、便血、胰岛素信号转导途径、致心律失常性右心室心肌病(ARVC)、Toll样受体信号通路、乙型肝炎、凝血功能、心机细胞肾上腺素能信号转导、肌萎缩性侧索硬化(ALS)、EGFR酪氨酸激酶抑制剂抗性等信号通路(图4)。
图4 基于P值差异基因的KEGG聚类分析横坐标为聚类基因数目,纵坐标为具体KEGG聚类注释,颜色代表P值,红色表示最小P值(P<0.01)
4.蛋白互作网络绘制及HUBs筛选:本研究以可信指数≥0.4为标准,所得PPI网络由489个节点和1033条连线构成。于PPI网络中共得到25个HUBs(图5)并构建PPI网络(图6),包括KLHL41、KBTBD8、FBXO4、KLHL13、FBXO6、FBXL16、CISH、HERC5、NEDD4L、SOCS2、ADCY3、PENK、GRIA2、HIST2H2BE、CCND1、GNAI1、GRIA1、GPR37、PTH1R、HIST1H2AC、HIST1H2BK、OPRK1、HTR7、ADM、ACKR3。GO分析结果表明,HUBs主要富集于“细胞外谷氨酸门控离子通道活性”等(表1)。KEGG分析结果表明,HUBs主要富集于“PI3K-Akt信号通路”、“癌症通路”等(表2)。
讨 论
KIT/PDGFRA基因突变是GIST的主要遗传改变,且为近年来GIST分子靶向治疗的唯一有效靶点。然而即便现已依据 SDHB 基因的缺失表达衍生出诸多WT-GIST亚分类,但其尚缺乏临床指导意义,单一手术切除及重复应用既往获益靶向药物的治疗模式仍未改变[10]。IGF1R曾被证实在WT-GIST 中特异性高表达并参与调控 PI3K/Akt/mTOR 信号通路,但因其抑制剂在临床试验中并未令WT-GIST获益而失去研究价值[11,12]。目前,关于MUT-GIST与WT-GIST间遗传差异的研究鲜有报道。本研究通过生物信息学分析对MUT-GIST与WT-GIST间基因表达水平进行探索,寻找WT-GIST的潜在分子标志物及治疗靶点,从而为WT-GIST的诊断及治疗提供新依据。

图5 差异基因的蛋白质互相作用网络图红色节点代表上调基因,绿色节点代表下调基因。每个节点的大小表示每个基因链接的程度,线表示节点之间的相互作用关系

图6 关键差异基因的蛋白质相互作用网络图橙色代表关键差异基因,颜色深度代表基于MCC算法计算后的关键差异基因排序,绿色代表与关键基因具有相互作用关系的基因

表1 关键基因的GO分析结果

表2 关键基因的KEGG分析结果
本研究中共筛选出628个DEGs,其GO分析的结果显示,DEGs主要参与Wnt信号通路的调节、生长因子活性的调控、转化生长因子-β受体信号通路的调控、异型细胞-细胞黏附等重要过程,且主要分布于细胞外的区域。Wnt信号通路通过调节细胞周期、干细胞自我更新和上皮-间质转化等重要进程,在肿瘤的发生、发展中发挥着重要作用[13,14]。研究表明,Wnt信号通路的激活是GIST发生、发展之必需,Shan等[15]研究发现Wnt通路抑制剂PKF118-310、XAV939、GK007-LK在不同的GIST模型中均具有显著的抗肿瘤效果。笔者的研究共发现CCND1、SHISA2、SFRP4、CITED1、HIC1、DKK4 6个基因被富集于Wnt信号通路调节功能中(P=0.18)。Shan等研究发现,GIST细胞Wnt信号通路的激活时,CCND1的表达显著增加。DKK4作为Wnt通路拮抗剂已被广泛报道,Wang等[16]研究发现,DKK4的表达量在高危险度GIST中显著上调,同时认为DKK4的表达与GIST预后不良密切相关。但本研究发现DKK4在WT-GIST样本中显著降低,这可能与KIT/PDGFRA的突变相关,仍需进一步验证。SHISA2、SFRP4、CITED1、HIC1是否参与了WT-GIST发生、发展的调控尚未有研究报道,这些基因为WT-GIST的研究提供了新思路。DEGs的KEGG分析结果显示,在WT-GSIT的发生、发展过程中,DEGs参与了PI3K-Akt、Rap1、细胞外基质受体相互作用 (ECM-receptor interaction)、cAMP等重要信号通路的调节。研究表明,PI3K-Akt信号通路的激活与GIST伊马替尼耐药显著相关,且耐药后PI3K-Akt-mTOR通路仍发生部分激活[17]。同时,PI3K-Akt的激活还会促进GIST细胞增殖并抑制其凋亡[18]。由此看来,调控PI3K-Akt信号通路的相关基因,将可能成为WT-GIST治疗的潜在靶点。
研究还对628个DEGs进行PPI绘制,并从中获取了KLHL41、KBTBD8、FBXO4、KLHL13、FBXO6、FBXL16、CISH、HERC5等共25个HUBs。PENK是神经递质脑啡肽的编码基因,相对分子质量为34kDa,位于人类染色体8q12.1上。它主要分布于细胞基质,也存在于细胞膜、细胞核和线粒体中。PENK是一种神经递质,编码一种前体蛋白,其经蛋白水解处理后可产生多种蛋白质。PENK衍生肽作为神经递质、神经调节剂和神经激素,具有阿片类活性并参与对压力和疼痛的反应,有助于调节食欲和睡眠。此外,PENK基因还在几个非神经元组织中表达,包括内分泌腺,如肾上腺髓质、免疫系统细胞和胚胎皮肤间充质细胞。研究表明在胃肠道肿瘤中,PENK的酶产物阿片生长因子,已被证实为肿瘤抑制因子,并且OGF-OGF受体轴在胃肠道肿瘤的生长抑制过程中发挥重要作用[19]。Tang等[20]发现,与高风险度GIST比较,低风险度和中风险度GIST组的PENK显著高表达,且与GIST的肿瘤直径、有丝分裂计数显著相关。同时,PENK还与头颈部恶性肿瘤等疾病密切相关[21]。本研究发现PENK在WT-GIST样本中低表达,与GAD1、NEFL、ADCY3、ACKR3、CDH2、OPRK1、GPR37、ADM、GNI1存在相互作用,共同参与调控WT-GIST的发生、发展。
FBXO4属于F-box蛋白的FBXO亚家族,主要介导靶蛋白泛素化及蛋白酶体降解。FBOX4以两种不同的方式识别两种底物cyclin D1和Pin2。FBOX4介导cyclin D1的泛素化依赖于Thr-286残基的磷酸化及与一种小的热休克蛋白AB-晶状体蛋白的相互作用,而Pin2的泛素化不需要磷酸化。FBOX4活性受到抑制后会导致细胞核cyclin D1的累积并发生致癌转化,这可能是cyclin D1在人类恶性肿瘤疾病中过表达的重要原因[22]。在肝细胞癌中,FBXO4的表达水平显著低于非肿瘤组织,在Sk-Hep1和NIH3T3两株肝癌细胞系中,Fbx4β、Fbx4γ、Fbx4δ 3个FBXO4的剪接变异体均在肝癌组织高表达并可促进肝癌细胞增殖和迁移,破坏cyclin D1的降解[23]。本研究中,FBXO4在WT-GIST低表达,与NEDD4L、KBTBD8、FBXL16、FBXO6、CCND1、HERC5、KLHL13、KLHL41存在相互作用关系,其在GIST相关领域尚未有研究报道,或可作为WT-GIST相关研究新的方向。
ACKR3为非典型趋化因子受体-3编码基因,非典型趋化因子受体属于A类G蛋白偶联受体。CXCL12和CXCL11可与之相结合。自ACKR3蛋白作为HIV侵入的辅助受体被首次报道以来,诸多研究发现其可在许多病理生理进程中发挥重要作用。研究表明,ACKR3在炎症、感染、缺血相关的各种疾病中显著上调,重要的是,在许多恶性肿瘤如前列腺癌、肾癌、肝癌、子宫颈癌、脑癌、肺癌和乳腺癌中也检测到了ACKR3的差异表达并参与调控疾病的发生、发展[24]。Gao等[25]研究发现,ACKR3的高表达可促性肺癌细胞增殖、侵袭、迁移从而促进肿瘤生长和转移。Behnam等[26]研究发现ACKR3的过表达与肺癌患者的不良预后和生存期显著相关。Li等[27]研究发现,通过LPS-TLR4-MD-2信号通路可上调胃癌细胞中ACKR3的表达,从而提高了胃癌细胞的增殖和迁移能力。胃癌组织中TLR4、MD-2和CXCR7的表达显著高于癌旁组织。并发现TLR4、MD-2和CXCR7的表达水平与胃癌TNM分期和淋巴结转移密切相关。本研究同样发现在WT-GIST样本中,ACKR3存在显著差异表达,并可与GNAI1、PENK、GPR37、ADCY1、OPRK1相互作用,参与WT-GIST的调控。可见ACKR3的高表达可能在消化道肿瘤中同样发挥着重要作用。目前尚未有研究报道ACKR3与WT-GIST的关系,该基因可能成为未来WT-GIST的潜在诊断或治疗靶点。
综上所述,通过生物信息学分析,笔者发现与MUT-GIST样本比较,在WT-GIST样本中筛选出了628个DEGs,这些DEGs可能与GIST的发生、发展密切相关。此外,本研究还筛选出了25个HUBs,其中包括PENK、FBXO4及ACKR3等,并对其进行了GO分析和KEGG分析。本研究存在一定局限性,所利用的3个基因芯片均未提供正常胃肠道组织基因表达数据,无法识别GIST组织与正常组织间的差异基因,且研究结果需通过细胞及动物实验进一步验证。以上结果可为未来GIST相关实验研究提供实验依据和方向,从而为GIST的临床诊断和治疗提供新策略。
