miR-222-3p靶向SOCS5促进宫颈癌细胞增殖、迁移和侵袭
2020-06-08薄晓莉哈丽亚哈力木别克张清华付晓雯王建军
薄晓莉 哈丽亚·哈力木别克 潘 静 张清华 付晓雯 王建军
宫颈癌是女性常见的恶性肿瘤,其发生率和病死率常年居高不下[1,2]。尽管早期宫颈癌的筛查和治疗有助于挽救60%~90%患者的生命,但多数患者仍在晚期发现,导致其预后较差[3]。因此,阐明宫颈癌发生、发展的分子机制,有助于制定更好的治疗策略。
微小RNA(microRNAs, miRNAs)是一类存在于生物体的非编码RNA分子,其长度约21~25个核苷酸[4]。miRNAs通过结合mRNAs的3′端非翻译区,调节蛋白表达,进而在多种生理和病理过程中发挥作用[5]。近期的一项研究显示,miR-222在宫颈癌中显著高表达[6]。miR-222是一种前体微小RNA,其成熟体miR-222-3p是在miR-222的3′端臂加工而来。然而,miR-222-3p在宫颈癌中的作用尚未见报道。本研究旨在明确miR-222-3p在宫颈癌细胞恶性生物学行为中的具体作用。
材料与方法
1.研究对象:5例宫颈癌患者来自于笔者医院妇产科,5例健康人来自笔者医院体检中心,其年龄、体重等指标均相匹配。受试对象均被告知本研究的目的,并签署知情同意书。涉及的操作遵照笔者医院医学伦理学委员会的相关规定。
2.细胞系:正常宫颈上皮永生化细胞系End1/E6E7、宫颈癌细胞系SiHa、人胚肾细胞HEK-293T均购自美国ATCC公司,保存于实验室。
3.试剂与仪器:胎牛血清FBS、DMEM培养基和高糖DMEM培养基(美国Gibco公司),miRNeasy Serum/Plasma试剂盒和miRNeasy Mini试剂盒(德国Qiagen公司),SYBR Premix Ex Taq Ⅱ试剂盒(日本TaKaRa公司),引物、miR-222-3p mimics、SOCS5过表达质粒、载有野生型SOCS5和突变型SOCS5的载体pGL3(中国生工公司),Lipofectamine 3000(美国Invitrogen公司),CCK-8试剂盒、RIPA裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒、小鼠抗GAPDH单克隆抗体和辣根过氧化物酶耦合二抗(中国碧云天公司),Transwell小室(美国BD Biosciences公司),PVDF膜(美国Millipore公司),兔抗SOCS5多克隆抗体(美国Abcam公司),荧光素酶报告基因检测试剂盒(美国Promega公司),倒置显微镜(日本奥林巴斯公司),实时定量PCR仪、电泳仪、转膜仪、化学发光仪和酶标仪(美国Bio-Rad公司)。
4.细胞培养:End1/E6E7细胞和SiHa细胞培养于含有10%胎牛血清的高糖DMEM培养基,HEK-293T细胞培养于10%胎牛血清的DMEM培养基,隔天换液,在5% CO2、37℃条件下进行培养,当细胞密度达到80%时进行传代。
5.实时荧光定量PCR:血清微小RNA的提取用miRNeasy Serum/Plasma试剂盒,细胞微小RNA用miRNeasy Mini试剂盒提取,经反转录后获得cDNA后,用SYBR Premix Ex Taq Ⅱ试剂盒进行实时荧光定量,程序设定为95℃10min,然后40个循环为95℃ 30s,55℃ 30s,72℃ 30s。U6作为微小RNA内参,采用2-ΔΔCT方法计算相对表达。Hsa-miR-222-3p:正向引物5′-GGGGAGCTACATCTGGCT-3′,反向引物5′-TGCGTGTCGTGGAGTC-3′。U6:正向引物5′-AGGGGCCATCCACAGTCTTC-3′,反向引物5′-AACGCTTCACGAATTTGCGT-3′。
6.细胞活力测定:SiHa细胞接种于96孔板,每孔细胞数约6000个,将miR-222-3p mimics(1μl)、Notch1过表达质粒(1.2μl),利用Lipofectamine 3000转染至SiHa细胞培养48h,然后更换培养基,每孔100μl培养基加入10μl CCK-8反应液,培养2h后于酶标仪测定,波长设定450nm。
7.细胞划痕实验:将转染了miR-222-3p mimics、pcDNA3.1-SOCS5的SiHa细胞接种于6孔板,每孔细胞数约为密度约为2×105个,过夜培养后,用移液管尖端进行划痕,用无菌PBS轻轻洗去划下的细胞,加入无血清培养基常规培养,24h后进行拍照。
8.Transwell实验:将转染了miR-222-3p mimics、pcDNA3.1-SOCS5的SiHa细胞在无血清的培养基重悬,Transwell小室的上室接种约2×105个细胞,Transwell小室的下室倒入含血清的培养基。在细胞孵箱培养24h后,用甲醇固定下室细胞,并用0.5%结晶紫染色20min,然后在倒置显微镜下观察、拍照并计数。
9.荧光素酶报告基因实验:荧光素酶报告基因实验在HEK-293T细胞中进行。HEK-293T细胞接种于96孔板,约6000个/孔,将载有野生型SOCS5的pGL3(1μl)与miR-222-3p mimics(1μl)、载有突变型SOCS5的pGL3(1μl)与miR-222-3p mimics(1μl)、载有野生型SOCS5的pGL3(1μl)与mimics NC(1μl)、载有突变型SOCS5的pGL3(1μl)与mimics NC(1μl)分别利用Lipofectamine 3000共转染至HEK-293T细胞内,48h后用Bio-GloTMLuciferase Assay System检测,分析数值。
10.蛋白免疫印迹:收集SiHa细胞,用RIPA裂解,BCA法蛋白浓度定量;蛋白样品用SDS-PAGE凝胶分离,然后转至PVDF膜;PVDF膜用5%脱脂奶粉封闭2h;抗SOCS5和GAPDH一抗在4℃过夜孵育;TBST洗膜后,用辣根过氧化物酶耦合的二抗在室温孵育PVDF膜2h;ChemDocTMXRS+ System仪器检测目的条带,并用Image Lab软件进行灰度分析。

结 果
1.miR-222-3p在宫颈癌上调表达:分别取健康人血清和宫颈癌患者血清,检测miR-222-3p的表达水平,qRT-PCR的结果显示,患者血清的miR-222-3p显著增多(图1A,P=0.008)。此外,宫颈癌细胞系SiHa的miR-222-3p表达水平也显著高于正常宫颈上皮永生化细胞系End1/E6E7(P<0.01,图1B)。
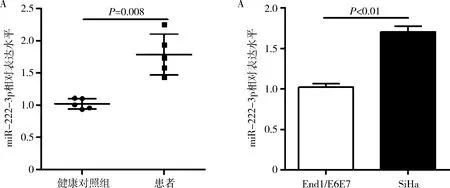
图1 miR-222-3p在宫颈癌上调表达A.miR-222-3p在宫颈癌患者血清和健康对照组血清中的表达;B.miR-222-3p在正常宫颈上皮永生化细胞系End1/E6E7和宫颈癌细胞系SiHa中的表达
2.miR-222-3p促进宫颈癌细胞恶性表型:将miR-222-3p mimics转染至SiHa细胞,其增殖能力高于转染mimics NC的SiHa细胞(图2A)。进一步检测miR-222-3p mimics对SiHa细胞迁移能力的影响,细胞划痕实验的结果表明,miR-222-3p mimics促进SiHa细胞的迁移能力(图2B)。通过Transwell实验证实,miR-222-3p mimics增加SiHa细胞向Transwell下室侵袭的能力(图2C)。
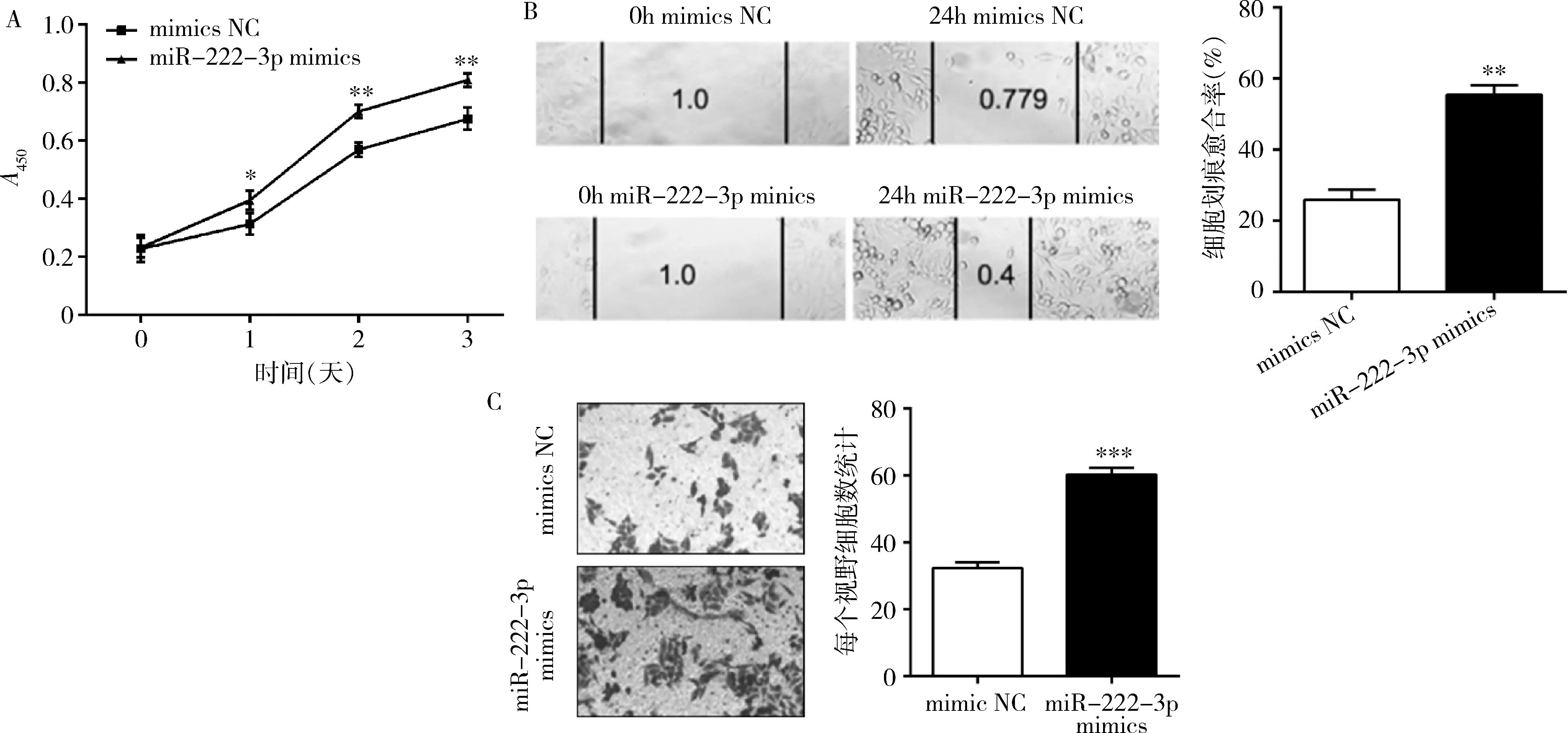
图2 miR-222-3p促进SiHa细胞恶性生物学行为A.SiHa细胞转染miR-222-3p mimics和mimics NC后的细胞活力变化;B.细胞划痕实验验证miR-222-3p mimics对SiHa细胞迁移能力的影响;C.Transwell实验检测miR-31-5p mimics对SiHa细胞侵袭能力的影响;与mimics NC比较,*P<0.05,**P<0.01,***P=0.000
3.SOCS5是miR-222-3p的直接靶点:通过TargetScanHuman7.2(http://www.targetscan.org/vert_72/)预测发现,SOCS5是miR-222-3p的潜在靶点,而且其结合位点在脊椎动物中高度保守。荧光素酶报告基因实验证实,共转染野生型SOCS5和miR-222-3p mimics的荧光素酶活性显著减低(图3A),表明SOCS5是miR-222-3p的直接靶点。蛋白免疫印迹实验表明,转染了miR-31-5p mimics的SiHa细胞的SOCS5蛋白水平显著下调(图3B)。为了证实SOCS5在miR-222-3p下游发挥作用,笔者进行如下实验。将SOCS5过表达质粒转染至SiHa细胞,SOCS5的蛋白表达水平显著升高(图3C)。CCK-8实验结果显示,共转染miR-222-3p mimics和SOCS5过表达质粒的SiHa细胞活力明显低于共转染miR-222-3p mimics和空质粒的SiHa细胞活力(图3C)。与之相一致的是,共转染miR-222-3p mimics和SOCS5过表达质粒的SiHa细胞的迁移能力和侵袭能力均低于共转染miR-222-3p mimics和空质粒的SiHa细胞(图3D和图3E)。
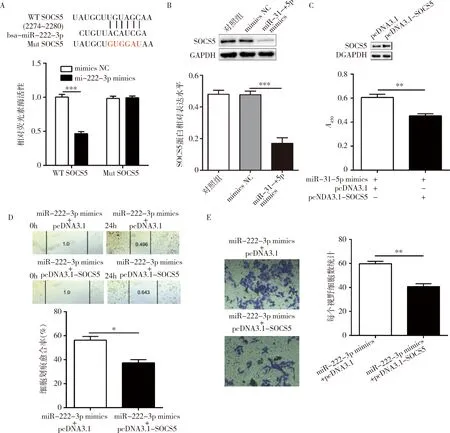
图3 SOCS5在miR-222-3p下游调节SiHa细胞的生物学行为A.荧光素酶报告基因实验验证SOCS5是miR-222-3p直接靶点;B.转染miR-222-3p mimics后SiHa细胞SOCS5的蛋白表达及灰度分析;C.共转染miR-222-3p mimics和SOCS5过表达质粒对SiHa细胞活力的影响;D.共转染miR-222-3p mimics和SOCS5过表达质粒对SiHa细胞迁移能力的影响;E.共转染miR-222-3p mimics和SOCS5过表达质粒对SiHa细胞侵袭能力的影响;*P<0.05,**P<0.01,***P=0.000
讨 论
在全球范围内宫颈癌在女性恶性肿瘤中的发生率和病死率均排在第4位,在妇科相关恶性肿瘤中的发生率和病死率排在第2位,仅次于乳腺癌[1]。目前,早期筛查和疫苗的使用是预防宫颈癌发生和进展的重要手段[7,8]。尽管化疗和手术对部分宫颈癌患者有效,但严重的不良反应和并发症影响患者的生活质量和预后[9,10]。因此,阐明宫颈癌的发生、发展分子机制,有助于为患者提供更好的治疗策略。
属于非编码RNA分子的miRNAs尽管不具备编码蛋白的功能,却可以通过调控mRNAs特定区域而影响蛋白表达,从而在细胞的多种生物学行为中发挥重要作用[11]。越来越多的研究表明,miRNAs介导的蛋白表达异常是宫颈癌发病机制的重要环节。Lü等[12]研究发现,miR-664在宫颈癌患者显著低表达,过表达miR-664可以抑制c-Kit表达,进而诱导宫颈癌细胞凋亡增加。一项临床研究显示,miR-361-3p在宫颈癌样本中低表达,而且与患者不良预后显著相关[13]。除了下调表达,有些miRNAs在宫颈癌呈现显著高表达。Chen等[14]通过检测临床样本发现,miR-1246在宫颈癌患者显著上调,而且提示淋巴结转移的发生。进一步的细胞学研究表明,通过慢病毒介导的miR-1246下调可导致血小板反应蛋白-2的表达升高,从而促进宫颈癌细胞凋亡增加并抑制其增殖;小鼠荷瘤实验也证实miR-1246的下调有助于抑制瘤体增长[15]。这些研究提示,miRNAs的差异表达在宫颈癌中发挥截然不同的作用。本研究表明,miR-222-3p在宫颈癌高表达,并促进宫颈癌细胞增殖、迁移和侵袭。此外,笔者发现SOCS5在miR-222-3p的下游发挥作用。
SOCS5是细胞因子信号转导抑制子SOCS家族成员之一,通过调节JAK-STAT信号通路在肿瘤细胞凋亡和增殖中发挥关键作用[16]。Zhang等[17]研究发现,抑制SOCS5可促进JAK-STAT3信号通路活化,从而增加胰腺癌的侵袭和转移。在急性T淋巴细胞性白血病中,沉默SOCS5的表达诱导JAK-STAT信号通路激活,促进疾病进展[18]。然而,SOCS家族成员在宫颈癌发病机制中的研究较少。国外的一项研究显示,SOCS1在宫颈癌组织中低表达或无表达[19]。与此结果相一致,Kim等[20]研究发现,SOCS1、SOCS3和SOCS5在宫颈癌组织和细胞系均呈现表达减少。但SOCS5在宫颈癌中的功能学研究尚未见报道。笔者发现,过表达SOCS5可抑制miR-222-3p对宫颈癌细胞的促增殖、促迁移和促侵袭作用。
综上所述,本研究通过体外实验证实miR-222-3p具有促进宫颈癌细胞增殖、迁移和侵袭的作用,而且其作用与抑制SOCS5表达有关。因此,这些结果初步提示miR-222-3p在宫颈癌的进展中发挥重要作用,为进一步明确其发病机制提供理论依据。
