BTN3A3低表达促进肝细胞癌的恶性进展
2020-06-08张梦梦苏晓东田毅夫季佳宇刘福生
张梦梦 苏晓东 田毅夫 季佳宇 刘福生
2018年,世界范围内肝癌的发生率在所有肿瘤类型中居第6位,病死率排名第4位,严重威胁人类健康。仅2018年,全球共有841000例新发肝癌患者,同时782000例患者死亡[1]。原发性肝癌包括肝细胞癌(hepatocellular carcinoma, HCC)和胆管癌(intrahepatic cholangiocarcinoma),以及其他发生率低的类型。其中肝细胞癌的发生率约占原发性肝癌(liver cancers)的80%[2]。
在疾病早期确诊的HCC患者可以进行手术切除术或局部消融治疗,然而,高级别的HCC患者通常只能进行疗效有限的、以减轻症状为目的的保守治疗。目前,已被批准用于高级别HCC系统治疗的临床药物,仅有多重激酶抑制剂索拉菲尼(sorafenib),临床试验数据表明,索拉菲尼可延长高级别HCC患者中位生存期约3个月,同时化疗不良反应强[3]。因此,找寻新的分子靶点是HCC临床研究的重要工作。
嗜乳脂蛋白家族成员含有1~2个细胞外Ig结构域,由于其蛋白质结构与B7家族共受体蛋白质具有部分相似性,因此被称为B7相关蛋白质[4~6]。BTN3A亚家族包含3个成员,BTN3A1、BTN3A2和BTN3A3,该亚家族成员被证实在多种肿瘤细胞中表达[7, 8]。近期报道,BTN3A3及BTN3A2中特定的单核苷酸多态性分别增加卵巢癌及胃癌的发生概率[9, 10]。BTN3A3的表达情况可预测胃癌患者对氟尿嘧啶(fluorouracil)化疗药物的敏感度[11]。乳腺癌肿瘤微环境中,位于肿瘤相关巨噬细胞膜表面的LSECtin通过与乳腺肿瘤干细胞表面的BTN3A3受体结合,促进肿瘤细胞的干性[12]。对于BTN3A家族蛋白,其在肝癌中的作用目前未见报道。
本研究通过对TCGA数据库的统计分析,发现Ⅳ期肝癌患者中BTN3A3基因的表达量降低,同时,低表达BTN3A3基因的肝癌患者整体生存期显著缩短。这提示,BTN3A3可能对肝癌的转移产生影响。肝癌细胞系体外迁移实验表明,降低BTN3A3表达后促进肝癌细胞系的迁移,侵袭实验表明,降低BTN3A3表达后促进肝癌细胞系的侵袭,说明BTN3A3调控肝癌细胞系的扩散转移能力。降低BTN3A3表达后肝癌细胞系克隆形成能力增强,说明BTN3A3调控单个肝癌细胞在新的位点增殖的能力。本研究初步明确了减少BTN3A3的表达能够促进肝细胞癌的恶性进展,有助于增加对BTN3A亚家族蛋白质功能的了解,为发展新的高级别肝细胞癌的分子治疗靶点提供线索。
材料与方法
1.细胞培养及试剂:HLE细胞系购自ATCC,HepG2细胞系购自协和细胞资源中心。HLE及HepG2细胞系采用DMEM培养基(美国Gibco公司, C11995500BT)培养,补充10%胎牛血清(杭州四季青公司, 11011-8611)和1%双抗(美国Gibco公司, 15140-122)。
2.抗体:BTN3A3抗体购自Proteintech公司(15896-1-AP),β-actin抗体购自美国Sigma公司(A5441)。
3.SiRNA转染:SiRNA(1#-GCUCGUGGAGAG-AAGUCUUTT,2#-GCCUGACUGAUGGGAAUAATT)由苏州吉玛公司合成,用以敲减肝癌细胞系中BTN3A3的表达。采用Lipo3000细胞转染试剂盒(美国Life technology公司, L3000-015)进行转染操作。细胞转染48h后,进行后续相应实验操作。
4.细胞迁移分析:于200μl无血清DMEM培养基中,加入1×105个细胞;将细胞悬液置于细胞培养小室(美国Millipore公司, MCEP24H48)的上室中;下室加入800μl含有10%胎牛血清的完全DMEM培养基。细胞培养24h后,获取细胞培养小室进行结晶紫染色(中国Beyotime公司, C0121)并拍照。该实验重复3次。
5.细胞侵袭分析:细胞培养小室采用Matrigel (美国BD公司, 356234)预包被,置于37℃孵箱中3h形成Matrigel包被层。于200μl无血清DMEM培养基中,加入2×105个细胞;将细胞悬液置于细胞培养小室的上室中;下室加入800μl含有20%胎牛血清的完全DMEM培养基。细胞培养24h后,获取细胞培养小室进行结晶紫染色并拍照。该实验重复3次。
6.细胞克隆形成分析:包含1×103个细胞的2ml细胞悬液接种于6孔板的孔中,培养2周后,进行结晶紫染色并统计克隆数。每个实验组设置3个复孔,该实验重复3次。

结 果
1.BTN3A3基因的表达量:采用TCGA数据库中肝癌患者的数据,分析了BTN3A3基因在不同分期患者中的表达情况。Ⅳ期肝癌患者中BTN3A3基因表达量显著下降(图1),其中Ⅱ期患者的表达量显著高于Ⅳ期患者(P<0.01),Ⅲ期患者的表达量显著高于Ⅳ期患者(P<0.05)。Ⅰ期肝癌患者中BTN3A3表达量同Ⅱ期、Ⅲ期、Ⅳ期患者之间比较,差异均无统计学意义,Ⅱ期肝癌患者中BTN3A3表达量同Ⅲ期患者之间比较,差异无统计学意义。

图1 Ⅳ期肝细胞癌患者肿瘤组织中BTN3A3表达量显著下降*P<0.05,**P<0.01
2.低表达BTN3A3基因的肝癌患者整体生存期:采用TCGA数据库中肝癌患者的数据,分析了BTN3A3基因的表达量与患者整体生存期之间的关系。获取364例肝癌患者的生存期数据,并根据BTN3A3基因表达量的高低分为两组,高表达组182例患者,低表达组182例患者,进行整体生存期的统计分析(图2)。低表达BTN3A3基因的患者整体生存期显著缩短(P<0.05)。

图2 低表达BTN3A3的肝癌患者整体生存期显著缩短
3.采用SiRNA成功敲减肝癌细胞系HLE及HepG2中BTN3A3的表达:采用SiRNA:1#-GCUCGUGGAGAGAAGUCUUTT,2#-GCCUGACUGAU-GGGAAUAATT,转染肝癌细胞系HLE及HepG2。收集转染后的细胞,提取总蛋白质进行Western blot法分析(图3)。两株细胞系中的BTN3A3表达量在两个靶点的作用下均显著下降。
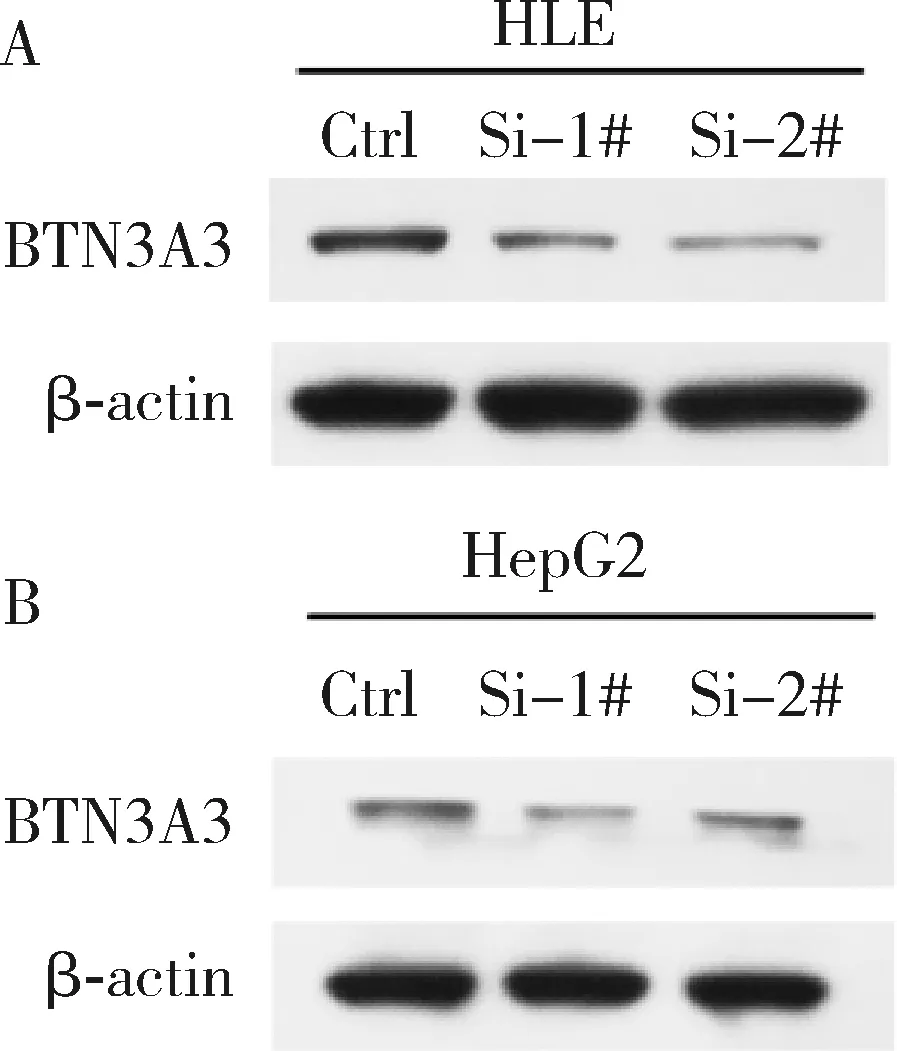
图3 在HLE、HepG2细胞系中成功敲减BTN3A3的表达A.HLE细胞系转染SiRNA后进行Western blot法结果图; B.HepG2细胞系转染SiRNA后进行Western blot法结果图
4.降低BTN3A3表达后促进肝癌细胞系的迁移:采用BTN3A3-SiRNA转染HLE及HepG2肝癌细胞系,转染48h后进行细胞迁移实验。降低BTN3A3表达后,两株肝癌细胞系的迁移能力均显著增强(图4)。
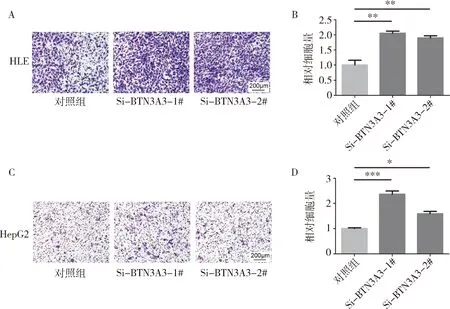
图4 HLE、HepG2细胞系中降低BTN3A3表达后细胞的迁移能力显著增强A.HLE细胞系迁移实验结果图(结晶紫,×50); B.HLE细胞系迁移实验统计结果; C.HepG2细胞系迁移实验结果图(结晶紫,×50); D.HepG2细胞系迁移实验统计结果;*P<0.05, **P<0.01,***P=0.000
5.降低BTN3A3表达后促进肝癌细胞系的侵袭:采用BTN3A3-SiRNA转染HLE及HepG2肝癌细胞系,转染48h后进行细胞迁移实验。降低BTN3A3表达后,两株肝癌细胞系的侵袭能力均显著增强(图5)。

图5 HLE、HepG2细胞系中降低BTN3A3表达后细胞的侵袭能力显著增强A.HLE细胞系侵袭实验结果图(结晶紫,×50); B.HLE细胞系侵袭实验统计结果; C.HepG2细胞系侵袭实验结果图(结晶紫,×50); D.HepG2细胞系侵袭实验统计结果;*P<0.01,**P=0.000
6.降低BTN3A3表达后肝癌细胞系克隆形成能力:采用BTN3A3-SiRNA转染HLE及HepG2肝癌细胞系,转染48h后进行细胞克隆形成实验。降低BTN3A3表达后,两株肝癌细胞系的克隆形成数目显著增加(图6)。

图6 HLE、HepG2细胞系中降低BTN3A3表达后细胞的克隆形成能力显著增强A.HLE细胞系克隆形成实验结果图(结晶紫); B. HLE细胞系克隆形成实验统计结果; C.HepG2细胞系克隆形成实验结果图(结晶紫); D.HepG2细胞系克隆形成实验统计结果;*P<0.05,**P=0.000
讨 论
转移导致了90%癌症患者的死亡[13]。通过切除术或经导管动脉化疗栓塞术,可成功治疗肝细胞癌患者的原发肿瘤,然而由于局部侵袭及肝内转移,患者复发概率高。明确肝细胞癌侵袭、转移的调控机制,有利于发展有效的针对高级别肝细胞癌的治疗靶点。本研究通过对TCGA数据库中肝癌患者的临床数据进行分析,明确了Ⅳ期患者中BTN3A3基因表达量显著降低;同时低表达BTN3A3的患者,生存期显著缩短。设计并获得敲减BTN3A3表达的SiRNA序列,并在肝癌细胞系HLE及HepG2中验证有效。进而证实在两株肝癌细胞系中,敲减BTN3A3的表达后,细胞迁移、侵袭能力显著增强,同时克隆形成能力显著增强。初步证实了BTN3A3在肝癌恶性进展中的抑制作用。
根据AJCC对于肝癌的分期定义,Ⅳ期患者发生区域淋巴结转移或者远处转移。在该分期的患者中,BTN3A3基因的表达量显著降低。由此推断,BTN3A3可能存在抑制肝癌转移的功能,低表达该基因的患者,对肿瘤侵袭的抑制作用降低,易发生淋巴结转移和远处转移。本研究所获取的ATCC数据库中的患者数据,Ⅳ期患者为6例,数目较少,因此还有待增加病例数后进一步验证。
针对364例肝癌患者的生存期数据进行比较分析,发现低表达BTN3A3基因的患者整体生存期显著缩短。这说明低表达该基因,不利于肝癌患者的疾病控制,BTN3A3具有在肝癌恶性进展中的抑制作用。同时,肝癌患者生存期分析的结果,也支持前述Ⅳ期肝癌患者中BTN3A3基因表达量显著下降的结论。
在转移发生过程中,一个位于原发肿瘤灶的癌细胞有序地发生下列变化,原位侵入周围组织,进入淋巴系统及血液系统的微管,存活,通过血液系统到达远处组织的微血管中,穿出血管,在远处组织微环境中存活,适应新的环境,增殖并形成新的转移灶[14]。采用Transwell细胞培养小室验证敲减BTN3A3后肝癌细胞系的迁移及侵袭能力,结果显示,敲减BTN3A3表达后,细胞的迁移及侵袭能力显著增强。迁移分析体现了肝癌细胞系在敲减BTN3A3表达后,在淋巴系统及血液系统中的转移能力增强,而侵袭分析体现了肝癌细胞系侵入周围组织能力增强。这都有利于肝癌细胞转移的发生。
克隆形成实验初步体现了单个肿瘤细胞在到达新的组织微环境中存活和定殖的能力。敲减BTN3A3基因表达后,肝癌细胞系的克隆形成能力显著增强,这提示该基因的表达降低有利于转移灶的发生。
当前,关于BTN3A3在肿瘤中的具体调控机制鲜有报道。在胃癌中,Pan等[11]采用生物信息及统计学方法,明确了BTN3A3对化疗药物氟尿嘧啶有效性的预测作用。在卵巢癌中,Peedicayil等[10]采用统计学方法,证实BTN3A3的SNPs与卵巢癌的发生率呈负相关。然而两项研究均未进行分子机制的研究。在乳腺癌中,位于巨噬细胞膜表面的LSECtin蛋白与位于乳腺癌细胞膜表面的BTN3A3结合,通过促进JAK2/STAT3信号通路活性,增强乳腺癌细胞的干性[12]。这一研究结果提示,在肝癌中BTN3A3可能也发挥对肿瘤细胞干性的调控作用。转移发生前期,肿瘤细胞通过表皮-间质转化(epithelial-mesenchymal transition, EMT)作用,增加自身可塑性及干性,以利于转移的进行。笔者推断,肝癌细胞中BTN3A3基因极有可能在EMT过程中发挥调控作用。在后续的深入研究BTN3A3抑制肝癌转移的分子机制中,笔者将以此为切入点。
综上所述,本研究证实BTN3A3基因在Ⅳ期肝癌患者中表达量显著下降,低表达该基因的患者整体生存期显著缩短。在细胞水平明确了敲减BTN3A3表达后,肝癌细胞系HLE及HepG2的细胞迁移、侵袭及克隆形成能力均显著增强,初步证实了BTN3A3在肝癌恶性进展中的抑制作用。这将为后续深入研究BTN3A3抑制肝癌转移的分子机制提供支持,同时为探索新的有效的针对高级别肝细胞癌的治疗靶点提供线索。
