邻苯二甲酸二丁酯降解菌对烟草青枯病的抑制作用
2020-06-06杨小琼李春黎王昌军孙敬国陈守文
杨小琼,余 君,周 文,李 程,李春黎,王昌军,孙敬国,陈守文,杨 勇*
1.湖北大学生命科学学院,武汉市武昌区友谊大道368 号 430062
2.湖北省烟草科学研究院,武汉市硚口区解放大道618 号 430000
3.四川中烟工业有限责任公司长城雪茄烟厂,四川省什邡市蓥华山路南段128 号 618400
烟草青枯病是烟叶生产中的主要病害之一[1-4]。目前对烟草青枯病的防治主要包括化学防治、生物防治和农业防治等[3,5-10],长期施用化学农药不仅导致病原菌产生抗药性等[11],而且抗病品种选育成功率低仍是农业防治中关键性难题[12-13]。生物防治方法因其安全、无公害和长效等特点已成为烟草青枯病防治的研究热点[3,14]。目前施用生物菌剂防治烟草青枯病已有较多研究报道[15-18],但烟草生产上青枯病并没有得到有效的控制[19-20]。赵文宗等[21]研究表明,2,4-二叔丁基苯酚、邻苯二甲酸二丁酯、邻苯二甲酸二异辛酯等芳香族化合物添加后会显著提高青枯病的发病率和病情指数;刘艳霞等[22]证实烟草根系分泌物中的苯甲酸、3-苯丙酸等酚酸类物质有利于青枯菌在烟株根际定殖;李石力等[23]研究发现,烟草根系分泌的有机酸通过增强青枯菌成膜基因的表达,可促进烟草青枯病的发生。可见,烟草根系分泌物中的芳香族或有机酸具有促进青枯病发生的作用。另外,烟草根系分泌的阿魏酸、肉桂酸、苯甲酸、香草酸、对羟基苯甲酸等自毒物质是烟草连作的障碍因子[24-28],而且连作土壤中阿魏酸及肉桂酸等化感自毒物质含量高于轮作土壤[29-30]。因此,化感自毒物质的积累是诱导青枯病发生的重要因素之一。
已报道邻苯二甲酸酯具有类激素作用,长期接触会对人体和其他生物的内分泌系统产生较大影响[31],而且邻苯二甲酸二丁酯为邻苯二甲酸酯的衍生物,是一类重要的化感自毒物质[21]。虽然已有报道指出芳香族化合物如苯甲酸等对青枯菌具有趋化性,但邻苯二甲酸二丁酯促进青枯病的发生机制尚不明确。为此,以邻苯二甲酸二丁酯为靶标物质,分析了邻苯二甲酸二丁酯对青枯菌的趋化诱导作用,并通过筛选高效降解菌降解土壤中的邻苯二甲酸二丁酯,旨在为烟草青枯病绿色防控提供依据。
1 材料与方法
1.1 材料、试剂和仪器
土壤样品取自于湖北大学资源与环境学院排污口、沙湖及垃圾堆,将所得土壤置于250 mL 灭菌的三角瓶中,4 ℃保存。供试烟草品种为云烟87。病原菌来源:青枯菌病原菌HF1-1 由湖北省烟草科学研究院提供。
试验所用试剂均购自国药集团有限公司。仪器:高效液相色谱仪(HPLC,美国安捷伦科技有限公司);电子分析天平ME204E(感量0.000 1 g,上海梅特勒-托勒多仪器有限公司);pH 计(梅特勒-托勒多仪器有限公司);722 型分光光度计(梅特勒-托勒多仪器有限公司);恒温培养箱LRH-70(上海索普仪器有限公司);SIMCABLE8 超纯水仪(美国Thermo 公司);HQL300B 恒温大幅度振荡摇床(武汉中科科仪技术发展有限责任公司);低温离心机(美国Scjlogex 公司)。
TTC 培养基(病原菌培养基)、基础盐培养基、LB 培养基、高氏一号培养基和孟加拉红培养基参照文献[32-33]配制。
1.2 方法
1.2.1 邻苯二甲酸二丁酯处理后青枯菌生物量和趋化效应分析
配制邻苯二甲酸二丁酯含量分别为2.0、2.5、3.0、3.5、4.0 和4.5 mg/L 的NA 液体培养基,然后接种1 mL 青枯菌液(1.0×109CFU/mL),30 ℃培养24 h 后取菌悬液稀释10 倍,在波长600 nm 下测定青枯菌的菌液浓度(CFU/mL)。
采用NA 液体培养基培养青枯菌至OD600为1.0,将菌液离心后用等体积磷酸缓冲液(100 mmol/L,pH 7.0)重悬,静置于无菌培养皿中。选用内径为1 mm 的灭菌毛细管,在管中吸入浓度为100 μmol/L 的邻苯二甲酸二丁酯溶液,并垂直浸于青枯菌培养液培养皿内,静置40 min,用注射器将毛细管内的液体移出,稀释为1×10-5后涂布于含有TTC 的NA 固体平板上,30 ℃培养18 h 后计数。每处理3 次重复,以PBS 缓冲液为对照。
1.2.2 邻苯二甲酸二丁酯降解菌筛选和培养条件优化
1.2.2.1 降解菌筛选
将收集的土壤分别取10 g,放于90 mL 灭菌去离子水中,180 r/min 振荡过夜获得菌悬液。吸取菌悬液10 mL 分别接种到邻苯二甲酸二丁酯浓度为800 mg/L 的LB 培养基、高氏一号培养基和孟加拉红培养基中培养7 d 后再吸取菌悬液100 μL 进行第二次驯化,如此循环7 次,参考文献[34]进行驯化。从终浓度的各培养基中吸取100 μL 的菌悬液涂布于含有600 mg/L 邻苯二甲酸二丁酯的固体培养基中,反复纯化多次分离,挑选形态鲜明、菌落清晰的不同单菌落。在LB 培养液中富集培养。以邻苯二甲酸二丁酯为唯一碳源,将挑选的各个菌置于基础盐培养液中,30 ℃230 r/min 培养18 h,观察菌液浊度,最终筛出可降解邻苯二甲酸二丁酯的降解菌。
1.2.2.2 邻苯二甲酸二丁酯降解效率检测
降解菌经LB 培养液富集培养,在邻苯二甲酸二丁酯终浓度为300 mg/L 的基础盐液体培养基中,接种降解菌1 mL(1.0×109CFU/mL),30 ℃230 r/min 培养48 h。利用乙酸乙酯萃取培养液中残余的邻苯二甲酸二丁酯后,离心沉淀菌体,取上清液,用0.22 μm 的滤膜过滤,收集滤液待测。
采用高效液相色谱法(HPLC)测定邻苯二甲酸二丁酯含量(质量分数)。液相条件为:流动相比例为甲醇∶水为95∶5,流速1 mL/min,波长245 nm,柱温30 ℃,进样量10 μL,色谱柱(Agilent ZORBAX SB-C18)为5 μm,4.6mm×250 mm。
1.2.2.3 菌种鉴定
参照文献[35]进行细菌生理生化指标鉴定。
分子生物学鉴定:通过DNA 提取试剂盒(上海生工生物工程股份有限公司)得到目标菌株(编号Ed2)的基因组,进行PCR扩增。反应体系:DNA模板5 μL,正反向引物各1 μL,dNTP(10 mmol/L)1 μL,10xExtaq buffer 5 μL,Extaq 1 μL,加ddH2O补足体系至50 μL。引物序列:27F:5'-AGAGTTTGATCCTGGCTCAG-3',1492R:5'-GGTTACCTTGTTACGACTT-3';扩增程序:94 ℃预变性3 min;94 ℃变性1 min,61 ℃退火1 min,72 ℃延伸1 min;30 个循环,72 ℃延伸5 min,4 ℃保存30 min。1%琼脂糖凝胶电泳检测PCR 产物的大小为1 450 bp 左右。同时由武汉擎科生物公司测序该产物大小为1 401 bp,并与GenBank中的16S rRNA序列进行比对。
1.2.2.4 培养条件优化
在LB 固体培养基平板上进行降解菌的活化,并转移到LB 液体培养基中作为种子液,检测单因素条件下Ed2 菌的生长状况。
(1)接种1 mL 青枯菌液(1.0×109CFU/mL)至LB 培养液中,在温度分别为18、30、37 和45 ℃,230 r/min 条件下培养,每隔4 h 取样,测定OD600时青枯菌液浓度,每组设置3 次重复;(2)接种1 mL青枯菌液至LB 培养液中,在pH 分别为4、5、6、7、8、9,230 r/min 条件下振荡培养,每隔4 h 取样,测OD600时青枯菌液浓度,每组设置3 次重复;(3)接种1 mL 青枯菌液至LB 培养液中,邻苯二甲酸二丁酯的初始浓度分别为100、200、300、400、500 和600 mg/L,230 r/min 条件下振荡培养,每隔4 h 取样,测定OD600值,每处理设置3 次重复。(4)青枯菌液接种量按培养液体积的0.6%、1.2%、1.8%、2.4%接种至LB 培养液中,30 ℃230 r/min 条件下振荡培养,每隔4 h 取样,测定OD600值,每处理设置3 次重复。
1.2.2.5 邻苯二甲酸二丁酯解降特性分析
在优化条件下,按照1.2.2.2 节描述的方法测定邻苯二甲酸二丁酯降解率。
1.2.3 盆栽试验
选择生长健壮一致的5 片真叶期烟苗移栽至直径12 cm、高16 cm 的盆钵中,每盆1 株,按照当地优质烟叶生产技术规范进行栽培管理。试验共设置3 个处理。对照(CK):基质土壤中添加青枯菌(1.00×1010CFU/mL);处理1(T1):青枯菌+邻苯二甲酸二丁酯;处理2(T2):青枯菌+邻苯二甲酸二丁酯+Ed2 菌。各处理中青枯菌菌悬液土壤接种量为10 mL(1.00×1010CFU/mL),邻苯二甲酸二丁酯添加量为10 mL(600 mg/L),Ed2 菌接种量为10 mL(1.00×1010CFU/mL)。
烟苗移栽15 d 后,参考文献[36]的方法,每7 d调查青枯病的发病情况并计算青枯病发病率。
发病率=(发病株数/调查总株数)×100%
每个处理烟苗10 株,重复5 次,共计150 株。参照文献[37]的方法,随机抽取烟株3株,收集根际土壤各10 g。所取土样分为两份,一份加入无菌水90 mL 振荡3 h,然后取悬浊液100 μL,涂布含TTC的NA 平板,30 ℃培养18 h 后统计青枯菌数量。另一份测定邻苯二甲酸二丁酯含量(质量分数)。
邻苯二甲酸二丁酯含量测定:利用乙酸乙酯萃取第二份收集的土壤中邻苯二甲酸二丁酯,然后利用HPLC 法测定土壤邻苯二甲酸二丁酯含量动态变化,HPLC 法测定条件参照1.2.2.2 节。
1.2.4 数据处理
采用SPSS19.0 软件和Excel 进行数据的描述统计分析。
2 结果与分析
2.1 邻苯二甲酸二丁酯对青枯病的影响
2.1.1 邻苯二甲酸二丁酯对青枯菌的生长和趋化效应分析
图1 显示,随着邻苯二甲酸二丁酯浓度增加,青枯菌的菌液浓度先增加后减少,在邻苯二甲酸二丁酯浓度为3.5 mg/L 时菌液浓度OD600为9.17±0.19(图1 a),表明低浓度的邻苯二甲酸二丁酯可以促进青枯菌生长,而高浓度则抑制青枯菌生长,与于妍华等[38]研究结果基本一致,说明邻苯二甲酸二丁酯是青枯菌生长的营养物质;在毛细管中添加邻苯二甲酸二丁酯,青枯菌的平均数量为(2.03±0.842)×107CFU/mL,明显高于对照[CK,(3.63±1.67)×106CFU/Ml)(图1 b),与李石力[23]和张克勤等[27]的试验结果基本一致,说明邻苯二甲酸二丁酯对青枯菌具有趋化诱导作用,也解释了连作条件下随着邻苯二甲酸二丁酯浓度的增高,青枯病发病率也显著升高的内在原因[28,30]。
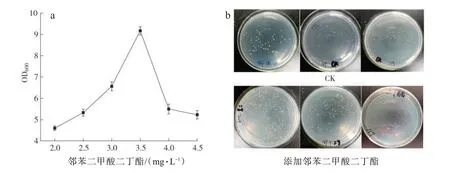
图1 邻苯二甲酸二丁酯对青枯菌的生物量影响(a)和趋化诱导(b)Fig.1 Influences of dibutyl phthalate on biomass(a)of R.solanacearum and the chemotaxis-inducing effects(b)
2.2 降解菌筛选鉴定与培养条件优化
2.2.1 菌株筛选
以邻苯二甲酸二丁酯为唯一碳源,从土壤中筛选获得邻苯二甲酸二丁酯降解菌4 株,HPLC 检测结果显示,邻苯二甲酸二丁酯液相出峰时间为3.8 min 左右,根据HPLC 峰面积百分比确定1 号菌为高效降解菌(表1),该菌株在48 h 内降解效率为89%(图2 a),该菌株编号为Ed2。
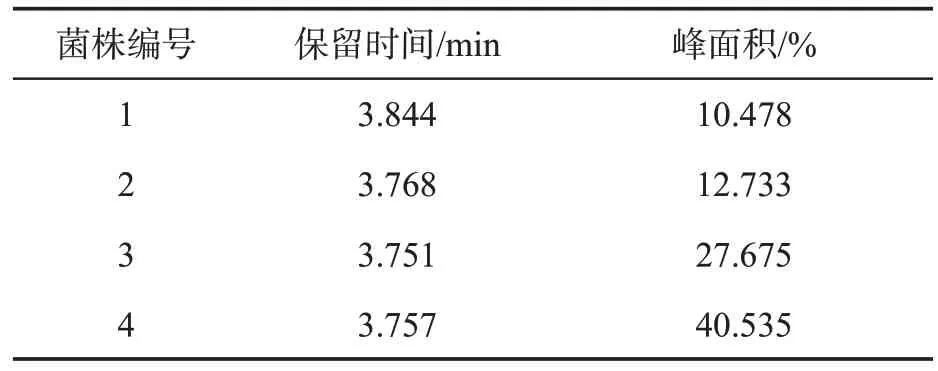
表1 邻苯二甲酸二丁酯降解效率Tab.1 Degradation rate of dibutyl phthalate
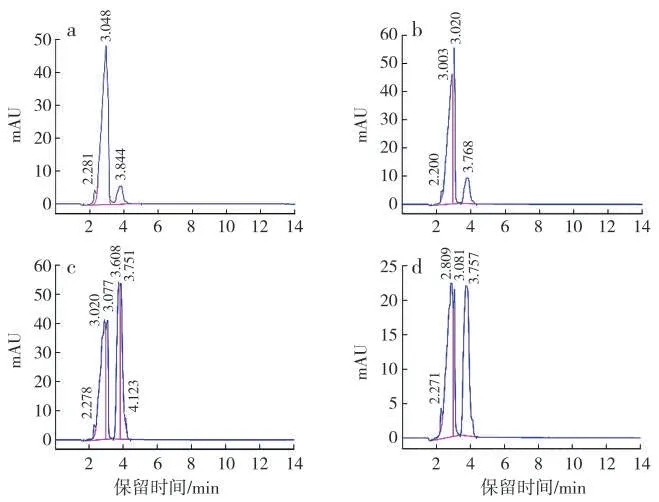
图2 邻苯二甲酸二丁酯降解率的液相色谱图Fig.2 HPLC chromatograms on degradation of dibutyl phthalate
2.2.2 菌株的生理生化鉴定
Ed2 菌在LB 培养基平板上菌落呈现乳白色,显微镜下观察呈球杆状,革兰氏染色呈阴性,能够利用葡萄糖、木糖、乳糖等,见表2。
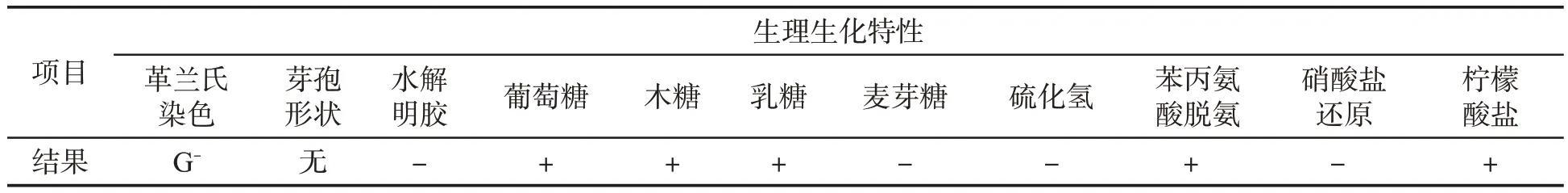
表2 菌株的生理生化特性①Tab.2 Physiological and biochemical characteristics of Ed2 strain
将菌株Ed2 的16SrRNA 基因序列提交GenBank数据库,序列登录号为MK729019.1,并构建系统发育树。分析结果显示:菌株Ed2与不动杆菌Acinetobacter nosocomialis strain RUH2376 在同一个分支上,序列相似性为80%,根据结果可以得知菌株Ed2 归于不动杆菌属(图3),并命名为Acinetobacter sp.Ed2。
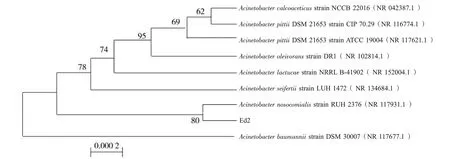
图3 Ed2 菌的系统发育树Fig.3 Phylogenetic analysis of Acinetobacter sp.Ed2
2.2.3 培养条件的优化
经过培养及条件优化,邻苯二甲酸二丁酯的初始浓度为300 mg/L 时,Acinetobacter sp.Ed2 生长状况最好(图4 a);其能耐受的pH 范围为5.0~9.0。当培养基pH 为7.0 时,Acinetobacter sp.Ed2 生长状况最好(图4 b);在30 ℃条件下培养生长状况最好(图4 c);在接种量为2.4%时生长状况最好(图4 d)。
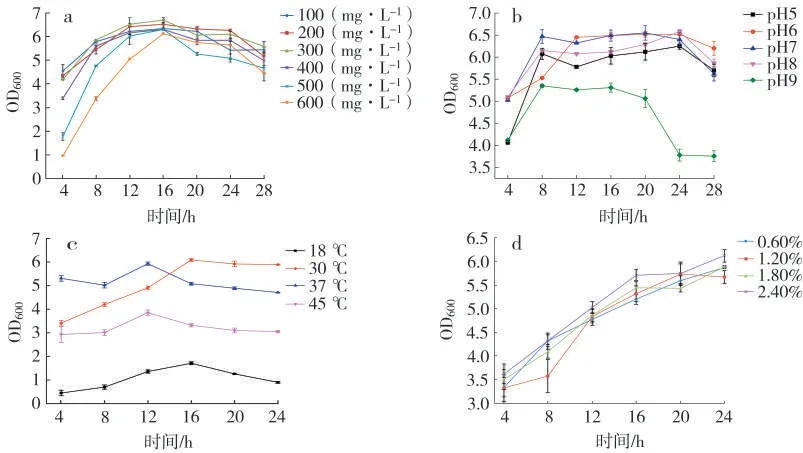
图4 不同培养条件下Acinetobacter sp.Ed2 生物量变化Fig.4 Biomass changes of Acinetobacter sp.Ed2 under different culture conditions
2.2.4 Acinetobacter sp.Ed2 降解邻苯二甲酸二丁酯的特性
Acinetobacter sp.Ed2 经培养48 h 后通过HPLC检测,发现温度在30 ℃、接种量2.4%和pH7 时分别表现出较高的降解效果,其降解率分别为81.97%±8.1%、89%±4.15%和66.23%±6.4%,见图5。
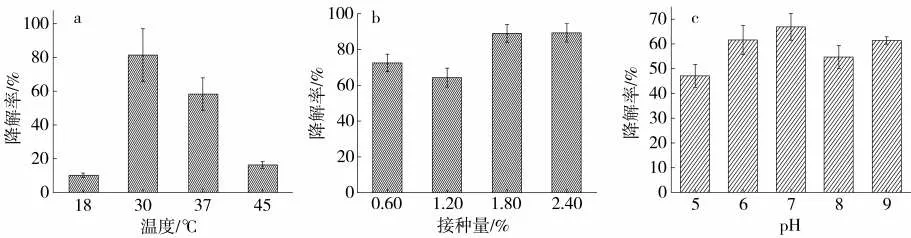
图5 不同条件下Acinetobacter sp.Ed2 对邻苯二甲酸二丁酯的降解特性Fig.5 Acinetobacter sp.Ed2's degradation characteristics to dibutyl phthalate under different conditions
2.3 降解菌处理后青枯病发病率及病原菌丰度的动态变化
2.3.1 土壤中邻苯二甲酸二丁酯降解分析
土壤中T1 处理邻苯二甲酸二丁酯残留率为36.68%±2.31%,T2 处理邻苯二甲酸二丁酯残留率为17.90%±1.99%,Acinetobacter sp.Ed2 对邻苯二甲酸二丁酯的降解率为51.17%(图6 c),说明Acinetobacter sp.Ed2 能在土壤中发挥降解作用。
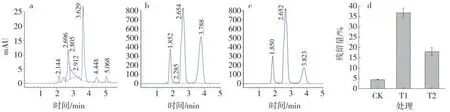
图6 土壤中邻苯二甲酸二丁酯的降解效果Fig.6 Degradation efficiency analysis of dibutyl phthalate in soil by HPLC
2.3.2 青枯菌病原菌丰度动态变化
图7 表明,CK 青枯菌菌落数量为(3.84±0.12)×108CFU/mL,T1 处理青枯菌菌落数量为(6.14±0.74)×108CFU/mL,T2 处理青枯菌菌落数量为(5.9±1.65)×107CFU/mL。T1 处理青枯菌数量显著高于CK(P=0.03),提高59.89%;T2 处理青枯菌数量显著低于CK(P<0.01)和T1 处理(P=0.04),分别降低84.63%和90.38%。说明降低土壤中邻苯二甲酸二丁酯可以有效降低青枯病病原菌的数量。
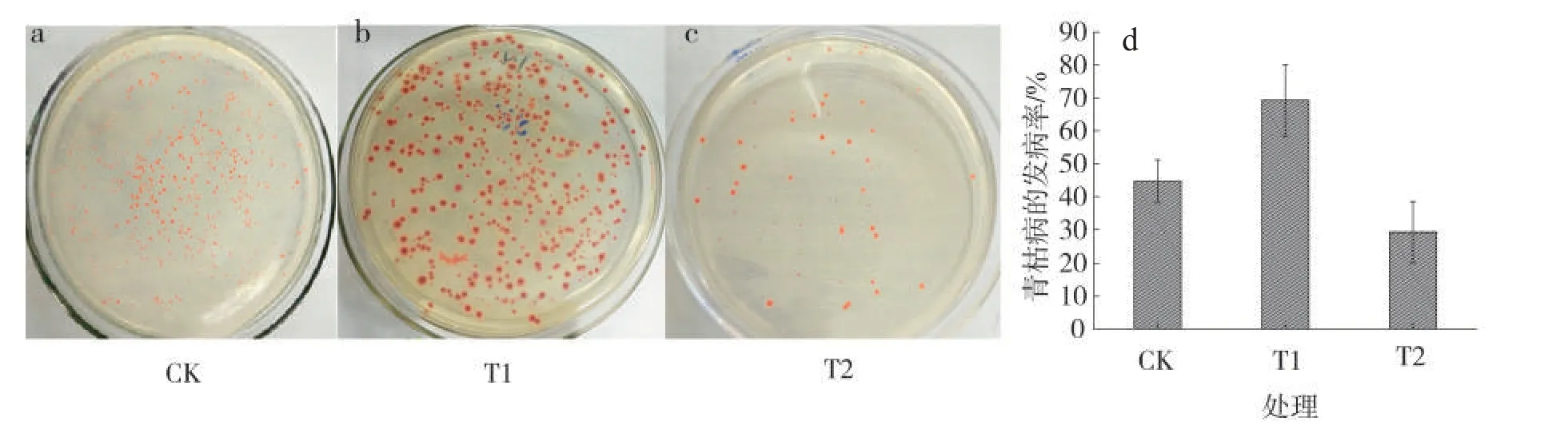
图7 不同处理土壤中青枯菌丰度及青枯病发病率的变化Fig.7 Changes of pathogen abundances of R.solanacearum in soil and incidences of bacterial wilt under different treatments
2.3.3 烟草青枯菌发病率动态变化
青枯病发病率分析结果表明,CK 青枯病发病率为44.68%±6.5%;T1处理青枯病发病为69.39%±10.9%;T2 处理青枯病发病率为29.35%±9.2%。T1 处理青枯病发病率显著高于CK(P<0.01),提高55.30%;T2 处理青枯病发病率显著低于CK(P=0.02)和T1 处理(P<0.01),分别降低52.23%和136.42%。这与刘艳霞等[22]和李石力[23]的研究结果基本一致,说明根系分泌的化感自毒物质积累是导致土壤病原微生物数量增加的重要原因,切断青枯菌的趋化效应物质可以达到防治青枯病的目的。
3 结论
盆栽试验结果表明,邻苯二甲酸二丁酯是青枯菌生长的重要营养物质,低浓度条件促进青枯菌生长,高浓度则抑制青枯菌生长;邻苯二甲酸二丁酯对青枯菌具有诱导趋化作用,是诱导和促进青枯菌烟草根际定殖的重要因素;利用邻苯二甲酸二丁酯高效降解菌降解土壤中的邻苯二甲酸二丁酯,可以显著降低土壤中青枯菌丰度和烟草青枯病的发病率。
