基于CRISPR/Cas9技术的烟草CPS2基因敲除及功能分析
2020-06-06张思琦贺凌霄孙聚涛李晓辉段杜薇徐世晓
张思琦,何 佳,贺凌霄,薛 刚,孙聚涛,李晓辉,段杜薇,徐世晓*
1.河南农业大学烟草学院,郑州市金水区文化路95 号 450002
2.河南中烟工业有限责任公司,郑州市郑东新区榆林南路16 号 450000
冷杉醇为赖百当类二萜化合物,是烟草叶面分泌的一种化学物质,多存在于香料烟和部分雪茄烟中,烤烟、白肋烟、马里兰烟中一般不存在[1]。经调制和醇化后,90%以上的冷杉醇、赖百当烯二醇氧化降解,产生多种降赖百当类化合物,其中降龙涎香醚、龙涎香内酯等物质具有强烈的龙涎香气[2]。Sallaud 等[3]通 过 转 化 二 倍 体 林 烟 草(Nicotiana sylvestris),发现CPS2 和ABS 基因直接参与冷杉醇的合成。在赖百当类合成途径中,香叶基香叶基焦磷酸(GGPP)折叠成环在柯巴基焦磷酸合酶(CPS2)催化作用下合成8-OH-CPP(8-羟基-柯巴基焦磷酸);在冷杉醇合成酶(ABS)和香紫苏醇合成酶(SCLS)催化作用下,8-OH-CPP 分别合成冷杉醇和赖百当烯二醇[4]。
CRISPR/Cas9 是利用向导RNA(gRNA)与基因靶位点序列结合,在Cas9 蛋白的作用下对靶DNA 分子进行剪切,DNA 分子发生断裂后会自动进行修复,在修复过程中可能会出现碱基的插入、缺失和替换,这可能会导致翻译提前终止,进而使原有的基因功能丧失[5-6]。CRISPR/Cas9 技术广泛应用于作物遗传改良和品种培育[7-10]。Wang 等[11]敲除小麦中3 个TaMLO 同源白粉病易感基因,得到了对白粉病具有抗性的小麦;ZHOU 等[12]创建了水稻温敏核雄性不育系;Shi 等[13]获得了玉米AGROS8 突变体,该突变体对乙烯利的敏感性降低,抗旱性提高,在干旱胁迫下籽粒产量仍较高。CRISPR/Cas9 技术在烟草上也有较多应用。潘阳等[14]对腺毛负向调控基因NtCycB2 进行敲除,提高了烟草腺毛密度,同时中性香气成分含量提高。聂梦云等[15]敲除萜类合成基因NtDXR 后,获得白化烟株,推测NtDXR 基因的突变能阻断烟草质体色素的合成;王姗姗等[16]对烟草腋芽形成关键基因NtLS 进行敲除,得到部分蛋白翻译错误的T0代突变植株。8306 品熙是以叶面分泌物为指标,经定向选育获得的烤烟新品系,其西柏烷类化合物和石油醚提取物含量提高,同时中性香气物质总量和重要致香物质如茄酮,巨豆三烯酮等含量提高[17-18]。与常规烤烟品种不同,8306 品系能够合成冷杉醇,对卷烟香气有负面影响[19-20]。柯巴基焦磷酸合酶基因(CPS2,copal-8-ol diphosphate hydratase)可编码冷杉醇,在烤烟基因组中为单拷贝。目前对烟草CPS2 基因功能及相关分子调控机制的研究尚鲜见报道。为此,利用CRISPR/Cas9技术对烟草CPS2 基因进行敲除,旨在明确CPS2基因在烟草萜类代谢途径中的作用,消除8306 品系烟叶杂气,改良烟草香气品质。
1 材料与方法
1.1 烟草材料及载体试剂盒
8306 为河南农业大学自选高香气烤烟品系,CRISPR/Cas9 载体试剂盒和检测引物由武汉天问生物科技有限公司合成。在河南农业大学育种实验室进行无菌育苗,置于恒温恒湿人工光照培养箱内,光周期为14 h 光照/10 h 黑暗;光照强度为1 500 Lx,温度为(27±1)℃。
1.2 CRISPR/Cas9 载体构建
根据NCBI 提供的mRNA 序列及对应的基因组序列信息,设计2 个CRISPR 靶位点,以提高基因打靶效率。靶位点1 序:GGAAACCCAAGCTGTGTC AT;靶位点2序列:CATGAACCATCAGAAAGTTG。设计载体构建的PCR 引物以及阳性克隆测序引物(表1),引物由武汉天一辉远生物科技有限公司合成,引物合成后,采用重叠延伸PCR 扩增出含有靶位点的片段,PCR 片段利用南京诺维赞生物科技有限公司的重组酶克隆至最终的CRISPR 表达载体。将构建的CRISPR 载体转入大肠杆菌,通过菌落PCR 筛选阳性克隆。具体方法:利用Golden Gate 克隆法,将两个sgRNA 组合在1 个载体中,分别用引物对P1-P2 和P3-P4 获得两个单独的PCR产物。使用重叠延伸PCR 法利用引物对P5-P6 将这两个片段连接,扩增出含有靶位点的片段。将目标序列连接到两个Bsa I 酶切位点之间,连接方法为一步克隆法。为进一步确定靶位点的准确性,靶位点片段与表达载体重组后,转化大肠杆菌TOP10,挑选4 个克隆,利用载体引物KN48-inf T2 as 进行 菌落PCR 验证。
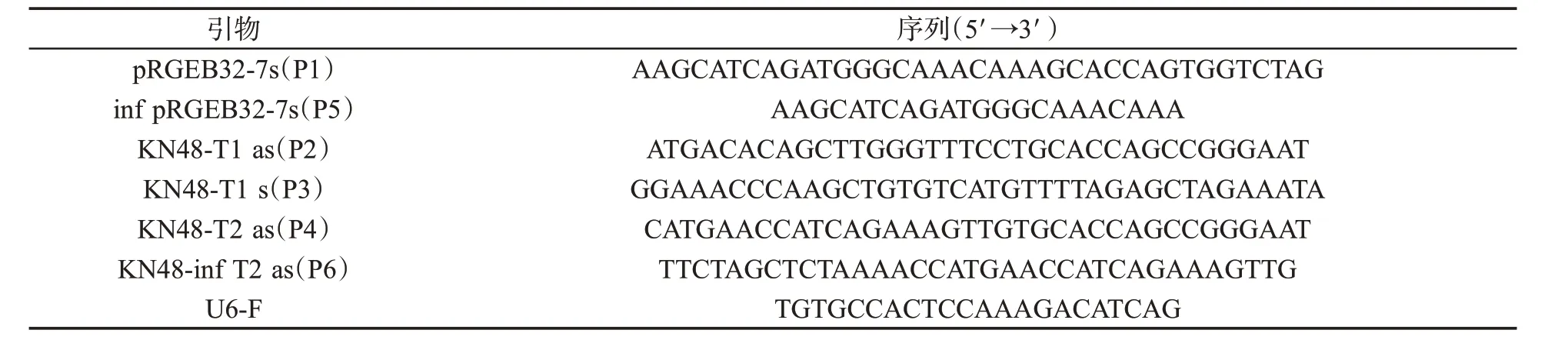
表1 PCR 扩增引物Tab.1 PCR primers
1.3 农杆菌介导的遗传转化
参照曾千春等[21]方法,成熟种子使用加入75%酒精和10%的次氯酸钠进行消毒后,接种于萌发培养基,光照(光周期为14 h 光照/10 h 黑暗;光照强度为1 500 Lx)下培养45 d。使用打孔器取0.5 cm 左右的叶片,转入预培养基,培养2 d。在含50 mg/L 卡那霉素培养基上活化农杆菌。农杆菌菌液侵染叶盘,弃去菌液,转入共培养基培养3 d。用灭菌蒸馏水及含有抗生素的水溶液清洗叶盘,吸干叶盘表面水分后,转入筛选培养基培养,待分化后转入生根培养基培养。经生根培养获得转化植株,培养1个月后至盆钵中土培。
1.4 转化植株目标基因靶位点序列突变检测
转化植株于2017 年5 月上旬移栽于河南农业大学科教园区大棚盆钵中,常规水肥管理。在苗期剪取转化植株叶片,使用Plant DNAIsolation Reagent(日本TAKARA公司)提取烟草叶片DNA,利用CTAB法抽提DNA。设计特异引物NPTII 序列,进行PCR 阳性检测。NPTII-dF:ACTGGGCACAACAGACAATCG;NPTII-dR:GCATCAGCCATGATGGATACTTT。待确认外源DNA 片段插入后,为了检测靶位点的突变情况,根据CPS2 基因序列及靶位点位置,设计引物17KN48序列对阳性植株进行PCR检测。17KN48-dF:ATCATAGCGGAATTGTTTGTCTC;17KN48-dR:TCC GTATAGATACCTAAGCGATCTG。将扩增出的目的条带进行纯化,送至北京擎科生物公司测序。利用BioEdit 7.0 软件将测序结果与模板序列进行比对。PCR 扩增体系20µL:1µL DNA,2µL 10×PCR buffer,0.4 μL dNTP mixture,正反引物各0.2µL,0.2 μL rTaq DNApolymerase,加DEPC水补充至20µL。扩增条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,30 个循环;72 ℃延伸10 min。配制1%的琼脂糖凝胶,放置电泳槽中进行电泳检测。
1.5 转化植株二萜类关键基因相对表达量测定
待转化植株叶龄60 d 时,取中部叶置于液氮中速冻,然后存放于-80 ℃冰箱中,备用。采用CTAB法提取叶片总RNA,反转录使用PrimerScript RT reagent Kit(日本TaKaRa 公司)将上述RNA 反转录为cDNA。荧 光 定 量PCR:设 计CPS2、ABS、CYC-1、CYP71D16、DXR 和Actin(内参基因)序列引物(表2)。反应体系为20 μL。包括2.0 μL 10×PCR Buffer,1 μL Mg2+,0.5 μL dNTPs,0.3 μL SYBR(20×),正反引物各0.5 μL,0.2 μL Taq DNA Polymerase,1 μL Template,14 μL ddH2O。PCR 程序为:95 ℃预变性10 min;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸10 s,40 个循环;循环结束后利用熔解曲线,从60 ℃缓慢升温至95 ℃,每次采集5 次荧光信号。依据Ct 值,计算相对表达量,并作图。
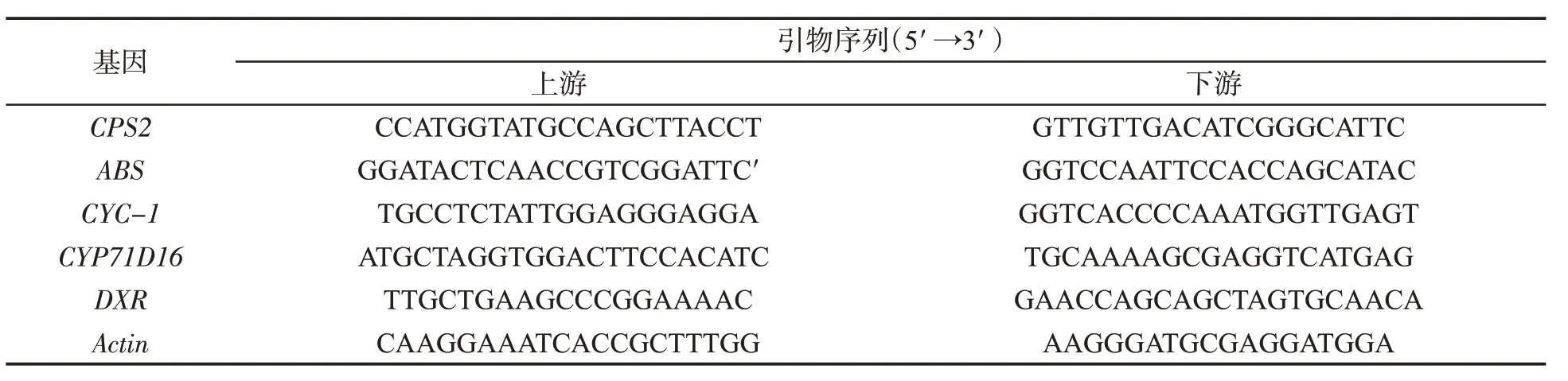
表2 荧光定量引物序列Tab.2 Sequences of primers for fluorescence quantitative PCR
1.6 转化植株叶面分泌物及GGPP 含量测定
选取叶龄60 d 时转化植株的中部叶,一部分沿主脉两侧剪切成叶圆片。另一部分将鲜叶用液氮速冻,冷冻干燥并打碎。将叶圆片置于500 mL 二氯甲烷中浸提,参照韩锦峰等[22]的方法,每片叶圆片每次浸提2 s,反复浸提4 次。收集二氯甲烷溶液,向其中加入1 mL 含正-17-烷醇的内标,同时加入10 g 无水硫酸钠。过滤,将滤液置于旋转蒸发仪中浓缩至50 mL,经氮吹仪吹干和衍生化反应后,使用GC/MS 联用仪(美国Agilent 公司HP-5890Ⅱ-5972)采用内标法进行定量分析[23]。同时取0.05 g 鲜叶液氮样研磨成粉末,加入1 mL 甲醇溶剂测定香叶基香叶基焦磷酸(GGPP)含量(质量分数)。
1.7 农艺性状调查
转化植株叶龄60 d 时,按照标准方法[24]测定株高、茎围、腰叶长、腰叶宽、有效叶片数和节距等指标。
1.8 数据处理
采用SPSS Statistic 17.0 对数据进行统计分析,采用新复极差法分析均值差异的显著性,采用Excel 2007 软件绘图制表。
2 结果与分析
2.1 gRNA 靶位点选择及表达载体构建
根据cds 序列与基因组序列(CPS2,Genebank HE588139.1)在第2 外显子区域设计2 个gRNA 靶位点序列。靶点长20 bp,靶位点1 序列为GGAAACCCAAGCTGTGTCAT,靶位点2 序列为CATGAACCATCAGAAAGTTG。靶位点在cds 区域的位置见图1,分别构建靶点1 和靶点2 的表达载体pRGEB32-Cas9-NPT II-CPS2-gRNA,见图2。利用靶位点接头引物,扩增中间载体获得含有靶位点的片段,大小约300 bp 的片段(图3),表明2个靶点gRNA 元件顺利插入到载体上。图4 显示,筛选到2 个阳性克隆菌落,PCR 产物大小约400 bp,挑选出的4 号克隆测序结果表明,2 个靶位点序列都与所设计靶点序列相同,说明构建的pRGEB32/Cas9-CPS2-gRNA 载体可进行下一步农杆菌介导的遗传转化。
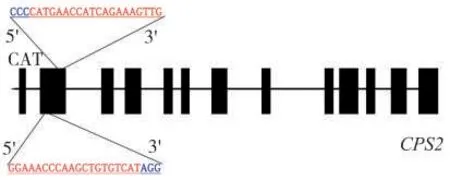
图1 2 个gRNA 靶点在CPS2 基因中的位置Fig.1 Positions of the two gRNA targets in CPS2 gene
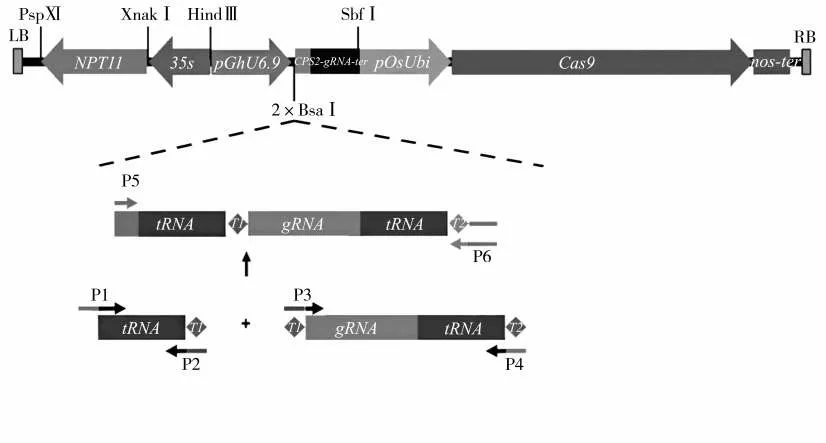
图2 pRGEB32-Cas9-NPT II-CPS2-gRNA 重组载体构建Fig.2 Construction of recombinant vector pRGEB32-Cas9-NPT II-CPS2-gRNA
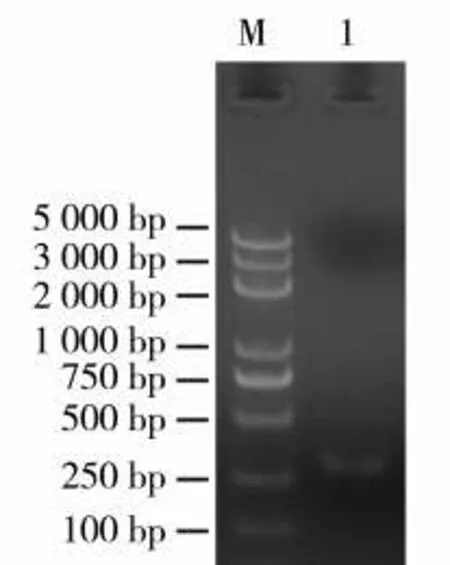
图3 靶位点片段扩增Fig.3 Amplification of target fragment
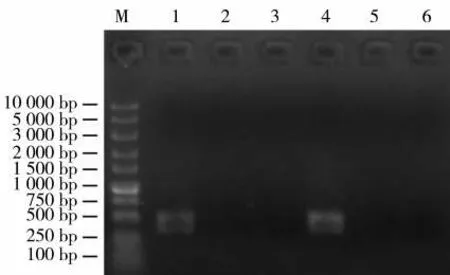
图4 菌液PCR 检测Fig.4 Bacterial liquid PCR detection
2.2 转化植株靶位点序列突变的差异分析
将所获得36 株T0代转化再生植株进行PCR阳性检测,电泳结果见图5、图6。最终得到31 株为阳性转化植株,靶位点中间序列缺失后扩增产物大小约356 bp。对阳性植株CPS2 基因进行测序表明,T0代共获得7 株成功敲除植株,突变比例达22.6%。突变均发生在靶点2 上,其中T0-26、T0-27、T0-36、T0-42 插入单个A 碱基,T0-45、T0-46插入单个C 碱基,T0-47 插入单个T 碱基(图7)。根据峰型图及子代株系测序结果,确定T0-26 为纯合型碱基插入,其余为杂合型碱基插入。对突变株系编码蛋白的氨基酸序列进行预测比对,结果见图8。由于靶点2 插入单个碱基A/T/C 引发移码,致使编码肽链提前遇到终止密码子,翻译的氨基酸链大幅缩短。
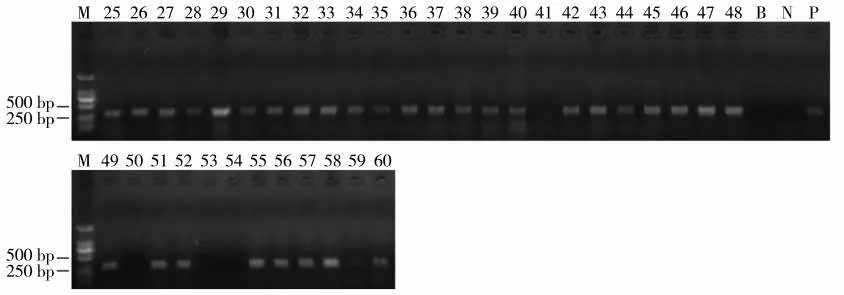
图5 T0代转化植株PCR 阳性检测Fig.5 Identification of T0 generation transformed plants by PCR detection
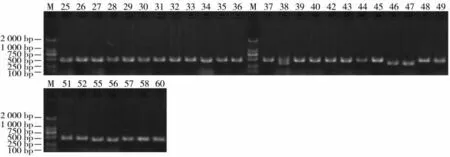
图6 T0代转化植株靶位点区域PCR 检测Fig.6 PCR detection at target sites in T0 generation transformed plants
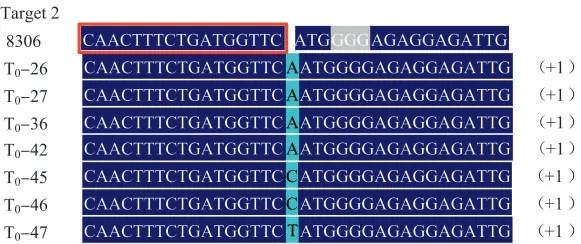
图7 靶位点区域PCR 产物测序文件解码结果Fig.7 Decoding results of sequencing files for PCR products of target sites

图8 8306 与T0代转化植株预测氨基酸序列分析Fig.8 Analysis of the predicted amino acid sequences of 8306 and T0 generation transformed plants
2.3 转化植株二萜类物质关键基因的差异表达分析
qPCR 检测结果见图9,DXR 是脱氧木酮糖磷酸代谢途径(DXR)中二萜类化合物合成的上游关键基因。与未编辑植株8306 相比,T0代转化植株DXR 相对表达量均上调。CYC-1 和CYP71D16 共同控制西柏烷类化合物的合成。CYC-1 以T0-46、T0-47 的表达量最高,T0-36 和T0-46 与对照相比表达量差异不大,T0-26、T0-27 和T0-45 与对照相比表达量均显著下降。CYP71D16 以T0-27 植株表达量最高,其他植株表达量与对照间差异不大。CPS2 和ABS 共同控制赖百当类化合物的合成。与8306 相比,T0代转化植株CPS2 的基因相对表达量显著降低,说明T0代转化植株中CPS2 转录受到抑制。同时ABS 的基因相对表达量也大幅降低,说明敲除CPS2 的同时也影响冷杉醇下游基因ABS的表达。
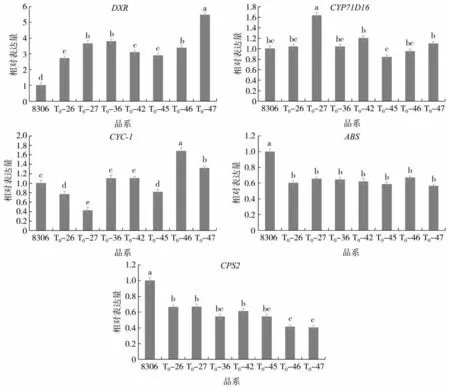
图9 8306 与T0代转化植株二萜类物质关键基因表达差异比较Fig.9 Comparison of expressions of key diterpenoids genes among 8306 and T0 transformed plants
2.4 转化植株叶面分泌物及GGPP含量的差异分析
如图10 所示,赖百当类物质主要包括冷杉醇和赖百当烯二醇,T0代转化植株冷杉醇和赖百当烯二醇含量较8306 显著降低,T0-45 冷杉醇含量最低。西柏烷类化合物包括西柏三烯一醇和西柏三烯二醇,与对照相比T0-46、T0-42、T0-47、T0-36 西柏三烯一醇含量显著升高,其余植株差异不显著;西柏三烯二醇含量除T0-27 差异不显著外,其余均出现小幅降低;T0-42 蔗糖酯类物质含量显著升高,T0-47、T0-45 显著降低,其余植株差异不显著;T0-42 和T0-46 烷烃类物质含量显著升高,而T0-26、T0-27、T0-36、T0-45 和T0-47 显著降低。与对照相比T0代转化植株GGPP 含量均显著升高,且T0-47 的GGPP 含量最高。
总体来看,敲除CPS2 后,冷杉醇和赖百当烯二醇含量减少,萜类合成前体GGPP 含量大幅提高,而西柏三烯一醇含量差异较大,西柏三烯二醇出现小幅降低。蔗糖酯、烷烃等其他代谢物质变化无明显规律。
2.5 转化植株农艺性状指标分析
农艺性状指标调查结果见表3。与8306 相比,T0代转化植株的株高、茎围、叶间距、最大叶长、最大叶宽均增加;T0-27、T0-45 和T0-46 的留叶数均增加1 片,其他植株留叶数有所减少。
3 讨论
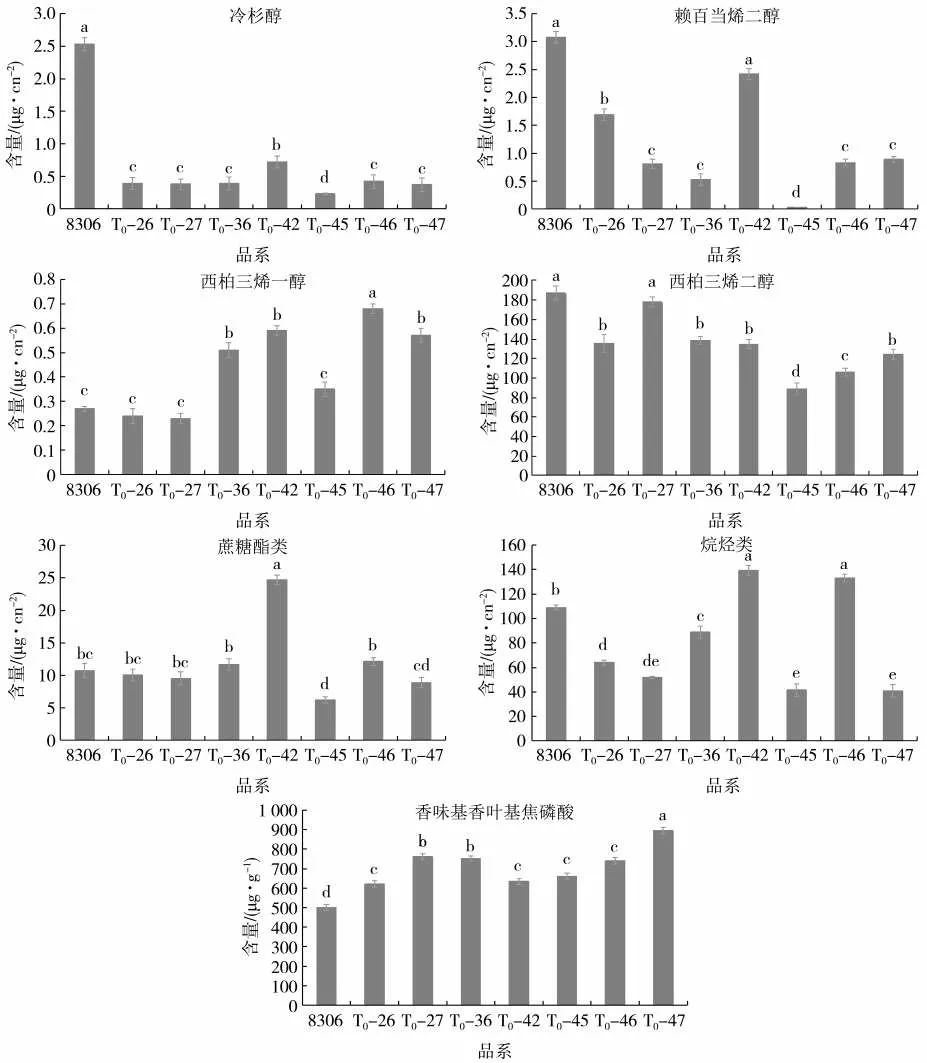
图10 8306 与T0代转化植株叶面分泌物及香叶基香叶基焦磷酸(GGPP)差异比较Fig.10 Comparison of leaf surface exudates and GGPP among 8306 and T0 generation transformed plants
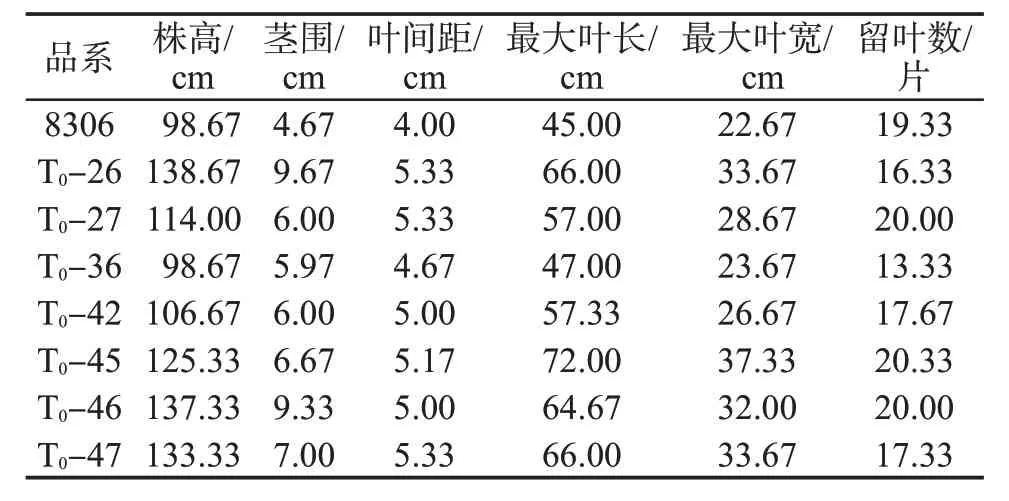
表3 8306 与T0代转化植株的农艺性状的比较Tab.3 Comparison of agronomic traits among 8306 and T0 transformed plants
本研究中利用CRISPR/Cas9 技术,共获得了7株靶位点序列突变的烟株,突变比例达22.6%。CPS2 基因的突变均发生在PAM 上游第3 碱基和第4 碱基之间,突变类型为单碱基A/T/C 的插入,以单碱基A 或T 插入所占比例最大,这与前人的研究结果基本一致[25-26]。对氨基酸序列进行预测,由于靶点2 插入单个碱基A/T/C 引发移码,致使编码肽链提前遇到终止密码子,翻译的氨基酸链大幅缩短。
本研究中T0转化植株CPS2 表达量均显著低于8306,说明对目的基因定向编辑后,其基因表达量水平显著降低,这与姚恒等[27]、宋凡等[28]、汪秉琨等[29]的研究结果一致。除此之外,ABS 的表达量也显著降低,其冷杉醇和赖百当烯二醇含量也显著降低,说明敲除CPS2 也会抑制ABS 基因的表达,引起赖百当类物质含量降低。T0转化植株DXR 表达量均显著升高,GGPP 含量也大幅提升,说明敲除CPS2 并抑制赖百当类物质合成途径后,促进了上游途径中萜类物质合成前体GGPP 的积累。敲除CPS2 会抑制赖百当类物质合成,由于对共同底物GGPP 的竞争减少,预测西柏烷类物质含量可能会适度增加。然而,西柏三烯一醇含量变化并无规律性,西柏三烯二醇除1 株差异不显著外其他均小幅降低。推测可能的原因是由于编辑技术上的差异,造成个体间西柏烷类物质含量差异;或者敲除CPS2 可能在一定程度上抑制了二萜类合成酶活性,抑制西柏烷类和赖百当类物质合成,同时积累的GGPP 有可能向其他萜类合成途径转化。敲除CPS2 对植株农艺性状会产生影响,T0代转化植株较未编辑8306 表现为株高、茎围、叶间距、最大叶长、最大叶宽均显著增加。这表明敲除CPS2 后使烟株的表型也发生了变化。
根据转化植株测序峰型及其子代株系测序结果,获得了1 株纯合型和6 株杂合型突变体。这些突变体的遗传后代群体可进行后续表型和功能的验证。而有关纯合型转化株系的无标记基因筛选以及在其自交后代中的稳定遗传和高香气品种繁育应用方面尚有待进一步研究。鉴于Cas9 蛋白与gRNA 可能发生错配导致脱靶效应,以及CRISPR系统有可能对靶位点再次剪切导致新的突变,因而对于靶修饰位点的遗传稳定性还需进一步试验验证。
4 结论
利用CRISPR/Cas9 技术对高香气烤烟品系8306 中的CPS2 基因进行敲除,得到7 株靶位点单碱基A/T/C 插入的转化植株。①CPS2 及ABS 表达量显著降低,其冷杉醇和赖百当烯二醇含量也显著降低,敲除CPS2 后可抑制赖百当类化合物的合成。②DXR 表达量显著升高,GGPP 含量也大幅提升,敲除CPS2 有助于上游途径中萜类物质合成前体GGPP 的积累。③CYC-1 和CYP71D16 表达量差异较大,西柏三烯二醇出现小幅降低,敲除CPS2可能抑制西柏三烯二醇积累。④T0代转化植株的株高、茎围、叶间距、最大叶长、最大叶宽均增加,敲除CPS2 会使植株表型性状发生变化。
