氯化物熔盐材料的制备及其热物理性质研究
2020-06-06魏小兰谢佩张雪钏王维龙陆建峰丁静
魏小兰,谢佩,张雪钏,王维龙,陆建峰,丁静
(1 华南理工大学化学与化工学院,广东广州510640; 2 中山大学材料科学与工程学院,广东广州510006)
引 言
太阳能作为一种清洁、可持续的能源越来越受到人们的重视,但它低能量密度和间歇供能方式是必须要解决的问题。聚光太阳能热发电(CSP)厂中的传储热装置,能实现无间断提供高温热能与无碳能源电力生产方式[1]。热介质储能和传热流体的研发是其中的关键技术之一,它影响着能源生产效率以及CSP 装置的运行维护费用[2]。在各种传热储热介质中,熔融盐以其蒸气压低、使用温度宽、黏度小、稳定性好等优点已经在太阳能热发电中得到广泛应用并取得成功[3-4]。国内外普遍使用的是Solar Salt 和Hitec 盐[5-6]。但硝酸盐的使用温度窄,并且在传热储热过程中会产生一系列氮氧化物NOx,影响大气环境[7]。因此,有必要研制新型的高温熔盐储能材料。
氯化物熔盐因其来源广泛、成本低廉、相变潜热大、工作温度范围宽、储热密度大等优点,作为太阳能传热储热介质,具有良好的应用前景,近年来成为国内外学者的研究热点[8-17]。由美国能源部SunShot 计划资助的MURI 项目,研究了NaCl-KCl-ZnCl2体系的热物性和不同金属在该体系中的腐蚀性[4],Li等[18]对NaCl-KCl-ZnCl2体系取了三个不同组成样品进行热物性研究,熔点在200~250℃之间,其中ZnCl2的含量在60%~75%(质量)之间,ZnCl2单价较高且蒸气压大,该体系相当高含量的ZnCl2,使熔盐成本高且蒸气压较大,同时该体系低温时熔盐黏度较大,当温度高于700℃时,熔盐才适合在管道内流动。因此该体系的以上特性阻碍了其在工业上的应用。孙李平[19]用NaCl、KCl、MgCl2三种纯盐制备了36 种不同配比的熔盐材料,通过DSC 测试对熔点、相变潜热、比热容进行测试,选出当NaCl、KCl、MgCl2质量比为7:1:2 时的样品,但该组分样品并不是体系中的最低共熔点;钟志强等[20]配制了15 种不同组成的NaCl-KCl-CaCl2体系三元熔盐,对其熔点、潜热和比热容进行测试,以上组成中的最低熔点温度为531.86℃,该组成并不是体系最低共熔点;熔盐组成非低共熔点组成,熔点较高,实际应用中会增加系统的保温能耗。且都没有对体系的密度、黏度等热物性进行测量,热物性数据少。Xu 等[16,21]研究了KCl-MgCl2和NaCl-KCl-MgCl2两个体系熔盐的热物理性质,但研究结果表明,研究的两个体系组分并不是体系的最低共熔点,KCl-MgCl2体系的比热容和热扩散系数多次测量结果中偏差较大,熔盐运行过程中不稳定。贺万玉[22]分别对KCl-LiCl、NaCl-KCl-LiCl 体系配制了18 种和36 种不同配比的熔盐,找到体系的低共熔点的组成与温度。Mohan 等[23]用FactSage 预 测 了NaCl-KCl-LiCl、MgCl2-KCl-LiCl、NaCl-MgCl2-LiCl 三 个 体 系 的 低共熔点,并对其低共熔点熔盐的热物性进行了研究。但LiCl 单价较高,含LiCl 的熔盐体系成本较高。
为寻求低成本、低能耗、运行温度高于600℃的高储热温度氯化物低共熔点熔盐传热储热材料,本文对一个二元氯化物NaCl-CaCl2体系,四个三元氯化 物 NaCl-KCl-CaCl2、NaCl-CaCl2-MgCl2、KCl-CaCl2-MgCl2和NaCl-KCl-MgCl2体系,一个四元氯化物体系NaCl-KCl-CaCl2-MgCl2体系,进行不同配比熔融。对这些不同配比的熔融物进行DSC 测试。找到低共熔点组成,并制备成熔盐材料。对这些低共熔点熔盐材料的比热容、密度、黏度等热物性进行测量;再通过测量熔盐质量损失曲线,确定熔盐工作温度上限,从而确定它们各自的最佳工作温度范围;最后根据测量结果计算了各自的储能密度。研究结果为熔盐材料在太阳能热发电系统和工业余热回收的应用提供指导。
1 实验
1.1 熔盐的制备
分析纯NaCl、KCl、CaCl2分别放入120℃干燥箱中干燥24 h,无水MgCl2吸水性非常强,且吸水后不易脱去,故密封保存[24]。按计算所得的配比称样,混合。分别放在马弗炉中加热到600℃至熔融状态,并保温3 h 使之形成均一液体,然后冷却至环境温度。研磨后得到熔盐样品,抽真空密封干燥保存。
1.2 熔盐熔点和比热容的测量
采用STA 449 F5 型差示扫描量热计(不确定度为±2%)分别测量样品熔点和比热容。比热容测量采用蓝宝石比较法进行。先测空铂金坩埚的热流做空白基线;在坩埚中加入与样品质量相近的蓝宝石再测其DSC 曲线;再在取出蓝宝石的原坩埚中加入约10 mg 左右样品再测其DSC 曲线;对比扣除空白基线的熔盐DSC 曲线和蓝宝石DSC 曲线,推算熔盐的比热容。在样品的DSC 曲线上获得熔点。测量时,以另一空铂金坩埚为参比。氮气气氛保护,流量为40 ml∙min-1,以10℃∙min-1的速度升温至650℃。
1.3 熔盐密度测量
密度是在以Archimedes 原理设计的熔盐物性综合测试仪(不确定度±2%)测量获得;以阿基米德法设计仪器测试样品密度,操作简单,测试精度高。具体方法是直接将一铂金锤挂在电子天平上,铂金锤完全浸没在熔盐液体中,所受浮力等于所排开熔盐的质量。因此测量铂金锤在浸入熔盐前后的质量差即可得到铂金锤在熔盐中所受浮力,从而推算得到熔盐密度。其计算公式如式(1)
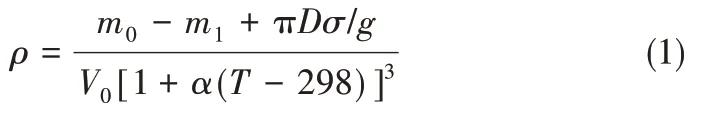
式中,m0代表铂金锤在水中的质量;m1代表铂金锤在熔盐液体中的质量;σ代表熔盐液体表面张力,由于其值很小,可忽略πDσ/g项;V0为室温时铂金锤体积;α为铂金锤体膨胀系数0.000009;T为熔盐的温度。测试过程中一直往炉膛中通氮气以保护熔盐。
1.4 熔盐黏度测量
用旋转法高温熔融黏度仪(不确定度为±2%)测量黏度;设计原理是往静止不动的装有样品的坩埚中,加一以恒速转动的转子,液态样品在坩埚和转子之间的径向方向上产生速度梯度。此时样品内部产生的阻力对转子旋转产生一个剪切力,然后根据流体牛顿力学,可得出剪切力和样品流体黏度的关系,从而得到样品黏度。即特制金属锤在固定转速(30 r∙min-1)时,读取金属锤在待测样品中的扭矩,此时扭矩即为样品流体在金属锤表面产生的剪切力矩。并根据黏度和剪切力之间的关系计算得到待测样品的黏度,计算公式如式(2)
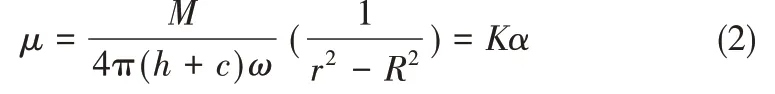
式中,μ表示黏度;M为转动力矩;h为金属锤浸入液体的深度;ω为转动角速度;r、R分别为金属锤和坩埚的半径;c为金属锤端面的黏滞阻力形成的端面效应所产生的附加管长;α表示转子以30 r∙min-1的转速转动时扭矩;K表示该仪器的黏度常数。熔盐在测试过程中,容易与空气中的水分发生水解反应,造成熔盐组分变化,为保证测试结果的准确性,在熔盐的测试过程中,通入氮气保护熔盐,隔绝空气。
1.5 熔盐热稳定性
用氧化铝坩埚取50 g熔盐,放入马弗炉中加热,在不同温度下恒温20 h,每隔4 h取出,用S 201型分析天平(精度为0.0001 g)称取熔盐质量,从而得到不同恒温温度下,熔盐质量随时间变化的曲线即质量损失曲线[25-27]。根据熔盐高温恒温下,质量损失小于2%时,确定熔盐的工作温度上限。再对性能较好的熔盐进行长期稳定性测试。
2 结果与讨论
2.1 熔盐低共熔点和相变潜热的确定
为寻求适用的中高温储热温度传热储热材料,以成本低廉、来源广泛的碱金属/碱土金属氯化物为组 元,配制 了NaCl-CaCl2、NaCl-KCl-CaCl2、NaCl-CaCl2-MgCl2、KCl-CaCl2-MgCl2、NaCl-KCl-MgCl2、NaCl-KCl-CaCl2-MgCl2共六个氯化物体系熔盐材料。在相图的指导下,在低共熔点附近取点,多次制样并做相应的DSC 测试,确定以上熔盐材料的低共熔点组成和温度。各熔盐低共熔点样品的DSC曲线如图1 所示,低共熔点的组成与温度如表1 所示。其中NaCl-KCl-CaCl2三元体系的低共熔点温度为503.8℃,是低共熔点温度最高的体系;NaCl-KCl-CaCl2-MgCl2四元体系的低共熔点温度为380.3℃最低,是低共熔点温度最低的体系,因此该体系在工业应用上的保温能耗也最低。其中NaCl-CaCl2-MgCl2体系低共熔点温度为431℃,低共熔点组成不同于Wei 等[14]研究的组成。相变潜热最大的是NaCl-CaCl2-MgCl2三元熔盐,达到241.9 J·g-1,该潜热比Wei等[14]研究的组成的相变潜热(190 J·g-1)要高出51.9 J·g-1。NaCl-KCl-CaCl2-MgCl2体系的相变潜热值也相当可观,达到了228 J·g-1。从表1 中看出,体系中同时含NaCl、MgCl2时,相变潜热都比较大,推测可能是因为NaCl 和MgCl2的熔化焓相对较大导致的[28]。
2.2 熔盐的比热容测试

图1 熔盐低共熔点的DSC曲线Fig.1 DSC curves of eutectic composition of six kinds of molten salts
以上熔盐体系从熔点到650℃的温度范围内的比热容测量结果如图2 所示。NaCl-CaCl2、NaCl-KCl-CaCl2、NaCl-CaCl2-MgCl2三个体系的比热容均随温度升高而增大,该现象表明,以上三个体系非常有利于熔盐传热储热。NaCl-KCl-MgCl2、NaCl-KCl-CaCl2-MgCl2两个体系在熔点温度至450℃内,比热容随温度增加而减小;而在450~650℃温度范围内,比热容也随温度增加而增加;KCl-CaCl2-MgCl2体系比热容在熔点至600℃范围内比热容随温度升高而增大,在600~650℃温度范围内,比热容随温度升高而缓慢减小。NaCl-CaCl2、NaCl-KCl-CaCl2体系在550~650℃温度范围内的比热容较小,在650℃下的比热容均小于1.0 J∙g-1∙K-1,分别为0.923 和0.971 J∙g-1∙K-1。NaCl-CaCl2熔盐中添加了氯化钾,比热容增大。NaCl-CaCl2-MgCl2、KCl-CaCl2-MgCl2、NaCl-KCl-MgCl2、NaCl-KCl-CaCl2-MgCl2熔盐熔点以上的比热容值均大于1.0 J∙g-1∙K-1,其中不含氯化钾的NaCl-CaCl2-MgCl2体系的比热容,要小于其他三个含氯化钾的熔盐。在这六个低共熔点熔盐中,四元熔盐NaCl-KCl-CaCl2-MgCl2的比热容整体位列第三。各液态熔盐比热容在不同温度下的实验数据如表2 所示,熔盐在所测范围内的比热容平均值也在表2列出。
2.3 熔盐的密度测试
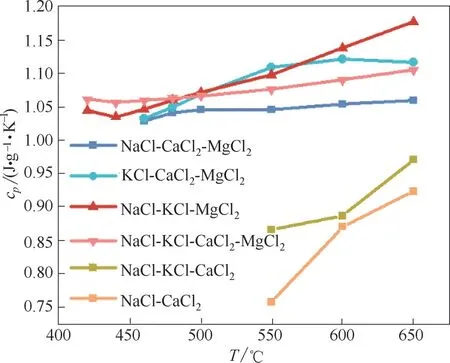
图2 熔盐的比热容随温度变化Fig.2 Heat capacity of six kinds of molten salts as function of temperature
熔盐的密度随温度变化的测量结果如图3 所示。从图中可看出,熔盐密度随温度升高而降低。密度随温度变化遵循线性方程,如式(3)所示。各熔盐的密度随温度变化的拟合公式如表3 所示,拟合度R2均大于0.98。混合物的密度可用直接相加法估算[29],与每一单一组分的密度有关。由于液态下纯CaCl2(1150 K)、纯MgCl2(1140 K)、纯NaCl(1150 K)、纯KCl(1150 K)的密度分别为2.040、1.63、1.515、1.465 g·cm-3[30];纯CaCl2、纯MgCl2的密度大于纯NaCl 和纯KCl 的,因此CaCl2、MgCl2的含量越多,尤其是CaCl2的含量越多,熔盐的密度越大。NaCl-KCl-CaCl2和NaCl-CaCl2的CaCl2含量很大,密度也较大。NaCl-KCl-CaCl2熔盐相对NaCl-CaCl2体系只添加了6.12%(mol)的密度最小的KCl,因此这两个熔盐在同一温度下的密度值相差不大;NaCl-KCl-CaCl2-MgCl2和NaCl-CaCl2-MgCl2熔盐在450~550℃之间的密度值也比较接近。从图中看出,NaCl-KCl-CaCl2-MgCl2熔盐的密度从1.97 g·cm-3减少至1.89 g·cm-3,NaCl-CaCl2-MgCl2的密度从1.96 g·cm-3减少至1.90 g·cm-3;液态下NaCl-KCl-CaCl2的密度逐渐从1.98 g·cm-3减少至1.94 g·cm-3,液态下NaCl-CaCl2的密度逐渐从1.96 g·cm-3减少至1.93 g·cm-3;液态下KCl-MgCl2-CaCl2的 密 度 逐渐 从1.72 g·cm-3减少 至1.68 g·cm-3,液 态 下NaCl-KCl-MgCl2的 密 度 从1.85 g·cm-3减少至1.75 g·cm-3;以上体系在熔点以上的温度范围内,密度值均小于2 g·cm-3。在整个测试温度范围内,样品的密度波动值均小于或等于0.1 g·cm-3,表明熔盐在管道内的热膨胀效应并不明显,有利于熔盐在管道内的传热。同时,样品在加热过程中存在微小体积变化,因此在管道设计中必须考虑这一点,预防安全隐患。
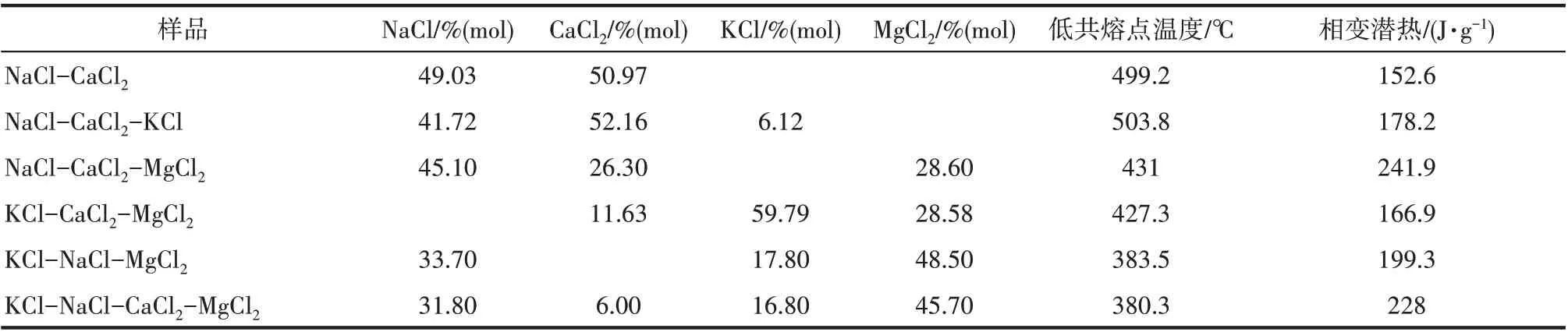
样品NaCl-CaCl2 NaCl-CaCl2-KCl NaCl-CaCl2-MgCl2 KCl-CaCl2-MgCl2 KCl-NaCl-MgCl2 KCl-NaCl-CaCl2-MgCl2 NaCl/%(mol)49.03 41.72 45.10 CaCl2/%(mol)50.97 52.16 26.30 11.63 KCl/%(mol)MgCl2/%(mol)6.12 33.70 31.80 6.00 59.79 17.80 16.80 28.60 28.58 48.50 45.70低共熔点温度/℃499.2 503.8 431 427.3 383.5 380.3相变潜热/(J·g-1)152.6 178.2 241.9 166.9 199.3 228

温度T/℃420 440 460 480 500 550 600 650平均比热容-cp/(J∙g-1∙K-1)Na/Ca-Cl Na/Ca/K-Cl Na/Ca/Mg-Cl K/Ca/Mg-Cl 0.758 0.870 0.923 0.850 0.865 0.887 0.971 0.908 1.028 1.040 1.045 1.045 1.053 1.059 1.045 1.032 1.049 1.068 1.108 1.121 1.116 1.082 Na/K/Mg-Cl 1.044 1.034 1.046 1.059 1.071 1.097 1.137 1.176 1.083 Na/K/Ca/Mg-Cl 1.061 1.056 1.059 1.062 1.066 1.076 1.090 1.105 1.072
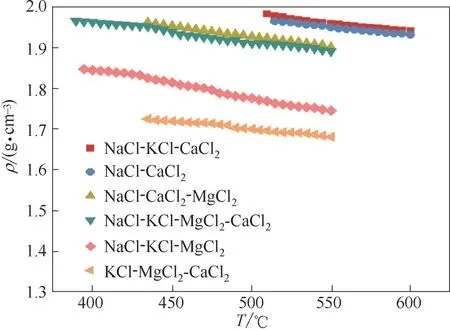
图3 熔盐的密度随温度变化Fig.3 Densities of six kinds of molten salts as function of temperature

样品NaCl-CaCl2 NaCl-CaCl2-KCl NaCl-CaCl2-MgCl2 NaCl-KCl-MgCl2 KCl-CaCl2-MgCl2 KCl-NaCl-CaCl2-MgCl2 ρ/(g·cm-3)ρ=2.17-4.02×10-4T ρ=2.20-4.41×10-4T ρ=2.22-5.03×10-4T ρ=2.21-7.12×10-4T ρ=1.89-3.83×10-4T ρ=2.22-4.87×10-4T R2 0.99351 0.98246 0.99794 0.99408 0.99466 0.98266

其中,a、b为常数。
2.4 黏度测试
样品的黏度随温度变化的测试结果如图4 所示,从图中可看出,样品黏度随温度的升高而降低,黏度随温度变化遵循的曲线方程如式(4)所示,拟合结果如表4 所示,除了NaCl-KCl-CaCl2-MgCl2的拟合度R2为0.97933,其他五个熔盐的拟合度R2均大于0.99。黏度越小,熔盐的流动性越好,流阻越小,泵送系统的能耗越小。一般认为,黏度小于5 mPa·s 的熔盐流体,其流动性较好[31],有利于其作为流体在管道内流动传热。从图中可看出,NaCl-KCl-CaCl2熔盐的黏度最大,NaCl-KCl-MgCl2熔盐的黏度最小。NaCl-KCl-MgCl2、KCl-MgCl2-CaCl2和NaCl-CaCl2熔盐在液态范围内,黏度都小于5 mPa·s,流动性较好。 NaCl-KCl-CaCl2-MgCl2和NaCl-CaCl2-MgCl2熔盐分别在温度达到410、465℃之后,黏度也降到5 mPa·s 以下,达到流动性较好的状态。NaCl-KCl-CaCl2-MgCl2熔盐流动性较好的温度区间很大,液态下整体流动性较好。而NaCl-KCl-CaCl2熔盐在520~600℃的温度范围内,黏度大于5 mPa·s,因此NaCl-KCl-CaCl2熔盐比较适合作为储热流体。

式中,c、d、e为常数。
2.5 工作温度上限确定
熔盐的工作温度范围也是熔盐传热储热流体应用必不可少的重要参数。通过测量熔盐的质量损失曲线确定熔盐静态储热稳定的工作温度上限,从而确定熔盐工作温度范围。在此温度范围内熔盐的组分变化忽略不计,性能稳定。为确定熔盐的工作温度范围,本文分别取50 g 以上六种熔盐样品研究其在不同温度下的质量损失曲线。Zhang 等[32]通过熔盐样品的热重分析TG 曲线来确定熔盐的稳定工作范围,但是TG 曲线测量的是少量毫克级别的样品在氮气吹扫下的质量变化曲线,少量样品在氮气吹扫的环境与工业运用时大量熔盐在密闭的管道内运行的实际情况差别较大,为确定熔盐的工作温度上限,本文分别取50 g 以上六种熔盐样品在密闭坩埚中静置加热,研究其在不同温度下的质量损失曲线。图5 是各体系恒温静置的质量损失曲线。从图中看出,随着温度的升高,样品的质量损失速率加快。在含氯化镁的体系,液态熔盐表面有一层白色的氧化膜和坩埚底部会生成水解产物,推测是高温下MgCl2与空气中的水分发生了反应[24,33]。以熔盐熔点温度以上50℃左右至质量损失小于2%时的温度区间为熔盐稳定运行的温度区间,则从图中 可 看 出,NaCl-CaCl2、NaCl-CaCl2-MgCl2、KCl-CaCl2-MgCl2、NaCl-KCl-MgCl2、NaCl-KCl-CaCl2-MgCl2五个熔盐的工作温度范围为550~800℃,480~700℃,480~700℃,430~650℃,430~700℃;NaCl-KCl-CaCl2体系在850℃下保温20 h,质量损失仍小于2%,因此推测该熔盐稳定运行的温度范围为550~850℃。以上氯化物体系的工作温度范围较宽且运行温度较高,适合作为中高温传储热熔盐材料,这将能提高太阳能热发电站的效率。
2.6 储能密度
储能密度决定了传储热过程中的热容量和热效率,是传储热应用中至关重要的参数,是评估材料储能优劣性和系统热效率的重要手段。单位体积储能密度可通过样品的比热容cp、密度ρ(T)和工作温度范围计算得到[29]。其计算公式如式(5)所示。

式中,E为材料储能密度;Tm、Tlim分别为材料熔化温度,材料的工作温度上限。本文中材料储能密度中的比热容值取材料比热容的平均值。各参数取值和计算结果如表5所示。材料储能密度与材料比热容、密度和工作温度范围有关。
其中NaCl-KCl-CaCl2-MgCl2四元熔盐的储能密度最大,储能密度为625.1 J∙cm-3,非常适用于作为熔盐传热储热材料。NaCl-KCl-CaCl2熔盐的储能密度仅次于NaCl-KCl-CaCl2-MgCl2熔盐,NaCl-CaCl2熔盐储能密度最小。在实际应用中,储能技术的性能除了受储能密度等状态量的影响之外,还受到介质本身在热量交换和转化等过程性能的影响[34]。
2.7 长期热稳定性
选取NaCl-KCl-CaCl2-MgCl2和NaCl-KCl-CaCl2储能密度最大的两个体系的低共熔点熔盐进行长期热稳定性实验。每种熔盐材料各取100 g,NaCl-KCl-CaCl2-MgCl2和NaCl-KCl-CaCl2低共熔 点 熔盐材料分别在600℃和700℃下恒温静置,测量其质量损失曲线。NaCl-KCl-CaCl2-MgCl2熔盐在600℃下保温180 h 和NaCl-KCl-CaCl2在700℃下保温240 h后的质量损失曲线如图6 所示。NaCl-KCl-CaCl2-MgCl2熔盐保温180 h 后质量损失为4.7%, NaCl-KCl-CaCl2熔盐保温240 h 后质量损失为0.49%,NaCl-KCl-CaCl2熔盐在700℃下能稳定运行。

样品NaCl-CaCl2 NaCl-CaCl2-KCl NaCl-CaCl2-MgCl2 KCl-NaCl-MgCl2 KCl-CaCl2-MgCl2 KCl-NaCl-CaCl2-MgCl2 cp/(J∙g-1∙K-1)0.850 0.908 1.045 1.083 1.082 1.072 ρ/(g·cm-3)ρ = 2.17- 4.02 × 10-4T ρ = 2.20 - 4.41× 10-4T ρ = 2.22 - 5.03× 10-4T ρ = 2.21- 7.12 × 10-4T ρ = 1.89 - 3.83× 10-4T ρ = 2.22 - 4.87× 10-4T Tm/K 772.3 776.8 704 656.5 700.3 653.3 Tlim/K 1073 1123 973 923 973 973 E/(J∙cm-3)460.0 559.9 505.5 475.6 463.1 625.1
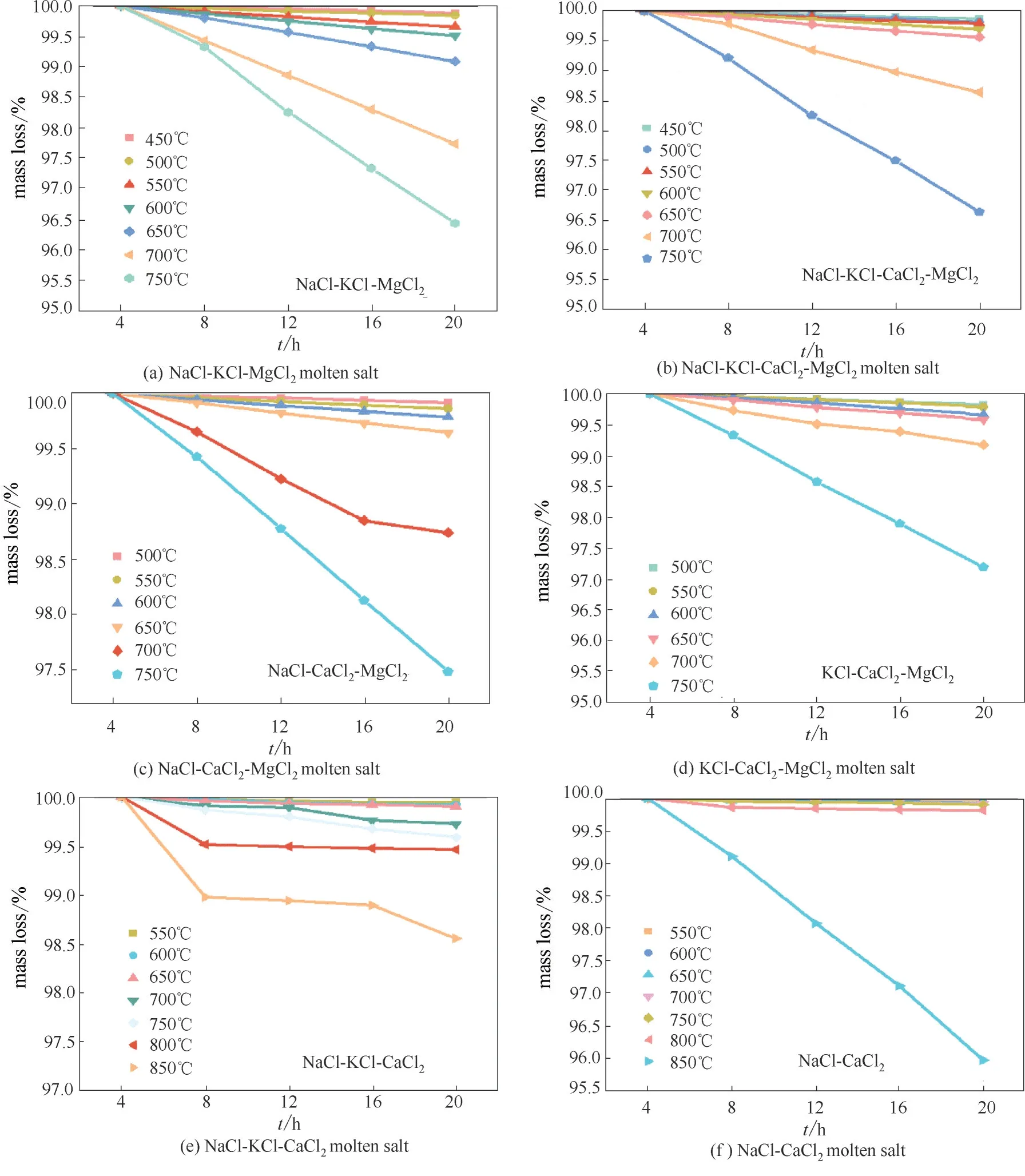
图5 熔盐在不同恒温温度下的质量损失曲线Fig.5 Mass loss curves of molten salts under isothermal conditions
3 结 论
本 文 研 究 了NaCl-CaCl2、NaCl-KCl-CaCl2、NaCl-CaCl2-MgCl2、KCl-CaCl2-MgCl2、NaCl-KCl-MgCl2、NaCl-KCl-CaCl2-MgCl2六个氯化物熔盐材料的熔点、相变潜热、比热容、密度、黏度和短期热稳定性,最后用测量所得比热容和密度结果,计算了以上材料的储能密度。综合以上六个不同熔盐材料的测试和计算结果,得到以下结论。
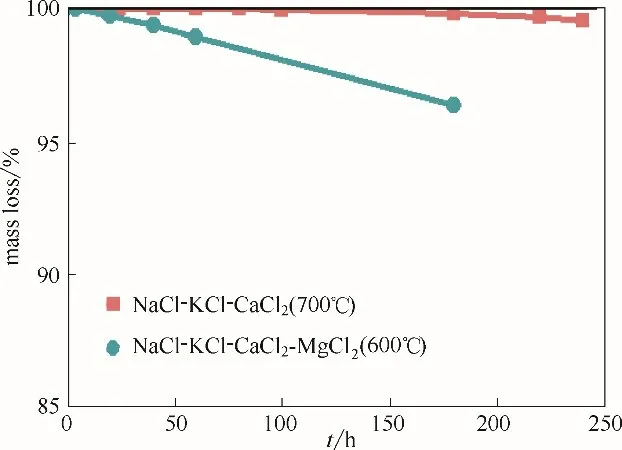
图6 NaCl-KCl-CaCl2和NaCl-KCl-CaCl2-MgCl2熔盐的质量损失曲线Fig.6 Mass loss curves of NaCl-KCl-CaCl2和NaCl-KCl-CaCl2-MgCl2 molten salts
(1)NaCl-KCl-CaCl2-MgCl2熔盐的熔点为380.3℃,相变潜热达到228 J·g-1,在420~650℃温度范围内,比热容值范围为1.061~1.105 J∙g-1∙K-1;在390~550℃温度范围内,密度值范围为1.97~1.89 g·cm-3;在400~600℃温度范围内,黏度范围为5.4~2.5 mPa·s;稳定工作温度范围为480~700℃,储能密度为625.1 J∙cm-3。与其他五个熔盐相比,该四元熔盐的熔点较低、流动性较好、储能密度较大,适合作为熔盐传热储热材料。
(2)NaCl-KCl-CaCl2熔盐黏度较大,稳定工作范围为550~850℃,稳定运行温度高,温度区间大,储能密度仅次于NaCl-KCl-CaCl2-MgCl2熔盐,适合作为熔盐储热材料。
符 号 说 明
cp——比热容,J∙g-1∙K-1
E——储能密度,J∙cm-3
μ——黏度,mPa·s
ρ——密度,g·cm-3
