活络止痛丸对风湿痹症模型大鼠的治疗作用及机制研究
2020-06-05王宝成姜文月王美慧杨明爽苏小红李芯茹
徐 杰,王宝成,姜文月*,王美慧,杨明爽,苏小红,李芯茹
(1.吉林省现代中药工程研究中心有限公司,吉林 长春 130012;2.通药制药集团股份有限公司,吉林 通化 134001)
目前类风湿关节炎(RA)动物模型有很多,如佐剂诱导的关节炎、卵蛋白诱导的关节炎、Ⅱ型胶原诱导的关节炎、多聚糖蛋白诱导的关节炎模型等。其中,佐剂性关节炎模型与人RA在发病机制、临床表现、病理、免疫等方面有着相似或相近的特点,且弗氏完全佐剂的操作简便易行,造模周期较短,重复性好,可同时获得大量模型动物,对RA的基础研究十分适宜。
本研究采用佐剂性关节炎模型作为实验动物模型,通过外界施以“风寒湿”和“风湿热”的致病因素制备风寒湿痹与风湿热痹两类病证结合动物模型,观察活络止痛丸对风寒湿痹与风湿热痹模型大鼠的治疗作用,并探讨其治疗风湿痹症的作用机制。
1 材料与仪器
1.1 动物
Wistar大鼠,雄性,体重180~220 g,由长春市亿斯实验动物技术有限责任公司提供,实验动物生产许可证为SCXK(吉)-2018-0007。
1.2 药物与试剂
活络止痛丸(批号:180501)由通药制药集团股份有限公司提供;万通筋骨片(批号:02171213K)购自通化万通药业股份有限公司;弗氏完全佐剂(批号:SLBR3897V)购自Sigma公司;大鼠白细胞介素-1β(IL-1β)酶联免疫检测试剂盒(批号:20190301)、大鼠肿瘤坏死因子-α(TNF-α)酶联免疫检测试剂盒(批号:20190301)、大鼠前列腺素E2(PGE2)酶联免疫检测试剂盒(批号:20190301)、超氧化物歧化酶(SOD)测定试剂盒(批号:20190301)、丙二醛(MDA)测试盒(批号:20190227)均购自南京建成生物工程研究所;氯化钠注射液(批号:1805090401)购自吉林省都邦药业股份有限公司。
1.3 仪器
FS40-8B1电风扇(美的环境电器制造有限公司);FS40-301电风扇(佛山市顺德区晟亚电器有限公司);DK-98-ⅡA水浴锅(天津市泰斯特仪器有限公司);DHG-9245A鼓风干燥箱(上海一恒科学仪器有限公司);Spectra Max Plus 384型酶标仪(美国美谷分子仪器有限公司);JY2003电子天平(上海舜宇恒平科学仪器有限公司);TDZ5-WS台式低速多管自动平衡离心机(长沙维尔康湘鹰离心机有限公司)。
2 方法
2.1 给药剂量
按照活络止痛丸产品说明书用法与用量要求,口服,一次4 g,一日3次。每人按平均60 kg计算为0.2 g/kg/d/人,折算大鼠给药剂量为1.25 g/kg,故设立低剂量(1.25 g/kg)和高剂量(2.5 g/kg)。
按照万通筋骨片(阳性药)产品说明书用法与用量要求,口服,每片0.28 g,一次2片,一日2~3次。每人按平均60 kg计,每天口服6片算为0.028 g/kg/d/人,折算大鼠给药剂量为0.175 g/kg。
2.2 建立风湿痹证模型[1-7]
风寒湿痹模型:Wistar大鼠随机分为空白组、风寒湿痹模型组、万通筋骨片、活络止痛丸高剂量与低剂量组,共5组,每组10只。除空白组外,其余各组大鼠在造模的第1天,每只大鼠注射弗氏完全佐剂0.1 mL于左后足跖皮内1次,造模7 d后再注射0.1 mL加强免疫,建立佐剂性关节炎大鼠模型,并将大鼠置于5~7 ℃冷水中,水深2 cm,伴以3档风力,每日1次,每次20 min,连续14 d。自造模第15天起,各给药组大鼠灌胃给药,空白组和模型组给予等量生理盐水灌胃,每日1次,连续21 d。
风湿热痹模型:Wistar大鼠随机分为空白组、风湿热痹模型组、万通筋骨片、活络止痛丸高剂量与低剂量组,共5组,每组10只。除空白组外,其余各组大鼠在造模的第1天,每只大鼠注射弗氏完全佐剂0.1 mL于左后足跖皮内1次,造模7 d后再注射0.1 mL加强免疫,建立佐剂性关节炎大鼠模型,并将大鼠置于36~38 ℃热水中,水深2 cm,伴以3档风力,同时给予37 ℃水浴恒温热蒸汽熏蒸,每日1次,每次20 min,连续14 d。自造模第15天起,各给药组大鼠灌胃给药,空白组和模型组给予等量生理盐水灌胃,每日1次,连续21 d。
2.3 检测指标及方法
2.3.1 一般状况观察 观察各组大鼠体质量、毛色、活动等情况。
2.3.2 足肿胀度 第35天末次给药后测定各组大鼠致炎足的足跖容积。
2.3.3 关节炎指数 关节炎评分标准如下:后足无关节炎表现计0分;后足1~2个关节发红,软组织肿胀计1分;后足3~4个关节发红,软组织肿胀计2分;后足5个或更多关节发红,软组织肿胀计3分;后足严重关节炎计4分。
2.3.4 大鼠血清TNF-α、IL-1β、PGE2及SOD、MDA水平 第35天末次给药后1 h,腹主动脉取血,静置30 min后,3 000 r/min离心10 min,分离血清。用试剂盒测定大鼠血清 TNF-α、IL-1β、PGE2、SOD、MDA的水平,具体操作按说明书步骤进行。
2.4 统计学处理
本研究利用SPSS17.0软件进行数据统计分析,组间比较采用双侧独立样本t检验。
3 结果
3.1 一般状况观察
在整个实验过程中,空白组大鼠精神状态良好,毛发光滑有光泽,活动自如,体重增加较快;风寒湿痹和风湿热痹模型组大鼠右后足跖致炎后肿胀明显,毛色泛黄而无光泽,活动减少,精神不振,个别大鼠右后肢足跖及踝关节出现溃烂、脱毛现象,体重增长缓慢;给予万通筋骨片及活络止痛丸干预后,上述症状均明显缓解,但模型组基本无变化。
3.2 足肿胀度
与空白组相比,风寒湿痹模型组致炎后足跖容积显著升高(P<0.001);与风寒湿痹模型相比,活络止痛丸高剂量组与万通筋骨片组显著降低足跖容积(P<0.01,P<0.05),活络止痛丸低剂量组无显著性差异(P>0.05)。实验结果见表1。
与空白组相比,风湿热痹模型组致炎后足跖容积显著升高(P<0.001);与风湿热痹组模型相比,活络止痛丸高剂量组与万通筋骨片组显著降低足跖容积(P<0.05,P<0.05),活络止痛丸低剂量组无显著性差异(P>0.05)。实验结果见表1。

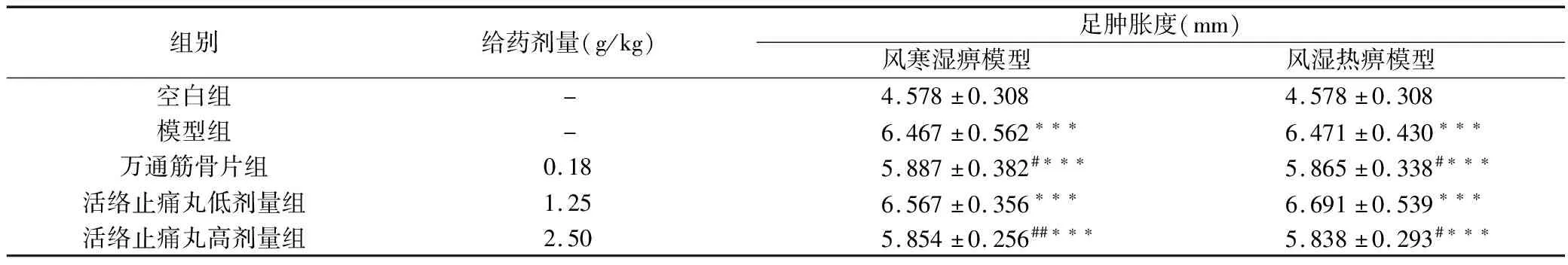
组别给药剂量(g/kg)足肿胀度(mm)风寒湿痹模型风湿热痹模型空白组-4.578±0.3084.578±0.308模型组-6.467±0.562∗∗∗6.471±0.430∗∗∗万通筋骨片组0.185.887±0.382#∗∗∗5.865±0.338#∗∗∗活络止痛丸低剂量组1.256.567±0.356∗∗∗6.691±0.539∗∗∗活络止痛丸高剂量组2.505.854±0.256##∗∗∗5.838±0.293#∗∗∗
注:与空白组比较:***P<0.001,**P<0.01,*P<0.05;与模型组比较:###P<0.001,##P<0.01,#P<0.05。
3.3 关节炎指数
与空白组相比,风寒湿痹模型组致炎后关节炎指数评分显著升高(P<0.001);与风寒湿痹模型相比,活络止痛丸高剂量组与万通筋骨片组显著降低关节炎指数评分(P<0.05,P<0.05),活络止痛丸低剂量组无显著性差异(P>0.05)。实验结果见表2。
与空白组相比,风湿热痹模型组致炎后关节炎指数评分显著升高(P<0.001);与风湿热痹模型组相比,活络止痛丸高剂量组与万通筋骨片组显著降低关节炎指数评分(P<0.001,P<0.01),活络止痛丸低剂量组无显著性差异(P>0.05)。实验结果见表2。

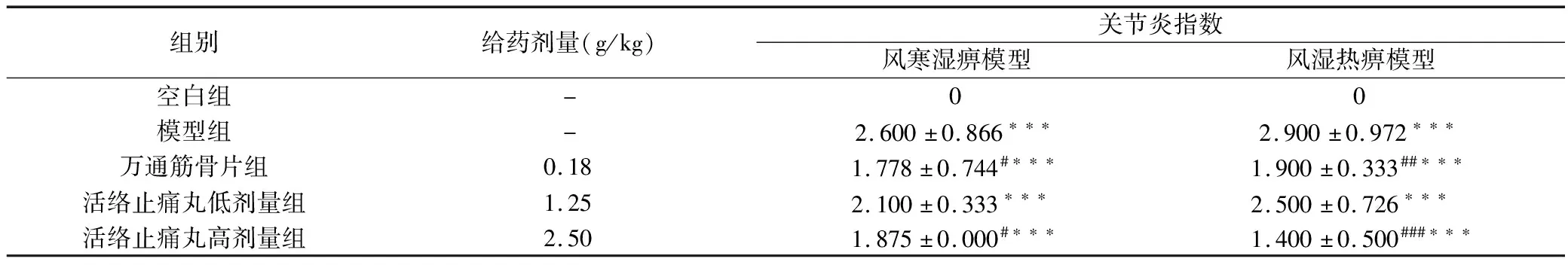
组别给药剂量(g/kg)关节炎指数风寒湿痹模型风湿热痹模型空白组-00模型组-2.600±0.866∗∗∗2.900±0.972∗∗∗万通筋骨片组0.181.778±0.744#∗∗∗1.900±0.333##∗∗∗活络止痛丸低剂量组1.252.100±0.333∗∗∗2.500±0.726∗∗∗活络止痛丸高剂量组2.501.875±0.000#∗∗∗1.400±0.500###∗∗∗
注:与空白组比较:***P<0.001,**P<0.01,*P<0.05;与模型组比较:###P<0.001,##P<0.01,#P<0.05。
3.4 大鼠血清TNF-α、IL-1β、PGE2及SOD、MDA水平
3.4.1 细胞因子TNF-α和IL-1β TNF-α:与空白组相比,风寒湿痹模型组TNF-α水平显著升高(P<0.05),与风寒湿痹模型组相比,万通筋骨片、活络止痛丸低剂量与高剂量组均显著降低TNF-α水平(P<0.05,P<0.01,P<0.05);与空白组相比,风湿热痹模型组TNF-α水平显著升高(P<0.05),与风湿热痹模型组相比,万通筋骨片、活络止痛丸低剂量与高剂量组均显著降低TNF-α水平(P<0.05,P<0.01,P<0.05)。实验结果见表3。
IL-1β:与空白组相比,风寒湿痹模型组IL-1β水平显著升高(P<0.01),与风寒湿痹模型组相比,万通筋骨片、活络止痛丸低剂量与高剂量组均显著降低IL-1β水平(P<0.05,P<0.01,P<0.05);与空白组相比,模型风湿热痹组IL-1β水平显著升高(P<0.05),与模型风湿热痹组相比,万通筋骨片与活络止痛丸高剂量组均显著降低IL-1β水平(P<0.05,P<0.05),活络止痛丸低剂量组无显著性差异(P>0.05)。实验结果见表3。


组别给药剂量(g/kg)TNF-α(ng/L)风寒湿痹模型风湿热痹模型IL-1β(ng/L)风寒湿痹模型风湿热痹模型空白组-155.520±30.806155.520±30.80618.343±5.19818.343±5.198模型组-258.007±102.397∗225.613±61.889∗25.861±5.357∗∗26.162±7.680∗万通筋骨片组0.18159.766±44.005#162.709±34.756#18.397±5.953#18.367±3.312#活络止痛丸低剂量组1.25147.470±38.960##125.621±56.151##18.073±4.329##21.610±7.101活络止痛丸高剂量组2.50158.906±35.065#145.788±45.081#19.736±4.987#18.762±3.452#
注:与空白组比较:***P<0.001,**P<0.01,*P<0.05;与模型组比较:###P<0.001,##P<0.01,#P<0.05。
3.4.2 PGE2 与空白组相比,风寒湿痹模型组PGE2水平显著升高(P<0.05);与风寒湿痹模型组相比,万通筋骨片、活络止痛丸低剂量与高剂量组均显著降低PGE2水平(P<0.05,P<0.01,P<0.05)。实验结果见表4。
与空白组相比,风湿热痹模型组PGE2水平显著升高(P<0.05);与风湿热痹模型组相比,万通筋骨片、活络止痛丸低剂量与高剂量组均显著降低PGE2水平(P<0.05,P<0.01,P<0.01)。实验结果见表4。
3.4.3 SOD和MDA SOD:与空白组相比,风寒湿痹模型组SOD活力显著降低(P<0.01),与风寒湿痹模型组相比,万通筋骨片与活络止痛丸高剂量组显著升高SOD活力(P<0.05,P<0.05),低剂量无显著性差异(P>0.05);与空白组相比,风湿热痹模型组SOD活力显著降低(P<0.001),与风湿热痹模型组相比,万通筋骨片、活络止痛丸低剂量与高剂量组均显著升高SOD活力(P<0.01,P<0.05,P<0.01)。实验结果见表5。
MDA:与空白组相比,风寒湿痹模型组MDA水平显著升高(P<0.001),与风寒湿痹模型组相比,万通筋骨片、活络止痛丸低剂量与高剂量组均显著降低MDA水平(P<0.001,P<0.001,P<0.001);与空白组相比,风湿热痹模型组MDA水平显著升高(P<0.001),与风湿热痹模型组相比,万通筋骨片、活络止痛丸低剂量与高剂量组均显著降低MDA水平(P<0.05,P<0.001,P<0.01)。实验结果见表5。


组别给药剂量(g/kg)PGE2(ng/L)风寒湿痹模型风湿热痹模型空白组-193.020±38.369193.020±38.369模型组-240.678±25.144∗242.463±32.062∗万通筋骨片组0.18195.801±37.863#200.215±28.561#活络止痛丸低剂量组1.25190.730±33.718##191.571±22.377##活络止痛丸高剂量组2.50198.518±32.982#186.495±32.609##
注:与空白组比较:***P<0.001,**P<0.01,*P<0.05;与模型组比较:###P<0.001,##P<0.01,#P<0.05。


组别给药剂量(g/kg)SOD(U/mL)风寒湿痹模型风湿热痹模型MDA(nmol/mL)风寒湿痹模型风湿热痹模型空白组-164.342±6.917164.342±6.9173.689±0.3643.689±0.364模型组-144.450±15.191∗∗141.790±9.245∗∗∗12.035±0.908∗∗∗11.371±1.531∗∗∗万通筋骨片组0.18158.300±8.309#166.183±13.441##6.768±1.285###∗∗∗8.851±2.565#∗∗∗活络止痛丸低剂量组1.25156.925±13.787153.992±11.665#4.849±1.954###5.540±1.705###∗∗活络止痛丸高剂量组2.50159.573±8.438#158.140±11.233##6.698±1.966###∗∗∗7.390±2.261##∗∗∗
注:与空白组比较:***P<0.001,**P<0.01,*P<0.05;与模型组比较:###P<0.001,##P<0.01,#P<0.05。
4 讨论
本研究采用弗氏完全佐剂诱导佐剂性关节炎,通过外界施以“风寒湿”和“风湿热”的致病因素制备风寒湿痹与风湿热痹两类病证结合动物模型,观察活络止痛丸对风寒湿痹与风湿热痹模型大鼠的治疗作用,并探讨其治疗风湿痹证的作用机制。试验结果表明,与风寒湿痹及风湿热痹模型组相比,活络止痛丸可显著降低足肿胀度、关节炎指数、血清IL-1β、TNF-α、PGE2、MDA水平,升高血清SOD水平,对风湿痹证模型大鼠具有治疗作用,为临床合理使用提供了理论依据。
