基于细菌表面展示技术的猪链球菌病-副猪嗜血杆菌病二联亚单位疫苗的小鼠保护效果评价
2020-06-05徐盛奎王春来
赵 谦,龚 俊,栾 天,徐盛奎,李 刚,王春来
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
猪链球菌病和副猪嗜血杆菌病分别是由猪链球菌(Streptococcus suis, SS)和副猪嗜血杆菌(Haemophilus parasuis, HPS)引起的猪呼吸道细菌性传染病,临床上多发生混合感染,也是仔猪常见的细菌性传染病[1-2]。疫苗预防是无抗养殖中防控这两种细菌病的关键环节[3]。但两种细菌血清型众多,灭活苗大多只对同源菌株有保护效果[4]。因此,拓展新的疫苗研究策略显得尤为重要。
Fe3+ABC 转运体底物结合蛋白(AfuA)[5]、寡肽结合蛋白A(OppA)、寡肽结合蛋白A2(OppA2)[6]与细菌的跨膜转运相关,这些转运相关蛋白具有良好的免疫原性。革兰氏阴性致病菌中的CdtB 是细胞致死膨胀毒素(CDT)全毒素的催化亚基。本实验室前期将HPS 的这4 种蛋白进行原核表达纯化后免疫小鼠进行攻毒保护试验,进一步确定rAfuA、rCdtB、rOppA、rOppA2 对HPS 均具有良好的保护效果,是HPS 亚单位疫苗候选抗原蛋白[7-9]。溶菌酶释放蛋白(MRP)存在于猪链球菌菌体表面[10],溶血素(SLY)分泌于上清中[11],二者均是SS 重要的保护性抗原,能诱导机体产生中和抗体,使免疫动物达到完全的保护。
INP 展示系统能将分子量较大的蛋白展示于菌体表面,而菌体自身的佐剂效应能诱发表面暴露的异源性抗原所引起的特异性免疫反应,使细菌表面展示的抗原蛋白能更好地被免疫系统识别[12-13]。因此,本研究利用含INP 的表面展示质粒,将AfuAOppA2、CdtB-OppA、MRP、SLY 分别展示于E. coil BL21(DE3)的菌体表面,制备了猪链球菌病-副猪嗜血杆菌病二联亚单位疫苗,并以小鼠为模型进行了初步的免疫保护效力评价。
1 材料与方法
1.1 菌株、载体及实验动物 E. coli DH5α和BL21(DE3)感受态细胞购自Tiangen Biotech(Beijing)公司;HPS 血清5 型分离株HN10、血清13 型分离株ZD12 及SS 血清2 型分离株M126、血清9 型分离株GZ2 均由本实验室临床分离并保存;pET28a-AfuA、pET28a-OppA、pET28a-OppA2、pET22b-CdtB、pET28a-MRP、pET28a-SLY 及表面展示质粒pMD-28a-INPHis 均由本实验室构建并保存;rAfuA、rCdtB、rOppA、rOppA2、rMRP、rSLY 重组蛋白均由本实验室前期制备并保存;4 周龄SPF 级KM 小鼠购自辽宁长生生物科技有限公司。
1.2 主要试剂及培养基 ISA 201 佐剂购自Seppic公司;PrimerSTAR Max DNA Polymerase、ExTaq DNA Polymerase、DNA 和 蛋 白Marker 购 自TaKaRa 公 司;One Step Cloning Kit 购自Vazyme 公司;DNA 回收试剂盒、质粒提取试剂盒、鼠抗His 抗体、山羊抗鼠IgG-HRP 购 自OMEGA 公 司;Dylight 680 标 记 的 山 羊抗鼠IgG 购自KPL 公司;增强型DAB 底物显色试剂盒购自Tiangen Biotech(Beijing)公司;细胞因子IL-2、IL-4 和IFN-γ检测试剂盒均购自CLOUD-CLONE 公司。免疫电镜委托哈尔滨兽医研究所电镜室完成。引物合成和测序工作均由吉林库美生物公司进行。Linker 序列由通用生物公司合成并克隆至pUC57质粒。
1.3 表面展示载体的构建及表面展示结果的鉴定
1.3.1 引物设计 接头Linker 是将两个蛋白序列隔开的GGGGS 的3 次重复的序列,其两端接头需要与蛋白两端的碱基序列互补。用于克隆的线性化载体要以pMD-28a-INP-His 质粒为基础反向扩增使其线性化,两端序列也需要与两侧所连接蛋白的末端碱基序列互补。根据GenBank 中HPS 基因序列(NC_011852.1)和SS 的基因序列(LS483418.1),设计用于构建pMD-INP-CdtB-OppA、pMD-INP-AfuA-OppA2、pMD-INP-MRP、pMD-INP-SLY 所需的引物序列(表1)。引物由吉林库美生物公司合成。
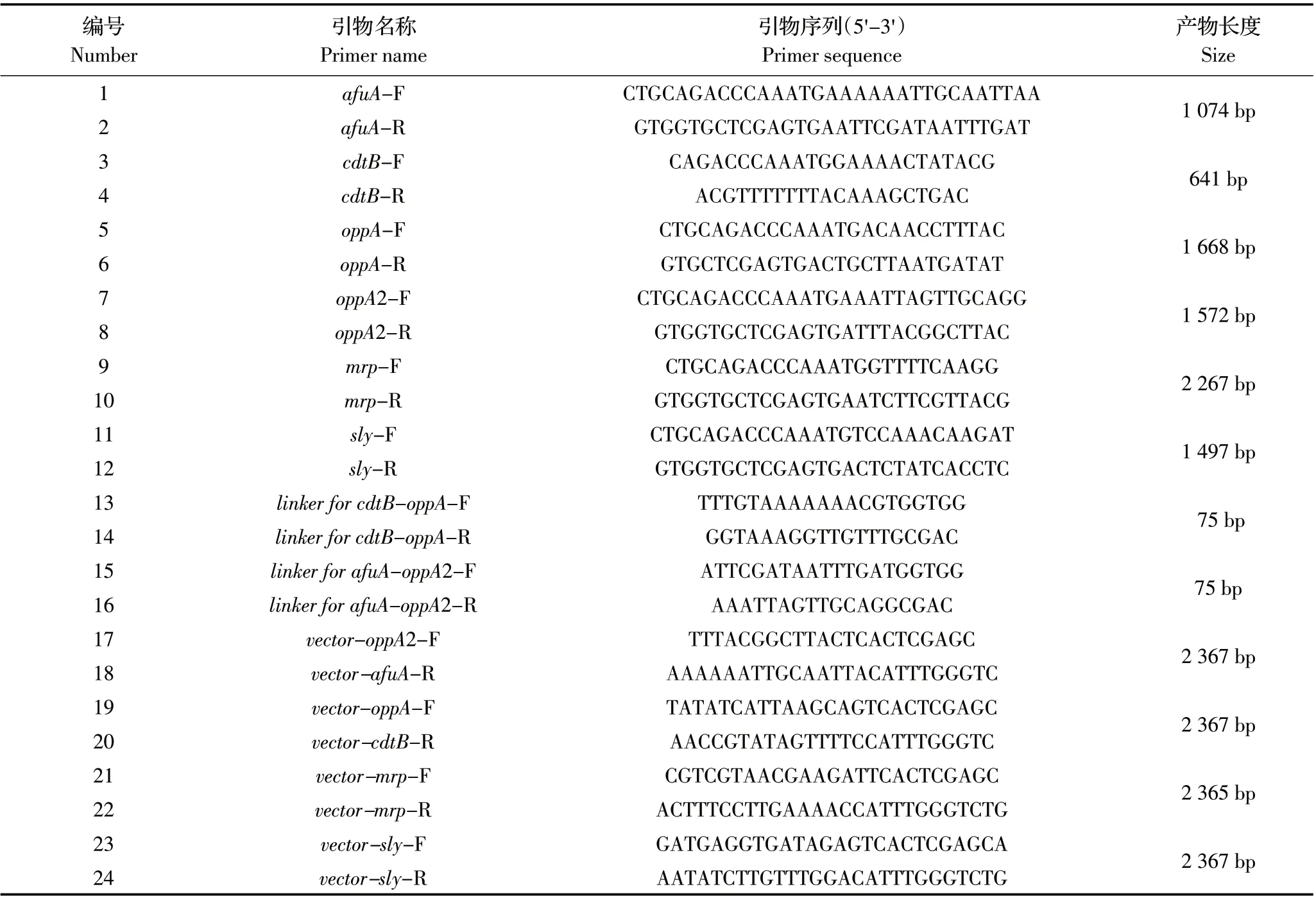
表1 引物列表Table 1 Primers in this study
1.3.2 4 个表面展示载体的构建及测序鉴定 分别以本实验室前期构建的重组质粒pET28a-AfuA、pET28a-OppA、 pET28a-OppA2、 pET22b-CdtB、 pET28a-MRP、pET28a-SLY、pUC57-Linker 质粒为模板,分别利用表1 中1 至14 引物PCR 扩增目的基因afuA、cdtB、oppA、oppA2、mrp、sly 及linker for afuA-oppA2、linker for cdtB-oppA,切胶回收后以afuA、cdtB、oppA、oppA2、linker 为模板进行融合PCR,分别构建afuA-oppA2、cdtBr-oppA融合片段。再以pMD-28a-INP-His为模板按照表1 中14 至24 引物分别反向扩增afuA-oppA2、cdtB-oppA、mrp、sly 线性化载体序列,并利用胶回收试剂盒回收产物。参照DNA 聚合酶Primer-STAR Max DNA Polymerase 的说明书,本实验中所有PCR 反应条件均为:95 ℃10 s,55 ℃10 s,72 ℃30 s。随后采用一步连接试剂盒将afuA-oppA2、cdtB-oppA、mrp、sly 分别与各自载体连接,并转化至E.coli DH5α感受态细胞,再将其涂布于LB平板(含100 μg/mL氨苄青霉素),进行抗性筛选。次日挑取单克隆接种到含氨苄的LB 液体中37 ℃震荡培养12 h 后提取质粒,由吉林库美生物公司测序,将测序验证正确的4 个重组表达载体分别转入E.coli BL21(DE3)感受态细胞中,利用氨苄抗性筛选阳性克隆保种。
1.3.3 4 个重组蛋白表面展示效果的检测 挑取阳性重组菌pMD-INP-AfuA-OppA2/BL21(DE3)、pMDINP-CdtB-OppA/BL21(DE3)、pMD-INP-MRP/BL21(DE3)、pMD-INP-SLY/BL21(DE3)单菌落于肉汤LB(含100 μg/mL 氨苄青霉素)中震荡培养至OD600nm≈0.6时加入终浓度为1 mmol/L的IPTG 于37 ℃诱导4 h,收集菌体进行SDS-PAGE,以鼠抗His 抗体(1∶2 000)为一抗,Dylight 680 标记的山羊抗鼠IgG(1∶15 000)为二抗,western blot 鉴定重组蛋白的表达。并将菌体送样,以鼠抗His 抗体(1∶2 000)为一抗,山羊抗鼠IgG(10 nm colloidal gold)为二抗,经免疫电镜观察重组蛋白AfuA-OppA2、CdtB-OppA、MRP、SLY 在细菌细胞膜的定位情况。
1.4 表面展示亚单位疫苗的制备 分别挑取重组菌pMD-INP-AfuA-OppA2/BL21(DE3)、pMD-INPCdtB-OppA/BL21(DE3)、pMD-INP-MRP/BL21(DE3)、pMD-INP-SLY/BL21(DE3)的单菌落接种至肉汤LB(含100 μg/mL 氨苄青霉素)的液体培养基中,37 ℃振荡培养至OD600nm≈0.6 时开始计时,加入诱导剂IPTG 诱导4 h 后收集菌体,加入终浓度为1.5‰的甲醛灭活。由于表面展示的rAfuA-OppA2、rCdtB-OppA、rMRP、rSLY 均融合表达His 标签,取本实验室前期纯化的已知浓度的带有His 标签的蛋白rOppA作为标准蛋白,以鼠抗His 抗体(1∶2 000)为一抗,Dylight 680 标记的山羊抗鼠IgG(1∶15 000)为 二抗,对标准品和4 种菌悬液进行western blot 鉴定,用ImageJ 软件对结果进行灰度分析,间接得出表面展示的rAfuA-OppA2、rCdtB-OppA、rMRP、rSLY 这4 种蛋白的浓度。最后将菌液与ISA 201VG 按照等质量比混合并乳化后制备表面展示二联亚单位疫苗。
1.5 小鼠免疫实验 选用SPF 级KM 小鼠160 只,随机分为4 组,每组40 只。按照表2 的免疫方案免疫小鼠。第一次免疫后间隔14 d 二次免疫,免疫途径和剂量与第一次免疫相同。在二次免疫14 d 后对小鼠经断尾采血,分离血清。
1.6 小鼠血清中抗体效价检测 将本实验室前期纯化的重组蛋白rAfuA、rCdtB、rOppA、rOppA2、rMRP 和rSLY 分别用包被缓冲液(0.1 mol/L Na2CO3-NaHCO3,PH 9.6)稀释至2 μg/mL 后包被ELISA 板,200 μL/孔,4 ℃过夜包被。按照本实验室建立的间接ELISA 方法,以上述二免14 d 后分离获得的4 组小鼠血清为一抗,山羊抗鼠IgG-HRP(1∶5 000)为二抗,分别检测小鼠血清中AfuA、CdtB、OppA、OppA2、MRP 和SLY 的抗体滴度。

表2 免疫方案Table 2 Immunization program
1.7 小鼠血清中细胞因子水平检测 采用细胞因子ELISA 试剂盒分别检测二免14 d 后分离获得的4 组小鼠血清中IL-2、IL-4、IFN-γ 的水平,测定其OD450nm,通过标准曲线计算样品中各因子含量。
1.8 小鼠攻毒实验 将包含对照组在内的4 个免疫组中每组40 只小鼠随机再分为4 组,每组10 只,分别用新鲜培养的HPS 血清5 型分离株HN10 和血清13 型分离株ZD12、SS 血清2 型分离株M126 和血清9型分离株GZ2 经腹腔注射攻毒。根据本实验室前期动物试验结果,HN10、ZD12、M126、GZ2 菌株的小鼠攻毒剂量分别为2.5×109cfu/只、5.0×108cfu/只、1.5×108cfu/只和5.0×107cfu/只。观察一周内小鼠的死亡情况。
2 结 果
2.1 表面展示载体的构建及表达情况检测 对pMDINP-AfuA-OppA2、 pMD-INP-CdtB-OppA、 pMD-INPMRP、pMD-INP-SLY 4 个重组表面展示载体质粒进行序列测定,测序结果与各基因序列的符合率为100%,表明目的基因AfuA-OppA2、CdtB-OppA、MRP、SLY 已克隆到表面展示载体中。Western blot结果显示空载体的表达菌BL21(DE3)无His 标记,4种含有重组表面展示载体的表达菌BL21(DE3)均带有His 标记(图1)。由于重组蛋白AfuA-OppA2、CdtB-OppA、MRP、SLY 在3'末 端 均 连 接 有His 标签,结果表明AfuA-OppA2、CdtB-OppA、MRP、SLY能在BL21(DE3)中表达。

图1 重组菌株自诱导后的western blot 检测Fig.1 The western blot detection of self-induced recombinant strain
2.2 重组蛋白在细胞膜的定位检测 免疫电镜实验结果显示,空载体的BL21(DE3)菌体表面未出现胶体金颗粒,4 种含有重组表面展示载体的E. coli BL21(DE3)菌体表面均出现胶体金颗粒(图2)。但免疫电镜结果并不能确定蛋白在膜上的表达丰度,只能直观得出本实验构建的重组表面展示载体能将外源蛋白AfuA-OppA2、CdtB-OppA、MRP、SLY 展示至菌体表面。
2.3 抗体滴度检测 分离二免14 d 的小鼠血清,利用间接ELISA 检测血清中AfuA、CdtB、OppA、OppA2、MRP 和SLY 的抗体滴度。结果显示,表面展示二联亚单位疫苗刺激小鼠产生的6 种抗体水平均稍低于或与纯化蛋白亚单位疫苗无显著差异,HPS-SS 灭活苗刺激小鼠产生的6 种抗体水平显著低于表面展示二联亚单位疫苗和纯化蛋白亚单位疫苗(p<0.05)(图3)。表明表面展示二联亚单位疫苗能刺激机体产生较高水平的抗体。
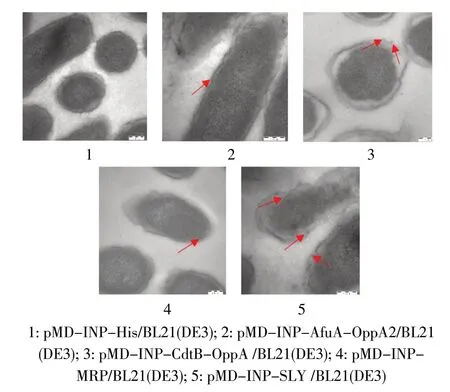
图2 免疫电镜观察重组蛋白在菌体外膜的定位情况Fig.2 Location of recombined proteins outer membrace

图3 免疫小鼠不同蛋白的ELISA 抗体滴度检测(**:p<0.05)Fig.3 ELISA antibody titers test of different proteins(**:p<0.05)
2.4 细胞因子水平检测 应用细胞因子检测试剂盒检测各个免疫组小鼠血清中细胞因子水平。结果显示,表面展示二联亚单位疫苗免疫组、纯化蛋白亚单位疫苗免疫组和灭活苗免疫组的小鼠血清中均含有IL-2、IL-4 和IFN-γ,灭活苗组小鼠血清中IL-4 含量显著高于其余两组,而3 个实验组血清中IL-2、IFN-γ的含量无显著差异(P>0.05),表面展示二联亚单位疫苗产生的IL-4 和IFN-γ稍高于纯化蛋白疫苗(图4)。表明表面展示二联亚单位疫苗在刺激机体产生细胞因子能力方面与纯化蛋白亚单位疫苗相当。
2.5 攻毒实验结果 用致死剂量的HPS 血清5 型分离株HN10 和血清13 型分离株ZD12、SS 血清2 型分离株M126 和血清9 型分离株GZ2 攻毒后,结果显示,PBS 对照组小鼠分别在攻毒后2 d、3 d、1 d、4 d 内全部死亡,表面展示二联亚单位疫苗对小鼠保护率分别为80%、80%、50%、80%,纯化蛋白亚单位疫苗对小鼠保护率分别为90%、60%、100%、80%,灭活苗对小鼠保护率分别为80%、60%、50%、60%(图5)。表面展示二联亚单位疫苗对HN10、ZD12、GZ2攻毒的小鼠保护率与纯化蛋白亚单位疫苗的保护率相当,且均优于灭活苗组。表面展示二联亚单位疫苗对SS 分离株M126 的保护效果一般,低于纯化蛋白亚单位疫苗,但与灭活苗保护效果相当。表明表面展示二联亚单位疫苗免疫保护力较好,但对不同分离株免疫保护力有所不同。
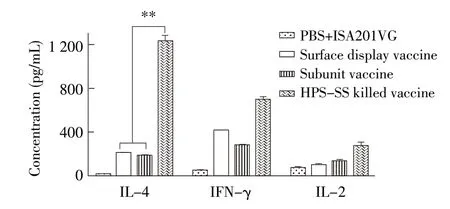
图4 各试验组细胞因子水平检测(**:p<0.05)Fig.4 Detection of cytokine levels in each group(**:p<0.05)

图5 攻毒试验结果Fig.5 Results of immune protection test
3 讨 论
SS 和HPS 血清型众多,型间交叉保护效果差,目前SS 和HPS 二联疫苗更倾向于亚单位疫苗的研发。但是目前市场上并没有商品化的基于细菌表面展示的针对猪链球菌病和副猪嗜血杆菌病的商品化的亚单位疫苗。蛋白亚单位疫苗所含抗原的免疫原性强,但刺激机体产生的免疫反应弱于灭活苗,在实际使用中通常需要进行多次免疫以达到或维持相应的免疫水平。基于表面展示的亚单位疫苗将蛋白展示于菌体表面,作为展示平台的大肠杆菌菌体也可以作为强烈的免疫刺激分子,使抗原蛋白能更好地被机体识别,促进所展示的抗原蛋白被免疫细胞识别。
本研究评价了表面展示二联亚单位疫苗对HPS和SS 分别攻毒的小鼠的保护效果,同时设立了相关蛋白的纯化蛋白亚单位疫苗组、HPS-SS 灭活苗组和对照组。从结果来看,表面展示二联亚单位疫苗刺激小鼠产生的AfuA、CdtB、OppA、OppA2 的抗体滴度基本与纯化蛋白亚单位疫苗持平,均优于灭活苗。表面展示二联亚单位疫苗刺激小鼠产生的IL-4水平稍高于纯化蛋白亚单位疫苗,这是由于除了展示于菌体表面的外源蛋白外,作为展示平台的E. coli BL21(DE3)的菌体也能激发小鼠的体液免疫。由于HPS-SS 灭活苗中含有大量的菌体抗原,该组小鼠体内IFN-γ水平高于其它两组。表面展示二联亚单位疫苗由于除所展示的蛋白外,还含有灭活的菌体,因此相比于纯化蛋白免疫组也能刺激机体产生更多的IFN-γ。从免疫攻毒实验结果来看,表面展示二联亚单位疫苗对SS 2 型和副HPS 5 型菌株攻毒小鼠的保护效果稍弱于传统的纯化蛋白亚单位疫苗。但是相对于传统的纯化蛋白亚单位疫苗来说,基于细菌表面展示的亚单位疫苗制备过程简单,只需将菌体灭活即可,省去了蛋白纯化的步骤,简化了生产工艺和生产成本,有着巨大的商品化潜力。
以上结果表明,基于表面展示的猪链球菌病-副猪嗜血杆菌病二联亚单位疫苗能激发小鼠的强烈的免疫反应,表明本研究中制备的表面展示二联亚单位疫苗对HPS 和SS 具有良好的保护效果。本研究为猪链球菌病-副猪嗜血杆菌病新型亚单位疫苗的研发提供了新思路。
