运动与自然杀伤细胞抗病毒等功能的关系和机制
2020-06-05董毅,李瑞
董 毅 ,李 瑞
在新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)疫情中,多个国家(地区)的职业运动员相继受到感染。例如,西甲瓦伦西亚俱乐部发布官方通告,称截至2020年3月17日,俱乐部约35%的雇员感染2019新型冠状病毒(2019-nCoV)。在美国职业篮球联赛中,包括鲁迪·戈贝尔、凯文·杜兰特等知名球星在内的多名队员新冠病毒检测结果呈阳性。国内,中国重剑队于2020年3月20日发布通告,3名国家队队员确诊感染新冠肺炎。研究发现,新冠肺炎在老年群体感染后的死亡率高于青年群体,并且淋巴细胞可能在其中发挥重要作用(Zhou et al.,2020)。这些现象引起人们对于如何提高免疫系统、抵抗病毒入侵的研究兴趣。因此寻找较易实现且无副作用的方法来提高机体免疫系统功能成为亟待探索的重要问题。
免疫系统是细胞和分子组成的复杂网络,其功能是保护宿主免受病毒和微生物侵袭,预防疾病。通过免疫因子杀灭被病毒感染的细胞和侵入的微生物,并可以杀灭肿瘤细胞。免疫细胞包括多种类型,其中自然杀伤(natural killer,NK)细胞是机体最重要的免疫细胞之一,属于大颗粒淋巴细胞,由骨髓中的早期先天性淋巴前体(EILP)发育而来,被认为是先天性淋巴细胞(ILC)家族的创始成员。NK细胞以其强大的细胞毒性而闻名,并且具有通过自然的细胞毒性或通过抗体依赖性细胞毒性(ADCC)自发裂解肿瘤细胞的能力。20世纪70年代,NK细胞开始受到免疫学家的重视,并开展了运动与NK细胞之间的交叉研究。例如,NK细胞与急性运动或慢性运动的关系。本文主要对运动对NK细胞的影响以及NK细胞对下游病毒、炎症等影响和机制作一个综述,期望能对本次冠状病毒感染疫情的防治提供有用的线索。
1 运动对NK细胞的影响
一直以来,研究者主要从神经内分泌等角度对机体免疫系统的调控进行研究,而运动作为一种综合性的能够动员全身系统的方式,也能够通过多种途径对免疫系统,尤其是NK细胞产生影响。
1.1 运动对NK细胞数量和活性的影响
研究表明,运动能够引起免疫系统的生理变化(何伟等,2002;黄孝瑛,1991;金锦萍 等,2007;刘淑慧 等,2002;马涛 等,2010;陶瑀 等,2019;Simpson et al.,2015)。Nieman等(1989)的早期工作就引起了人们对运动与免疫系统联系的兴趣,其研究发现,经常中等强度锻炼的人与久坐的人群相比,免疫力明显增强,上呼吸道感染(URTI)的症状更少。对健身爱好者、跑步者的调查表明,经常锻炼的人群比久坐的人群更不易感冒(Nieman,2000;Shephard et al.,1995)。一项对547名成年人进行的为期1年的流行病学研究表明,与不定期的中度到剧烈体育锻炼的人相比,经常性锻炼的人患URTI的风险降低了23%(Matthews et al.,2002)。此外,有研究证明,适度的运动可以增加血液中NK细胞的百分比(王晓军,2004)。因此,免疫力的增强可能是由于经常锻炼的人NK细胞的数量发生改变或功能得到了活化。在此方面,不少研究报告了不同的运动类型、强度和时间对外周血中NK细胞数量和活性的影响。
1.1.1 时间依赖性
研究发现,运动的持续时间对先天性和适应性免疫反应都具有深远的影响,而且NK细胞的数量和功能具有明显的时间依赖性。一些研究者首先对NK细胞在运动前后的变化进行了探讨。在一项研究中,30名健康成年男性参加了4种不同时间和强度的骑行运动:1)65%O2max,30 min;2)30%O2max,60 min;3)75%O2max,60 min;4)65%O2max,120 min。分别在锻炼之前和之后的3 min、30 min、2 h、24 h抽血测试。结果发现,运动停止后3 min NK细胞的百分比立即增加并达到顶峰,运动后30 min下降至运动前以下水平,2 h后下降至最低值,而运动后24 h逐渐恢复至基线水平(Kendall et al.,1990)。Nieman等(1992)安排10名健康男性以最大力量运动30 s。分别于运动前,运动后即刻和1 h采集血液样本发现,运动后即刻NK细胞数量显著上升,而1 h后低于运动前水平。10名年轻男性以高等(80%O2max)与中等(50%O2max)强度跑步机运动45 min,在运动前和运动后即刻,以及运动后1 h、2 h和3.5 h采集血样,分析NK细胞的数量和活性。结果显示,两种强度下,运动后即刻的NK细胞比例增加,运动后1 h和2 h均低于运动前水平,运动后3.5 h又恢复运动前水平(Nieman et al.,1993)。Strasner等(1997)对8名健康成年女性(21~33岁)以80%O2max和 40%O2max的强度进行自行车运动,分别于运动前、运动后即刻、运动后90 min和3 h采集外周血,发现两种强度下运动后即刻NK细胞的百分比上升至最高点,90 min后下降至最低点,3 h后恢复至运动前基线水平。Boas等(1996)则观察了儿童人群的情况,研究对16名进行过游泳训练的儿童与17名未进行过游泳训练的儿童进行30 s的Wingate无氧试验,运动前和运动后3 min和60 min检测NK细胞活性和细胞数量,结果发现,运动后3 min的NK细胞数量和活性显著上升,运动后60 min逐渐下降至运动前以下水平。Gabriel等(1992)进一步对职业运动员进行了观察,11名自行车运动员在功率自行车上运动60 s,在运动前、运动后即刻、15 min、30 min、1 h、2 h、4 h和24 h分别采集血样。结果发现,NK细胞运动后即刻达到峰值,30 min下降至基线水平,运动后2 h下降至基线水平以下,24 h再次到达基线水平左右。此外,有研究者还观察了10名经验丰富的马拉松运动员,受试者在实验室进行了3 h的锻炼,并在运动前和运动中1 h以及运动后5 min、1.5 h、6 h和21 h收集血液样本,与基线值对比后发现,NK细胞数量在运动后1.5 h和21 h与基线值相比显著降低。NK细胞活性在运动后的1.5 h内明显低于基线水平;运动后6 h,NK细胞活性显著下降;运动后21 h,NK细胞活性与基线水平无明显差异(Berk et al.,1990)。而对经常运动的人和久坐的人在自行车上进行标准渐进式力竭运动进行对比,发现运动后NK细胞活性都能立即达到最高水平,在120 min后降至最低点,继而在20 h内缓慢恢复至运动前水平(Brahmi et al.,1985)。还有研究对10~12岁常规训练的青春期女体操运动员与年龄和成熟程度相近且未经训练的女性进行观察,发现30 s最大无氧运动结束时NK细胞数量均显著升高,运动后24 h恢复至运动前水平,但仍有升高趋势(Wolach et al.,1998)。
还有研究对运动持续中的NK细胞进行了观察。久坐的男性进行60%O2max60 min的剧烈运动,在运动前、运动中30 min和60 min及运动后30 min和120 min采集外周静脉血样品,检测发现,运动中NK细胞数量不断升高,至运动结束后的瞬间达到最高点,30 min后下降至最低点,运动后2 h呈上升趋势但没有恢复运动前水平(Rhind et al.,1996)。Gannon等(1998)则让 10名健康男性以65%O2max进行2 h的自行车运动,在运动前与运动中30 min、60 min、90 min和120 min以及运动后4 h和24 h采血发现,NK细胞绝对数量在运动中已经开始逐渐上升,运动后即刻数量到达最高值,运动后4 h在基线以下,而在24 h恢复至基线以上。与相应的运动前相比,每当运动持续30 min,NK细胞的自然杀伤细胞毒活性(NKCA)都会显著升高,并在运动后4 h下降至基线以下,运动后24 h恢复至运动前水平附近(Gannon et al.,1998)。对15名年轻健康的志愿者在75%O2max的情况下进行60 min的自行车运动,并在运动前和运动中的数分钟以及运动后的2 h和24 h采集血液样本,测试发现,在自行车运动期间,NK细胞活性已明显升高,在2 h后降至最低,并在24 h内恢复至锻炼前水平。Shinkai等(1992)对21名年轻男性在60%O2max下进行60 min自行车运动,每30 min收集一次血样,包括运动中30 min、60 min和运动后30 min、60 min、120 min,然后进行免疫学测试。结果显示,在整个运动过程中NK细胞数量不断增加,运动后即刻到达顶峰,之后数值不断下降,60 min下降至最低点,继而开始缓慢上升,2 h后仍未恢复到运动前水平。这些研究都表明,在运动过程中,NK细胞数量随着运动的持续而增加。
也有研究的结果在时间依赖性上略有不同。比如,有研究发现,NK细胞增加在运动后2 h内即恢复正常(Pedersen et al.,1990)。Brenner等(1999)对 8名健康男性随机分配进行3种不同形式的运动(离心运动、短时间剧烈运动和长期运动),分别采集运动前、运动后即刻、运动后3 h、24 h和72 h的血样,结果发现,NK细胞数量和活性在运动后即刻达到最高值,运动后3 h内恢复至运动前的基线值,随后的24 h和72 h不断上升并超越基线值,在观察过程中,NK细胞数量从未低于运动前基线水平。
通过以上不同运动阶段、不同性别、不同年龄段以及不同人群的研究可以发现,运动本身对NK细胞数量和活性的影响具有时间依赖性。大部分研究表明,在运动期间NK细胞数量和活性不断上升,至运动后即刻达到顶峰,表明NK细胞在运动期间被募集到外周血中,随着时间推移,在运动后的0.5~2 h之间下降到最低水平后出现拐点,从下降转为上升趋势,一般到24 h都能恢复至运动前水平。结果提示,在免疫力受损的“打开窗口”期间(运动后3~72 h之间),病毒和细菌可能会入侵,从而增加亚临床和临床感染的风险。因此,提倡在运动结束后,尤其是长时间大强度的运动后,应做好一系列防护措施,如保暖,补充谷氨酰胺、维生素C/D和碳水化合物等(李家盈,1984;万月红等,2015),以保证身体在恢复期防止疾病的侵袭。
1.1.2 强度依赖性
除了时间依赖性外,研究发现,NK细胞的数量与运动强度之间也存在一定的联系。同等时间内的不同强度的运动对NK细胞的数量与活性有着不同的影响。
以上研究数据表明,运动强度是影响NK细胞活性和数量的重要因素。强度越大,NK细胞数量和活性动员越多。但大强度训练后应保证足够的休息,避免在运动后免疫功能处于低水平时病毒和细菌的攻击。
1.1.3 运动类型和模式依赖性
在运动时间和强度依赖性的基础上,国内外运动免疫学家还对不同运动类型和不同运动模式与NK细胞的关系进行了探讨。Brenner等(1999)对8名成年男性分别实施了 4 组实验:1)5 min,90%O2max,自行车;2)力量训练(卧推、肱二头肌弯举)3组,每组10次,60%~70%RM;3)2 h,60%O2max,自行车;4)静坐组。在前3种锻炼中,NK细胞数量和活性均显著增加,但在运动后3 h内恢复至锻炼前的基线值。其中在运动后即刻NK细胞数量增加最多的是第1组,其次是第3组,最后是第2组;NK细胞活性增加最多的是第3组,其次是第1组,最后是第2组。但是在所有类型的锻炼中,每个NK细胞的细胞溶解活性都没有明显改变,表明细胞活性的变化主要取决于NK细胞数量的变化(Brenner et al.,1999)。
短时间无氧运动模式:11名健康的运动员在自行车测功机上进行了60 s的剧烈运动,运动后即刻NK细胞数量比运动前增加了5倍(Gabriel et al.,1992)。10~12岁训练有素的女体操运动员和未经训练的女孩进行30 s的全力无氧运动,运动后即刻NK细胞数量增加了3倍左右(Wolach et al.,1998)。16名儿童进行30 s的全力自行车运动,运动后即刻NK细胞数量增加了大约5倍(Boas et al.,1996)。29名受试者参加了上下150个台阶的简短训练,运动后即刻NK细胞数量大约增加了4倍(Millard et al.,2013)。这些研究表明,短时间无氧运动模式能够迅速增加NK细胞数量。
其他运动模式:国内学者虞定海等(2008)以中小强度的有氧运动“健身气功和五禽戏”为运动模式,每天26~39 min,每周最少4次,持续锻炼6个月,6个月后与运动之前比较,实验组女性受试者NK细胞活性增加了19.52%,男性受试者显著增加了32%。王晓军(2004)对老年受试者进行6个月的太极拳训练,血液NK细胞含量增加了7.18%,较对照组明显提高;老年受试者在6个月的锻炼后进行了一次太极拳锻炼,运动前后血液NK细胞百分含量增加了16.48%,说明一次适量的运动对于提高老年人的免疫机能,促进身体健康,预防疾病具有积极的意义。
通过对以上文献分析发现,大多数类型和模式的运动后即刻,NK细胞数量显著升高并达到最高点(图1),但不同的运动类型和模式后升高的水平不一样。升高值从高到低依次是长时间高强度运动、短时间无氧运动、抗阻运动、中等强度运动。长时间的中等强度运动可使免疫细胞分布更加广泛,功能也能持续提高,而长时间的剧烈运动可能会导致免疫参数的轻微损害,例如,中性粒细胞功能、血清和粘膜免疫球蛋白水平、血浆谷氨酰胺浓度,以及自然杀伤细胞细胞毒性。这可能也是本次新冠肺炎疫情中职业运动员感染率较高的原因之一。
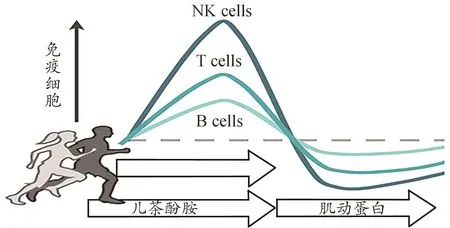
图1 运动中免疫细胞的动员情况和影响因素(Idorn et al.,2016)Figure 1. Mobilization of Immune Cells and Influencing Factors during Exercise
2 运动对NK效应的作用机制
NK细胞受运动的影响很大,运动引起的NK细胞功能变化的机制主要涉及神经系统、内分泌系统和免疫系统之间的联系。交感神经系统活动的增加以及儿茶酚胺(例如,肾上腺素和去甲肾上腺素)的分泌是运动过程中某些淋巴细胞和单核细胞亚型动员的主要原因。此外,运动会增加下丘脑-垂体-肾上腺轴(HPA)的活性,导致释放促肾上腺皮质激素释放激素、肾上腺皮质激素和皮质醇,这些物质对淋巴细胞的运输具有深远的影响(Okutsu et al.,2008)。研究表明,生理剂量的肾上腺素给药,除了降低促分裂原反应性外,还会导致外周血淋巴细胞亚群相对比例发生变化,因此可以模拟体内的部分情况(Crary et al.,1983)。总之,运动对免疫功能具有重要的调节作用。这些影响是由多种因素介导的,包括多种应激激素、运动诱导的炎症细胞因子释放以及血液流体动力学导致的细胞重新分布。下面根据运动对NK细胞的几种不同影响分别阐述其可能的机制。
2.1 运动导致NK细胞数量升高的机制
普遍认为,在血压和心输出量增加的基础上所引起的切应力作用,是外周淋巴计数增加的机制之一(Walsh et al.,2011)。研究发现,肾上腺素是在体育锻炼和其他身体应激期间将NK细胞募集到血液中的主要原因。一定强度和时间的运动可使血液中的去甲肾上腺素(NE)和肾上腺素(E)升高,进而作用于肾上腺素受体中的β2受体,该受体分布于血管平滑肌,能够介导血管扩张并影响免疫调节细胞的运输和功能(Murray et al.,1992)。同时,运动引起的急性交感刺激,导致免疫调节细胞选择性释放到循环中,随后使得细胞免疫功能发生改变。此外,运动还可能通过增加的切应力和不依赖于脾脏的β2肾上腺素能机制,将NK细胞从边缘池转移到血液中,此过程仅需数分钟(Pedersen et al.,2000)。另有研究报道,NK细胞和单核细胞的迅速增加可能是由血流量和儿茶酚胺浓度增加而导致的(Gabriel et al.,1992)。
2.2 运动导致NK细胞数量降低的机制
当运动结束后,血液重新分布到全身各个器官和组织,因此运动后血液中NK细胞数量的快速下降可能归因于归巢机制。然而尚不清楚运动后最初几个小时内NK细胞向哪个隔室或器官发生了迁移(Gabriel et al.,1992)。
2.3 运动导致NK细胞活性升高的机制
研究发现,β-内啡肽和运动均可刺激NK细胞活性。一项研究对8名健康年轻女性进行自行车运动,并在随机条件下在体内注射安慰剂和阿片样物质拮抗剂纳洛酮。安慰剂注射后的运动伴随着NK细胞活性的急剧增加,而注射纳洛酮运动后NK细胞活性不再显著升高,这表明阿片样物质系统可能在生理应激期间参与NK细胞的调节(Fiatarone et al.,1988)。动物实验表明,长期向脑内注入β-内啡肽可增强体内NK细胞的活性,而纳洛酮可消除这种作用(Jonsdottir et al.,1996)。而且体外实验也观察到β-内啡肽对NK细胞活性有明显的刺激作用。如果与人外周血单核细胞或NK细胞一起孵育,β-内啡肽会增强NK的活性(Mathews et al.,1983)。
有研究发现,运动期间NK细胞活性增加还与儿茶酚胺的分泌相关。高强度运动条件下,升高的儿茶酚胺刺激NK细胞流入循环血中,这可通过外周血NK细胞活性的增加来反映。儿茶酚胺浓度随着运动逐渐升高,在运动结束时达到最高点,随后逐渐下降,到运动后90 min时儿茶酚胺浓度与运动前的基线水平相当(Strasner et al.,1997)。在自行车运动期间,肾上腺素增加,导致NK细胞活性增加和单核细胞亚群的重新分布,从而导致NK细胞功能改变。向8位健康受试者皮下注射0.2 mg肾上腺素后,外周单核细胞的NK细胞活性在15~30 min内增加,而在接受0.2 ml生理盐水注射的3名对照受试者中,未观察到NK细胞活性的变化(Tonnesen et al.,1984)。
此外,细胞因子在NK细胞的功能中也发挥了重要作用。当BMNC与干扰素-α(IFN-α)、白介素-2(IL-2)一起预孵育时,运动期间的NK细胞活性均显著增加,表明细胞因子具有刺激NK细胞毒性活性的作用(Pedersen et al.,1988)。
这些研究结果表明,运动可以通过多种途径提高NK细胞的活性。
2.4 运动导致NK细胞活性降低的机制
研究发现,运动后2 h由于NK细胞亚群(CD16+)比例分布正常,而单核细胞比例增加了两倍,因此NK细胞活性下降可能并非由于NK细胞池大小的变化。这一发现提示,单核细胞在剧烈运动期间释放的前列腺素是NK细胞活性下降的原因(Pedersen et al.,1988)。体外研究表明,药理学浓度的甲基泼尼松龙和氢化可的松可抑制NK细胞功能,部分是通过抑制效应细胞对靶细胞的粘附来实现的(Pedersen et al.,1986)。大剂量皮质类固醇抑制NK细胞活性,其抑制的程度与类固醇浓度直接相关,与效应细胞的数量成反比(Parrillo et al.,1978;Pedersen et al.,1984)。这些研究提示,单核细胞和皮质醇是降低NK活性的主要因素。这可能是运动导致NK细胞活性降低的机制。
总之,运动能够影响NK细胞的数量和活性(表1)。作为其中的潜在介质,如儿茶酚胺、皮质醇以及β-内啡肽,其作用值得进一步研究。在分子水平上,表观遗传学改变可能与NK细胞的功能变化有关。目前,由于使用了不同的运动方式(类型,持续时间,强度和频率),而且不同的测量时间点以及不同的检测方法都限制了对NK细胞功能的研究。因此,有待进一步深入研究以确定运动对NK细胞功能影响的机制,更重要的是,应进一步研究运动后NK细胞分布目的地。
3 NK细胞对健康的作用及其机制
NK细胞通过对病毒、肿瘤、炎症等靶标进行作用,从而实现机体抗病毒、抗炎等功能,为防治类似冠状病毒的感染起作用。

表1 运动影响NK细胞数量与活性的机制Table 1 The Mechanisms underlying the Effect of Exercise on the Number and Activity of NK Cells
3.1 NK细胞对健康的作用
NK细胞是人体重要的免疫细胞,与抗肿瘤、抗病毒感染和免疫调节密切相关,在人体预防疾病发生和治疗相关疾病中也起着关键的作用。
3.1.1 NK细胞与病毒
NK细胞是天然免疫系统的效应细胞,在控制病毒感染中扮演着重要角色。最新研究表明,NK细胞可直接对病毒做出反应,可在初次病原体接触或接种疫苗后发展出记忆样反应,还具有形成适应性免疫反应的潜力。研究已经明确,NK细胞通过非中和抗体介导的ADCC作为保护性疫苗反应途径的重要性(Haynes et al.,2012)。更为重要的是,与其他免疫细胞相比,NK细胞可以有效地区分病毒感染的细胞与正常细胞,而且无需事先致敏,并具有在适应性免疫发生之前杀死病毒感染细胞的能力。因此NK细胞被募集和激活后,能够在控制冠状病毒、艾滋病毒(HIV)、乙型肝炎病毒(HBV)和淋巴细胞脉络丛脑膜炎病毒(LCMV)、小鼠巨细胞病毒(MCMV)、急性登革热病毒(DENV)感染中起着关键作用。
3.1.1.1 NK细胞与冠状病毒
严重非典型呼吸综合征(SARS)的一项流行病学调查显示,该病死亡率随着年龄的增长变化很大。其病程似乎在儿童中很少导致致命结果,但老年人的死亡率却很高,其中病死率为60岁以下的患者为13.2%,而60岁或以上的患者为43.3%,主要原因可能与年龄越大的人群免疫抵抗力越弱有关(Donnelly et al.,2003)。对新冠肺炎的流行病学调查显示,新冠肺炎死亡患者具有以下特点:淋巴细胞减少,年龄普遍较大,存在多项慢性基础疾病(高血压、糖尿病、冠心病、凝血功能异常等)。而老年人治疗效果较差可能是由于免疫系统减弱和炎症增加(Zhou et al.,2020)。这两次冠状病毒疫情流调结果提示,淋巴细胞(包括NK细胞)可能在其中发挥重要作用。
3.1.1.2 NK细胞与HIV
NK细胞的成熟和发育可以进一步增强HIV特异的ADCC活性(Parsons et al.,2014)。因此,ADCC是NK细胞控制HIV感染的有效因素。而通过治疗性疫苗接种重建T细胞功能可以增强慢性HIV-1感染者的NK细胞活性。该发现为研究HIV-1免疫所涉及的适应性免疫机制和先天性免疫机制之间的相互作用提供了新的见解,并揭示了在未来针对HIV-1的治疗性疫苗策略中利用NK细胞功能的可能性(Jost et al.,2014)。
在HIV-1感染的情况下,NK细胞的功能并不局限于靶细胞的细胞毒性消除。通过识别感染HIV-1的细胞激活NK细胞,可能导致γ干扰素(IFN-γ)和巨噬细胞炎性蛋白-1β(MIP-1β)的分泌,影响抗病毒反应并限制病毒传播。在HIV感染的人源化小鼠模型中,以NK细胞依赖性方式使用IL-15超激动剂(IL-15与可溶性IL-15Rα结合)可有效阻断HIV感染(Seay et al.,2015)。
此外,HIV感染的控制也与NK细胞有关,在刺激多功能CD8αPOSNK细胞后,NK细胞显示出强有力的细胞毒性功能,并激活 IFN-γ的表达(Vieillard et al.,2010)。同时NK细胞在急性HIV感染早期在外周血中扩张,可以在体外抑制HIV复制,还可以在感染者体内调节免疫压力,从而导致病毒逃逸(Alter et al.,2007)。回顾性研究证明,高功能CD8(+)NK细胞的数量与HIV相关的疾病标志物呈负相关,并与疾病进展延迟有关,这表明CD8(+)NK细胞代表了一种新NK细胞衍生的先天性免疫,与HIV感染的临床转归有关(Ahmad et al.,2014)。
3.1.1.3 NK细胞与HBV
急性乙型肝炎和慢性乙型肝炎患者的肝脏中均富含NKp46阳性NK细胞。急性乙型肝炎患者外周血NK细胞比慢性乙型肝炎患者和健康人群外周血NK细胞表达更高水平的活化受体和更低水平的抑制受体,从而显示出细胞溶解活性和IFN-γ产生的增加;急性乙型肝炎患者血清促炎细胞因子和趋化因子水平也较慢性乙型肝炎患者和健康人群升高。因此,在急性乙型肝炎患者中,IFN-γ和NKCA的增加与肝损伤和病毒清除有关(Zhao et al.,2012)。
将过表达颗粒酶H的NK细胞过继转移到HBV感染的小鼠中,能够清除HBV(Tang et al.,2012)。而在感染了HBV的患者中发现,活化性受体NKG2D在HBV感染过程中部分也能通过激活NK细胞来调节免疫炎症和抗病毒反应(Wang et al.,2017)。通过阻断免疫抑制细胞因子(包括IL-10和TGF-b)也可增强NK细胞在慢性HBV感染中的抗病毒功能(Peppa et al.,2010)。这些研究表明,NK细胞是针对B型肝炎免疫疗法的有效靶标。
3.1.1.4 NK细胞与LCMV、MCMV、DENV
在感染持续性LCMV的小鼠中,NK细胞的耗竭可能增强病毒特异性T细胞群的增殖或抗病毒活性,这表明NK细胞耗竭疗法是提高免疫功能的有效途径(Waggoner et al.,2014)。
NK细胞的反应控制了IFN-α/β的正、负效应与其他先天性细胞因子之间的平衡,以优化MCMV免疫反应的协调,表明NK细胞对MCMV感染的早期反应能力至关重要(Robbins et al.,2007)。
DENV感染患者症状首次出现后,NK细胞被强烈激活并增殖。DENV感染患者的血浆和诱导的皮肤水泡中IL-18水平的升高,以及IL-18R下游伴随的信号传导,相应的NK细胞亚群可以在急性感染早期定位于皮肤,这些结果代表了人类急性病毒感染期间NK细胞以前未出现的特征(Zimmer et al.,2019)。
这些研究结果表明,NK细胞对防治病毒感染具有非常重要的意义,也为进行NK细胞治疗提供了依据。
3.1.2 NK细胞与肿瘤
由于NK细胞具有无需事先致敏便有效区分和杀死异常细胞的能力,因此能够对肿瘤发生产生作用。这种识别并迅速杀死肿瘤细胞的能力,提示NK细胞具有作为抗癌“活体药物”的潜力。NK细胞控制癌症的发展,主要在恶性转化的初始阶段,但在特定的肿瘤发生背景下,也可以在肿瘤转化的最后阶段起作用(Della Chiesa et al.,2016)。目前NK细胞介导癌症治疗的策略主要有以下几个方面。
3.1.2.1 基于补体或抗体的治疗
急性髓细胞性白血病(AML):研究发现,使用脐血干细胞衍生的CD16(+)NK细胞在使用抗CD47抗体治疗时,有效促使急性淋巴细胞白血病细胞凋亡(Valipour et al.,2020);使用NKG2D配体MICA和抗CD20scfv嵌合蛋白可增强NK细胞介导的抗白血病细胞毒性重组蛋白,能通过NK细胞特异地裂解白血病细胞(Zou et al.,2018);人原代急性髓系白血病细胞移植小鼠,经CD16+NK-92细胞和抗CD123单克隆抗体照射后,存活率高于经CD16+NK-92细胞和同型对照抗体照射的小鼠,因此,CD16+NK-92细胞系与以白血病干细胞抗原为靶点的抗体结合,可以提高AML相关临床前模型的生存率(Williams et al.,2018)。
3.1.2.2 细胞因子修饰刺激NK细胞联合过继转移的治疗
肺癌:在细胞因子刺激的NK细胞和T细胞联合过继转移后,能够延长非小细胞肺癌(NSCLC)患者的生存期(Zhang et al.,2014)。此外,在同种异体、离体细胞因子刺激下或冷冻手术后的NK细胞过继转移后,晚期NSCLC患者的免疫细胞功能得到改善,生活质量明显提高(Iliopoulou et al.,2010;Lin et al.,2017)。
骨髓瘤:在高度危险的复发性骨髓瘤患者中注入新鲜NK细胞,然后每天给予IL-2后发现,在7名可评估的患者中,没有与NK细胞输注有关的严重不良反应,而同时大部分患者的疾病进展速度显著降低(Szmania et al.,2015)。
3.1.2.3 NK细胞募集和活化
胃癌:融合蛋白NKG2D-IL-15可以通过NK细胞的募集和活化,控制小鼠异种移植胃癌的生长(Chen et al.,2017)。
黑色素瘤:人dsNKG2D-IL-15可通过激活和募集小鼠NK细胞和CD8+T细胞来延迟移植黑色素瘤的生长。
乳腺癌:活化的NK细胞抑制了肿瘤的形成和器官转移,表明NK细胞负责抑制小鼠中乳腺细胞逐渐生长为肿瘤细胞。
3.1.2.4 联合治疗
通过常规放射、化学、靶向疗法、离体刺激、基因修饰、抗体的组合使用,联合自体或同种异体NK细胞和靶向NK细胞,可能会发现治疗肿瘤更为有效的方法。例如,白血病:通过使用FMS样酪氨酸激酶3(FLT3)特异地嵌合抗原受体(CAR)的自然杀伤细胞可以有效对B细胞急性淋巴细胞白血病进行靶向治疗(Oelsner et al.,2019)。神经母细胞瘤:研究发现,过继的NK细胞疗法与m3F8(鼠单克隆抗体)结合使用是安全的,并且在较高的细胞剂量下具有抗神经母细胞瘤的作用(Modak et al.,2018)。
尽管肿瘤可能发展出多种机制来抵抗内源性NK细胞的攻击,但NK细胞的离体激活、扩增和基因修饰都可以极大地提高其抗肿瘤活性,并使它们具有抵抗肿瘤微环境的能力。这些方法中的一些已被转化为临床试验,并支持在血液系统恶性肿瘤或实体瘤患者中进行NK细胞输注的临床治疗,已取得令人鼓舞的结果。除免疫疗法外,最新研究表明,诱导肿瘤细胞衰老的分子靶向药物可以引发NK细胞监控程序,导致肿瘤细胞死亡(Ruscetti et al.,2018)。进一步表明,NK细胞可能是未来多模式癌症治疗方法中的关键角色。
3.1.3 NK细胞与细菌
细菌广泛分布于土壤和水中,或与其他生物(包括人类)共生。细菌对环境、人类和动物既有好处又有危害。细菌作为病原体,可导致破伤风、伤寒、肺炎等疾病;也可用于制造食品,如奶酪、泡菜、酱油、醋、酒等。NK细胞在先天性免疫中非常重要,一般NK细胞能够很快发现入侵的微生物并对其进行清除或中和转化,还能及时清除已经被病毒感染的细胞。后来,人们发现NK细胞也能够识别并响应细菌感染的细胞。NK细胞在细菌感染中的作用已被明确确立,具有先天的抗菌免疫功能(Souza-Fonseca-Guimaraes et al.,2012)。
益生菌:有研究指出,益生菌显著诱导NK细胞分裂,导致细胞因子大量分泌,在细胞分化和炎症消退中起到重要作用。细菌的这种潜在平衡作用能够将活化信号保持在一个合理的区间,从而防止NK细胞过度或过低活化。益生菌还可调节活化的NK细胞,控制癌症干细胞的分化,从而抑制肿瘤的生长,并减少炎症性细胞因子的释放。这些研究表明,非致病性细菌在人外周血单核细胞中诱导了独特的免疫反应(Bui et al.,2015)。
肺炎克雷伯菌:肺炎克雷伯菌的外膜蛋白A和鞭毛蛋白分别通过Toll样受体2(TLR2)和Toll样受体5(TLR5)发出信号,直接刺激人体NK细胞,诱导NK细胞产生IFN-γ,并在参与识别病原体相关分子模式诱导的激活中与IL-2和促炎性细胞因子协同作用。高度纯化的NK细胞通过Toll样受体TLR直接识别并响应病原体成分,导致病原体死亡(Chalifour et al.,2004)。
金黄色葡萄球菌:通过采用野生型(WT)、IL-15基因敲除(KO)和NK细胞耗尽的小鼠模型,肺部被金黄色葡萄球菌感染后,WT小鼠气道腔中的活化NK细胞显著增加,并在肺中产生IL-15。因此确定了NK细胞在宿主防御肺部细胞外细菌感染中的关键作用,并暗示IL-15通过对NK细胞而非其他先天细胞的作用参与了这一过程(Small et al.,2008)。
分枝杆菌:从健康供体新鲜分离的NK细胞和NK细胞株中发现,NK细胞对结核分枝杆菌感染的单核细胞的裂解程度大于未感染的单核细胞,说明NK细胞对结核分枝杆菌感染的单核细胞具有杀伤活性(Vankayalapati et al.,2002)。NK细胞对感染的单核细胞的裂解能够降低分枝杆菌感染的活力,表明NK细胞在预防或应对分枝杆菌感染中非常重要(Katz et al.,1990)。
3.1.4 NK对自身免疫性疾病的影响
NK细胞属于大型的粒状淋巴细胞,是先天性和适应性免疫系统之间的重要纽带,因此其功能、数量及活性的改变与多种自身免疫性疾病有关。
重症肌无力(EAMG):研究发现,NK细胞的过继转移通过抑制滤泡辅助性T细胞(Tfh)和生发中心B细胞来改善EAMG症状。NK细胞还可以通过诱导T细胞凋亡抑制 CD4+T细胞和 Tfh(Yang et al.,2019)。而且采用IFN-α治疗重症肌无力后,患者体内NK细胞的活性增强(Bolay et al.,1998)。
系统性红斑狼疮(SLE):通过对SLE患者NK细胞表型分析发现,部分患者NK细胞表达增殖标记物Ki67出现频率明显高于健康供体。而且研究表明,细胞因子IL-15能够促进NK细胞Ki67的诱导。这些结果提示,NK细胞在调节SLE免疫介导的病理过程中起着重要作用,同时也为SLE的治疗干预提供了可能的靶点(Hudspeth et al.,2019)。SLE患者血液中NK细胞的比例和总数量显著降低,在SLE肾炎患者中更为明显(Park et al.,2009)。这与血清IFN-α水平升高有关,IFN-α是一种细胞因子,可促进SLE患者激活诱导的细胞凋亡(Huang et al.,2011)。患有活动性SLE的患者中CD56brightNK细胞的比例增加,这表明NK细胞在疾病的活跃期具有降低细胞毒性的能力,但增加了细胞因子的产生(Schepis et al.,2009)。
3.1.5 NK对炎症的影响
NK细胞不仅是抵抗病毒感染和癌症的第一道防线,还参与维持组织稳态。近年来对NK细胞活化的研究表明,它们能够对组织损伤引起的炎症刺激做出反应,并有助于炎症的发展和消退。
实验表明,小鼠自限性过敏性气道炎症模型在停止接触过敏原后,嗜酸性粒细胞和T细胞被清除,同时肺和纵隔淋巴结NK细胞数量增加。纵隔淋巴结NK细胞被激活,开始表达 CD27、CD11b、CD69、CD107a和 IFN-γ。同时NK细胞表达CMKLR1(一种促分解介质resolvin E1的受体)并消耗NK细胞以降低了resolvin E1介导的过敏性炎症的分解(Haworth et al.,2011)。
在丙型肝炎病毒(HCV)感染的情况下,肝细胞和库普弗细胞(KC)均能够释放IL-1β和IL-18,而KC可以通过这种机制激活NK细胞(Pan et al.,2016;Zannetti et al.,2016)。虽然肝细胞死亡会加剧肝脏炎症,但IL-18可以发挥保护功能从而限制肝脏损伤,IL-18的保护作用部分是由于激活NK细胞,并诱导激活程序性死亡受体1(PDL1)和凋亡相关因子配体(FasL)引起NK细胞记忆(Terme et al.,2012,Van den Boorn et al.,2016)。 NK细胞还可以通过在炎症过程中分泌TNF-α和IL-22,而对肝组织再生产生有益作用,刺激肝细胞增殖以替代垂死的肝细胞(Cosgrove et al.,2008,Park et al.,2011)。
此外,NK细胞的细胞毒性活性可以通过NKG2D受体与早期活化的HSC表达的RAE-1配体结合,从而杀死HSC衍生的成纤维细胞,抑制纤维化的发展(Melhem et al.,2006)。
3.2 NK细胞清除细胞靶标的机制
NK细胞清除靶标的机制主要包含以下途径:1)释放含有细胞凋亡诱导酶的细胞毒性囊泡,包括丝氨酸蛋白酶颗粒酶B和造孔蛋白穿孔素,靶细胞上的受体结合和摄取这些囊泡后,导致细胞溶解;2)在激活受体结合后通过Fas配体或TRAIL死亡受体进行信号传导,从而诱导细胞凋亡;3)释放具有有效抗病毒和抗肿瘤活性的细胞因子(包括 IL-2、IL-15、IL-12和 IL-18);4)IgG 抗体的恒定(Fc)结构域,通过FcγRIIIA受体(CD16)与NK细胞结合而触发ADCC。
4 结论
运动与NK细胞之间具有紧密的直接联系。运动锻炼增加了循环血中NK细胞的数量和活性,而NK细胞对运动时间、强度和类型/模式都有一定的依赖性,如大强度长时间训练后的免疫抑制比其他运动形式严重。因此,应根据运动对NK细胞的影响,合理安排训练计划,并在训练后做好身体防护措施。未来的研究需要进一步解决运动诱导的NK细胞募集与循环的机制。更重要的是,应探明运动动员NK细胞后的目的地。NK细胞在宿主应对病毒、炎症、癌症、自身免疫性疾病等方面有着突出的杀伤能力。目前,利用NK细胞开发的免疫疗法越来越多,临床试验的结果也令人鼓舞。未来通过运动训练激活NK细胞可以作为一种抗病毒、肿瘤等疾病的预防和治疗方法,从而预防类似冠状病毒感染的疫情。将运动训练与免疫功能、疾病的控制联系起来,将可能成为未来的研究热点之一。
