HPLC法测定鼻炎康胶囊中欧前胡素的含量
2020-06-04马海平
马海平,王 曼,许 尚,朱 军
(1.长江大学附属仙桃市第一人民医院 药学部,湖北 仙桃 433000;2.湖北医药学院附属东风医院,湖北 十堰 442008)
鼻炎康胶囊是湖北省仙桃市第一人民医院的制剂产品,收载于《湖北省医疗机构制剂规范(2011年版)》,是由苍耳子、白芷、薄荷、辛荑、桑白皮、黄芩、金银花共7味药材经煎煮、浓缩、干燥而成的硬胶囊剂中成药,内容物为土黄色粉末,味微苦。具有消风散炎、宜通鼻窍的功效,可用于鼻塞流涕、鼻炎、鼻窦炎及过敏性鼻炎的治疗。鼻炎康胶囊隶属本院自制制剂,目前其质量控制标准只有相应药材的薄层色谱鉴定和浸出物含量。质量标准相对宽松,缺少有效的含量测定方法来评估药品药效和安全性。白芷作为本处方中的主药之一,是鼻炎康胶囊发挥疗效的重要成分和保证。
白芷为伞形科当归属植物,始载于东汉《神农本草经》,名白,芳香,列为中品,性温,味辛。具有解表散寒、祛风止痛、通鼻窍、燥湿止带、消肿排脓的功效[1]。白芷中含有丰富的异欧前胡素、欧前胡素、佛手柑内酯、珊瑚菜素、氧化前胡素等多种有机酸类成分[2]。
欧前胡素又名白芷乙素,属于6,7-呋喃香豆素类化合物,广泛存在于白芷、欧前胡、当归、蛇床等药用植物中,分子式C16H14O4,分子量270.209 96。性状为白色粉末,不溶于水,易溶于弱极性有机溶剂,为重要的天然活性物质,具有镇痛、消炎、抗肿瘤和抑制心肌肥大等药理作用[3]。临床上广泛应用于藿香正气水、龙葵银消片和元胡止痛片等多种中药复方制剂,是大鼠经胃白芷提取液后血浆中的主要成分[4]。《中华人民共和国药典(一部)》已建立了中药材白芷的相应质量标准,即利用高效液相色谱法测定白芷中欧前胡素的含量。本实验参考该法,拟通过建立鼻炎康胶囊中欧前胡素含量测定的高效液相色谱法,建立全面可靠的鼻炎康胶囊制剂产品的质量控制标准,为患者提供安全有效的医院制剂产品。
1 仪器与耗材
1.1 仪器
P1201型高效液相色谱仪(大连依利特),UV230Ⅱ紫外-可见检测器,AL204电子分析天平(梅特勒/精确度1×10-4g),超声波清洗器(KQ-50B),移液枪(100-1 000 μL,赛默飞)。
1.2 耗材
欧前胡素对照品(上海源叶,99.8%,供含量测定用);甲醇(色谱纯,SIMARK)、水(纯化水自制)、定量滤纸(双圈11 cm)、微孔滤膜(Merck有机系0.45 μm)、一次性无菌注射器(5 mL)。
样品:鼻炎康胶囊1批次若干瓶(仙桃市第一人民医院制剂室制剂产品,0.4 g×20粒/瓶,批号20190203。
2 方法
2.1 色谱条件
色谱柱为Diamonsil C18色谱柱,规格:250 mm×4.6 mm/5 μm;流动相为甲醇:水(55∶45);检测波长300 nm;流速1.0 mL/min;柱温40 ℃;进样量10 μL,理论塔板数按欧前胡素计算不得低于3 000。
2.2 溶液的配制
2.2.1 对照品溶液的制备 精密称取欧前胡素对照品0.020 8 g于10 mL容量瓶中,加甲醇溶解并稀释至刻度,摇匀,作为对照品储备液(2.080 mg/mL)。分别精密量取上述对照品储备液0.8、2 mL于50 mL容量瓶中,加甲醇稀释至刻度,作为对照品中间液(33.28、83.2 g/mL),分别精密量取上述83.20 μg/mL对照品中间液1.25、2.50、5.00 mL于50 mL的容量瓶,加甲醇稀释至刻度,制成2.080、4.160、8.320 g/mL系列浓度梯度工作液。
2.2.2 供试品溶液的制备 取本品5粒,精密称定内容物重量,置于50 mL容量瓶中,加甲醇45 mL,超声处理60 min,放冷,加甲醇至刻度,摇匀,定量滤纸过滤,取续滤液适量,用0.45 μm有机相滤膜过滤,滤液用进样瓶收集,上机备用。
3 方法的验证与确认
3.1 系统适应性分析
分别精密吸取上述“2.2.1”项对照品溶液及“2.2.2”项供试品溶液各10 μL,按“2.1”项色谱条件分析,欧前胡素对照品及鼻炎康胶囊供试品欧前胡素色谱见图1(1号图谱为供试品图谱,2号图谱为对照品图谱)。结果显示,在保留时间32.8 min处,对照品与供试品均出现一色谱峰,出峰时间高度重叠,峰形无明显拖尾或前沿(拖尾因子1.01),且供试品欧前胡素峰周围基线平整,无明显噪音或杂峰干扰,分离度5.29,理论塔板数85 496。结果表明,采用上述“2.1”项HPLC分离方法能够有效分离鼻炎康胶囊中的欧前胡素成分。
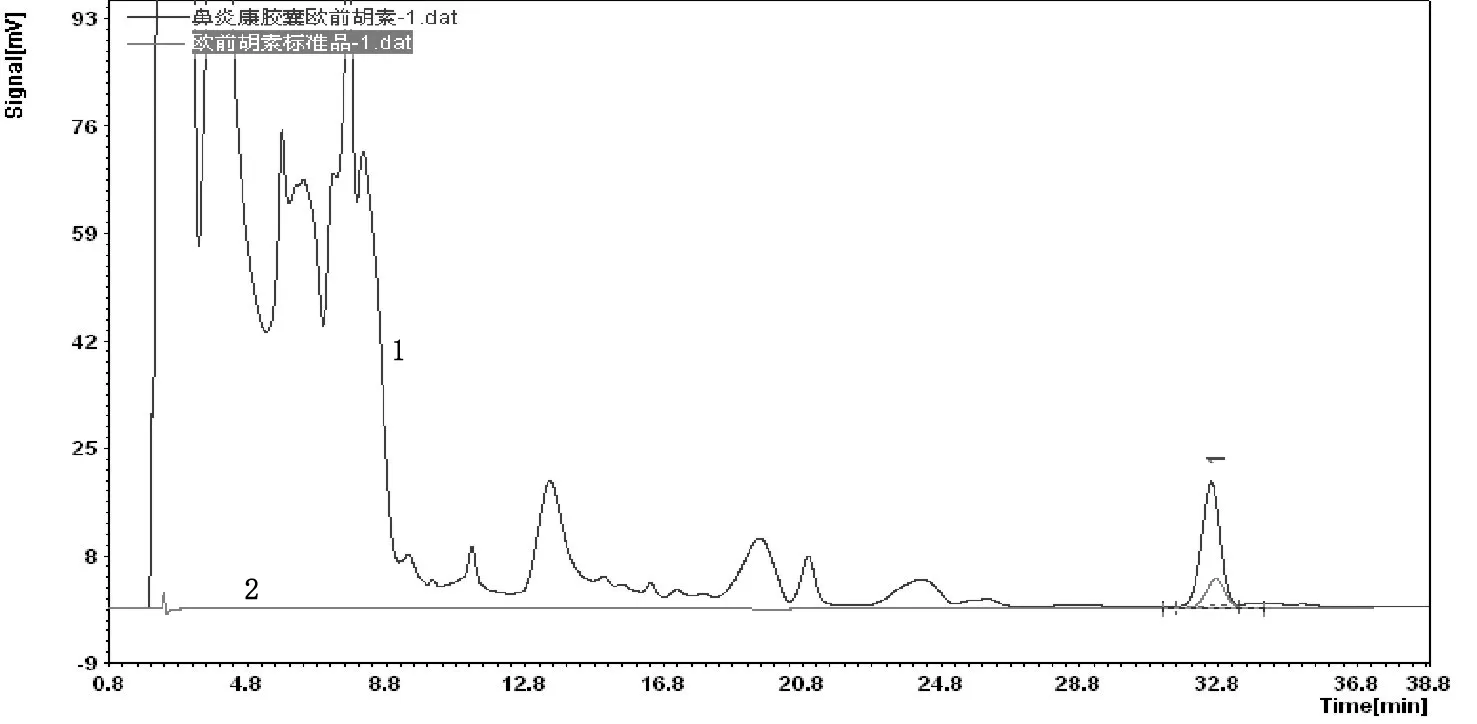
图1 欧前胡素对照品与鼻炎康胶囊供试品图谱
3.2 空白分析
3.2.1 标样空白 按以上“2.2.1”项所述,以超纯水替代欧前胡素对照品配制标准样品空白,按以上“2.1”项所述色谱条件进样,得到标准样品空白图谱。如图2所示(1号图谱为对照品图谱,2号图谱为标样空白图谱),标准样品空白基线平整,噪音0.02 mV,漂移0.11 mV/30 min,图谱无杂质峰出现。结果表明,对照品配制所用试剂对目标峰无干扰。
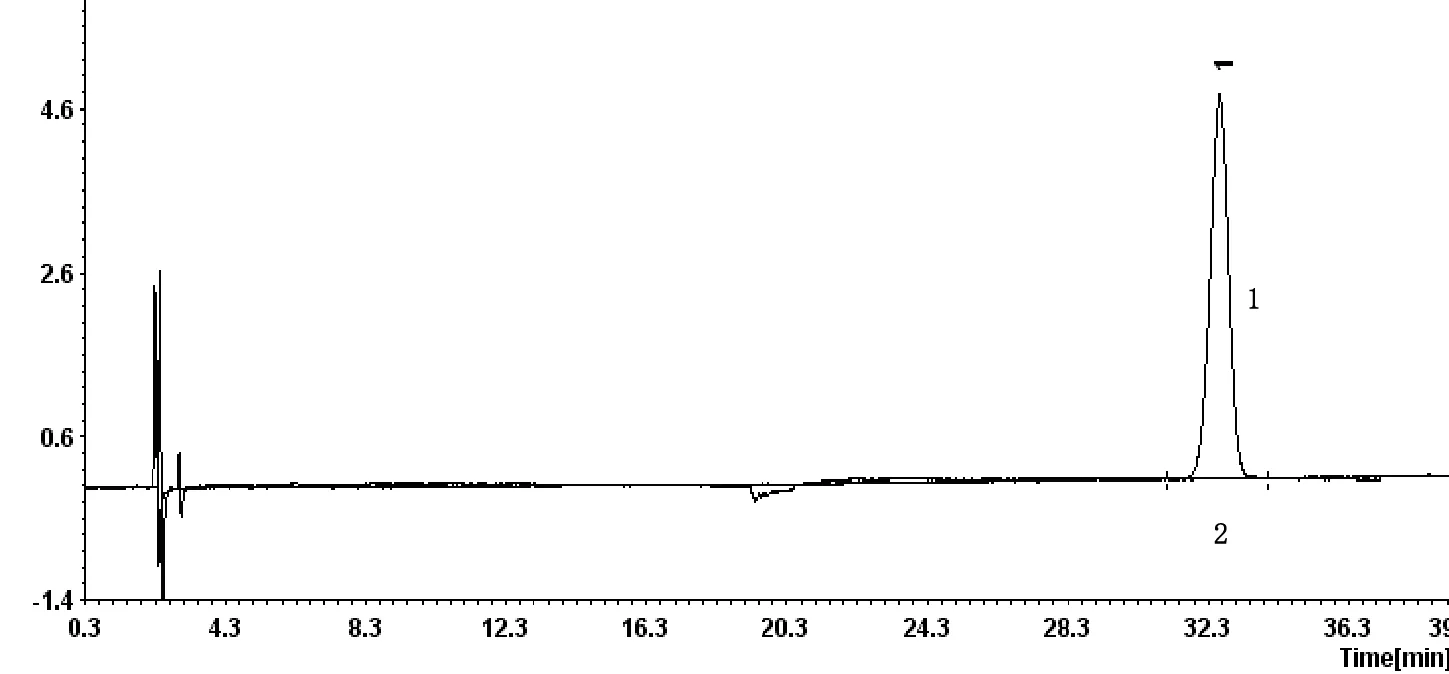
图2 标样空白/对照品图谱
3.2.2 试剂空白 按以上“2.2.2”项所述,以纯水替代鼻炎康胶囊供试品配制试剂空白,按以上“2.1”项所述色谱条件进样,得到试剂空白图谱。如图3所示(1号图谱为对照品图谱,2号图谱为试剂空白图谱),试剂空白在出峰时间32.8 min附近无干扰峰出现。结果表明,供试品前处理所用器皿和试剂未对目标峰产生干扰。
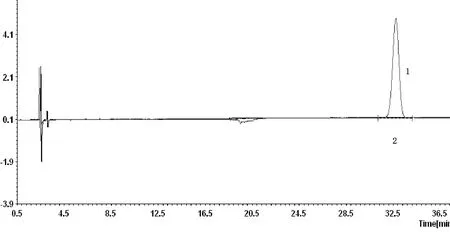
图3 试剂空白/对照品图谱
3.2.3 样品空白 按以上“2.2.2”项所述,以在制剂工艺中不添加白芷原药材(其余制剂工艺不变)所生产的胶囊替代正常制剂工艺生产的该批次鼻炎康胶囊作为供试品制备样品空白,按以上“2.1”项所述色谱条件进样,得到样品空白图谱。如图4所示(1号图谱为对照品图谱,2号图谱为样品空白图谱),样品空白在出峰时间32.8 min附近基线平整,无干扰峰出现。
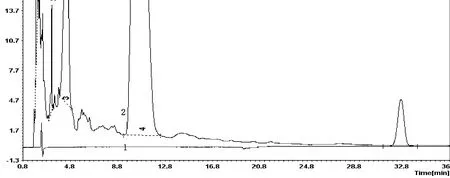
图4 样品空白/对照品图谱
3.2.4 结论 本次实验所用试剂、器皿以及鼻炎康胶囊内除白芷外的基质未在欧前胡素目标峰附近产生干扰,结合峰形判断,在32.8 min出现的峰为单一组分峰,组分物质为欧前胡素。
3.3 线性关系
按以上“2.2.1”项所述,分别配置浓度为2.080、4.160、8.320、33.28、83.20 μg/mL系列梯度工作液,并按以上“2.1”项所述色谱条件依次进样。在保留时间32.8 min处,出现峰面积与进样浓度呈线性相关的色谱峰组,该峰即为欧前胡素目标峰。以峰面积A为纵坐标(Y),以对照品浓度C为横坐标(X),绘制标准曲线,进行线性回归分析,得回归方程为A=20.308C+8.818 3(R2=0.999 8),如图5所示。结果表明,欧前胡素在该分析条件下,在2.080~83.20 μg/mL浓度范围内,其峰面积与其浓度线性相关性良好,满足定量要求,如表1所示。
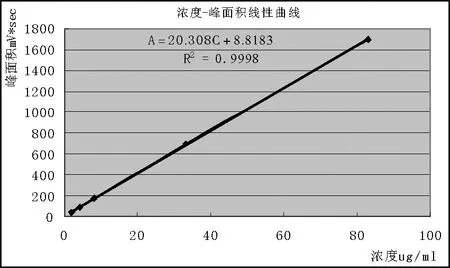
图5 欧前胡素浓度-峰面积曲线
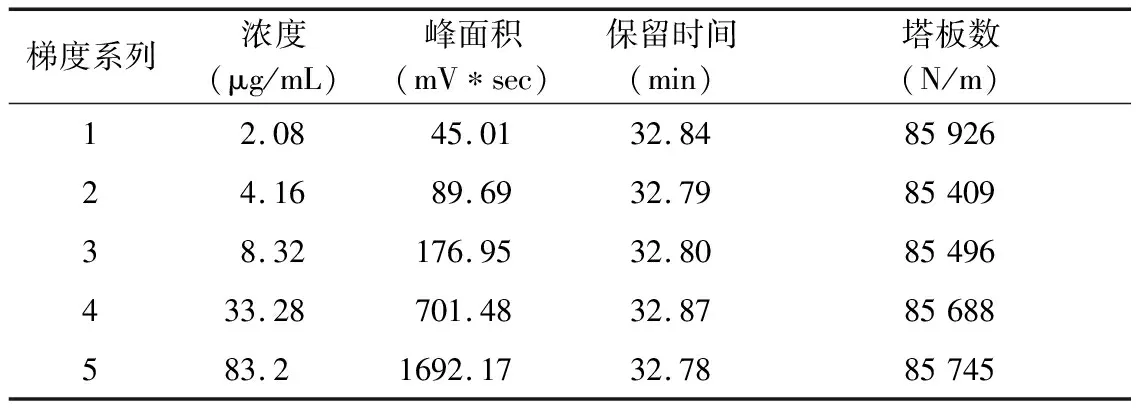
表1 欧前胡素浓度-峰面积曲线
3.4 精密度实验
精密度的评价标准参考Horwitz方程[5]:CV=2(1-0.5lgw),其中CV为变异系数,w为质量分数,用10的幂次指数表示,例如含量为1 mg/kg时,w=10-6。本次供试品鼻炎康胶囊中欧前胡素含量约为0.1%,相对标准偏差应小于3.7%。重复性标准暂定为该标准的1/3,即重复性相对标准偏差应小于1.2%,期间再现性相对标准偏差应小于3.7%。
3.4.1 重复性 按以上“2.2.2”项所述操作,制得一个供试品溶液重复进样6次,数据如表2所示。结果表明,在重复性条件下,样品、方法、仪器重复性良好,峰面积RSD=0.05%<1.2%目标值。保留时间无漂移现象,证明甲醇-水(55∶45)的流动相在分离体系中容易达到平衡且系统稳定性良好。
3.4.2 期间再现性 取同批次鼻炎康胶囊若干粒,取出内容物混匀,每次精密称定2.000 g,共6次,置于50 mL容量瓶中,其后按以上“2.2.2”项所述操作,共制得6个供试品,每个样品进样两次,峰面积取平均值。以上6次实验由6名不同质检员分别在6周内每周重复一次完成,实验设计见表3。结果如表4所示,期间再现性RSD=0.78%<3.7%,符合要求。即该方法在本实验室环境下,具有一定的人员和时间再现性。
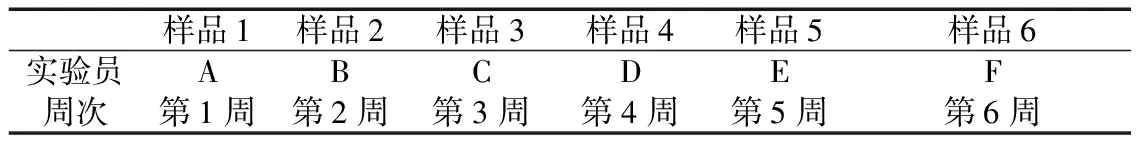
表3 期间再现性实验设计
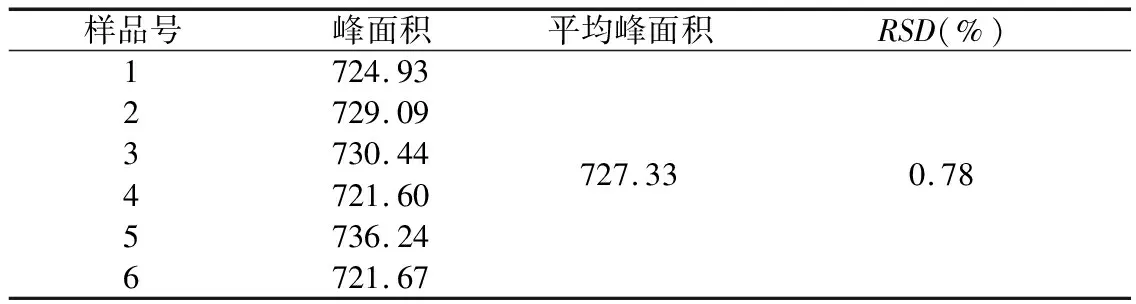
表4 重复性数据
3.5 检出限和定量限
本法未做检出限和定量限相关系统性分析。供试品鼻炎康胶囊中欧前胡素含量约为0.1%(以内容物计),按照称样量2 g,定容体积50 mL,稀释倍数为1条件处理,上机浓度约为30 mg/kg,在线性范围内。本法按标准曲线最低点暂定为定量下限,即LOQ=50 mg/kg,LOD=15 mg/kg(按定量限1/3计算)。该数据仅供参考,在没有明显基质噪音干扰的情况下,实际检出限和定量限应显著低于该拟定值,不同的供试品基质具有不同的噪音水平,所得结果不同,不具有普适性。
3.6 稳定性实验
3.6.1 样品稳定性 鼻炎康胶囊作为仙桃市第一人民医院制剂产品,保质期为6个月,储存条件为阴凉避光。按照该条件对同一批次的鼻炎康胶囊留样,由同一名实验员每月定期进行欧前胡素含量稳定性测试跟踪,每次实验进行3平行操作,含量取平均值。如表5所示,结果表明,在保质期内,鼻炎康胶囊中欧前胡素含量未随时间推移出现显著的趋势性变化。即鼻炎康胶囊样品在有效期内具有稳定性。

表5 鼻炎康样品稳定性跟踪
3.6.2 样品处理液稳定性 取同一批次鼻炎康胶囊,按以上“2.2.2”项操作,得上机液,分别封装于若干样品瓶中,常温避光保存。按以上“2.1”项所述间隔一定时间重复进样,每次进样2次,取峰面积平均值,进行稳定性跟踪分析,结果如表6 所示。供试品处理液以甲醇为溶剂,在密封条件下,48 h内稳定性良好。稳定性试验第3天,处理液出现浑浊,未进行上机测试。因此,建议同一批次检验工作在2天内完成。
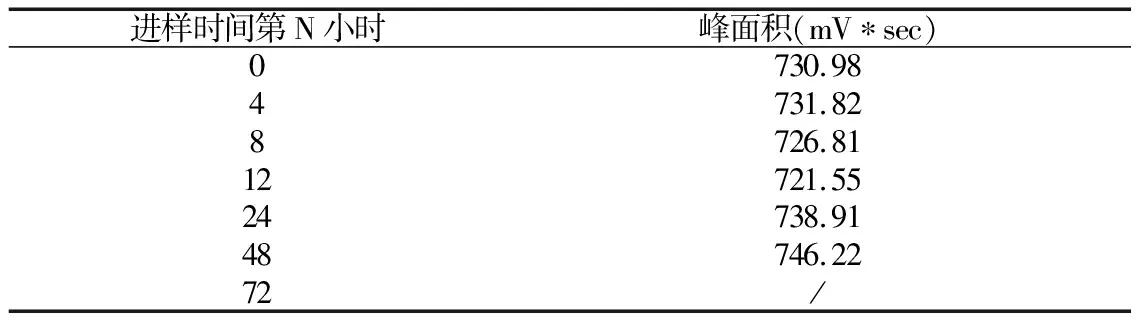
表6 处理液稳定性跟踪
3.6.3 标准溶液稳定性 按以上“2.2.1”项所述,制备浓度为8.320 μg/mL对照品溶液,分装于若干样品瓶中,分别冷冻、冷藏和常温保存,定期上机检测(上机前恢复至室温),每个样品进样3次,记录峰面积取平均值,实验设计及结果见表7。
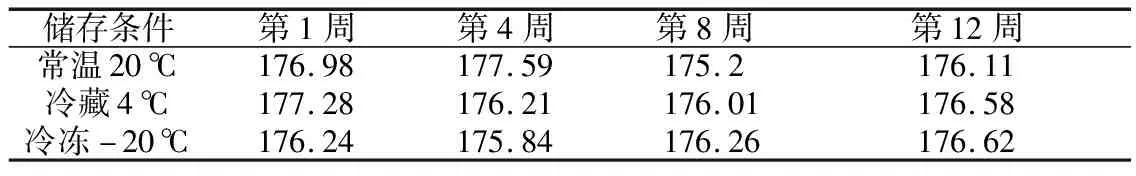
表7 标准溶液稳定性跟踪
结果表明,三种储存条件下的欧前胡素对照品峰面积均未随时间出现趋势性变化。在密封条件下,欧前胡素标准品以甲醇为溶剂,在常温、冷藏和冷冻温度下均具有较好的稳定性,经实验证明的有效期可达3个月。
3.7 准确性
由于没有相应的市售鼻炎康基质质控样品,本次准确性评价采用回收率测试。
取同批次鼻炎康胶囊若干粒,取出内容物混匀,每次精密称定2.000 g,从置于50 mL容量瓶中起,按以上“2.2.2”项所述操作,测定内容物欧前胡素本底含量,重复6次取平均值,结果以mg/g计。
另精密称定内容物2.000 g,置于50 mL容量瓶中,加入一定量欧前胡素对照品,按以上“2.2.2”项所述操作,测定加标样品欧前胡素含量,计算加标回收率。加标浓度为本底含量的1/3(因本法中欧前胡素有检出,且含量较高,因此未进行检出限加标回收测试),加标方式为欧前胡素储备液2.080 mg/mL×0.25 mL。每个加标浓度重复6次,实验结果见表8。
在本底含量1/3处进行加标回收测试,回收率均值为99.1%,标准偏差1.09%,本次回收率的测量不确定度按3倍标准偏差计算可得U=3.27%,即回收率范围为95.83%~102.37%,与100%没有显著性差异。该结果表明,本法不存在系统性偏差,准确性符合要求。

表8 加标回收率
4 讨论与分析
4.1 检测波长的选择
采用紫外全波长扫描,欧前胡素供试品溶液在300 nm处有最大吸收,灵敏度达到定量要求,因此将检测器波长定为300 nm。
4.2 溶剂的选择
欧前胡素不溶于水,易溶于弱极性有机溶剂,在甲醇中溶解性良好,以甲醇为提取溶剂的提取效果优于乙醇[6]。本法样品前处理和对照品均以甲醇为溶媒,甲醇不仅可以充分有效萃取鼻炎康胶囊内容物中的欧前胡素(超声萃取1 h后萃取液中欧前胡素含量不再增加,表明内容物中欧前胡素已萃取完全[7]),还能起到沉淀剂作用,沉淀难溶性杂质。经甲醇萃取后的续滤液为黄色澄明液体。对于部分基质颗粒较大供试品,建议先研磨过20目筛后再处理[8],以增加萃取效率,也可采取冷凝回流法[9]或适当延长超声萃取时间。本法萃取液的体积使用量为50 mL,一般使用6倍量体积的甲醇萃取效果较好[10],需综合考虑上机浓度等因素。
4.3 流动相的选择
本法采用甲醇∶水=55∶45作为流动相,出峰时间32.8 min,理论塔板数符合要求,与相邻色谱峰有效分离,无杂质峰干扰,如图6所示。
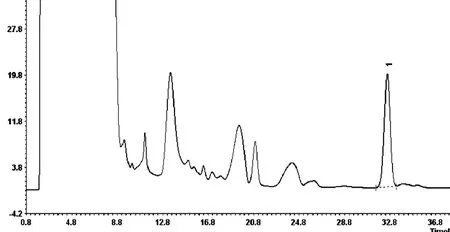
图6 鼻炎康胶囊欧前胡素色谱
鼻炎康为复方制剂,七味药材经甲醇萃取后处理液组分复杂,杂质峰较多,从图谱可以看出,在26 min前杂质峰出现频繁。欧前胡素为弱极性物质,提高甲醇比例后在流动相中的分配系数增加,保留时间缩短,对pH不敏感。甲醇比例每提高1%,保留时间随之减少5%。本法甲醇比例可以适当提高,以缩短出峰时间,减小峰展宽,但比例不宜超过60∶40,过高甲醇比例可能导致分离度降低,甚至杂质峰干扰。相反的,降低甲醇比例可以有效避免极性相对较高的杂质组分干扰,然而保留时间延长将导致峰展宽,基线噪音干扰,以及分析时间增加等问题。
4.4 鼻炎康胶囊的质量评价标准
鼻炎康胶囊是临床常用的用于治疗慢性鼻炎和鼻窦炎的药物,在《湖北省医疗机构制剂规范(2011年版)》中,其质量标准尚只有白芷的薄层鉴别[11],然而白芷药材的TLC鉴别易受复方制剂中其他药材的干扰,检测结果不明显。且单纯的鉴别检测并不能保证药品的有效性和安全性。有文献表明,欧前胡素摄入过量将导致神经系统、心血管系统和呼吸系统毒性,并具有给药部位的局部刺激性[12]。建立可行有效的含量测定方法是当前鼻炎康制剂质量控制的当务之急。
本文探索的鼻炎康胶囊中欧前胡素含量测定高效液相色谱法,经过系统的方法学研究,具有良好的精密度、准确性和稳定性,且简单易行,是对鼻炎康胶囊质量标准的有效补充,为鼻炎康胶囊的质量评价奠定基础。
