不同焦油释放量卷烟全烟气气-液界面暴露致细胞毒性、炎症因子释放和细胞凋亡的研究
2020-06-04华辰凤赵俊伟尚平平樊美娟谢复炜
华辰凤,赵俊伟,尚平平,樊美娟,谢复炜,李 翔*
(中国烟草总公司郑州烟草研究院,河南郑州 450001)
卷烟烟气是一种由气相部分和粒相部分组成的复杂气溶胶。其中,气相物质占92%,粒相物质占8%。据报道,已确定的烟气成分有近5 000多种,其中国际癌症研究机构列出卷烟烟气中可以致癌化合物69种[1],公共卫生组织认为可能导致烟草相关疾病的烟气成分100多种。目前,对卷烟烟气体外毒性评价研究多采用烟气中单一成分如4-甲基亚硝胺基-1-3-吡啶基-1-丁酮[4-(N-nitrosomethylamino)-1-(3-pyridyl)butan-1-one,NNK][2]、苯并[a]芘、镉等[3]或烟气总粒相物进行检测和研究[4-5],不符合人体吸烟时的正常生理过程,难以全面真实地反映烟气混合物体系的生物学效应。全烟气气-液界面系统是一种集细胞气-液界面培养和卷烟主流烟气暴露为一体的烟气以气溶胶形式直接暴露细胞的系统,具体是利用多孔膜细胞培养技术将细胞培养于微孔膜层,并以微孔膜为分界线,使生长于该膜上的细胞处于上方为气体、下方为液体的环境;且将吸烟机产生的主流烟气直接传送至该系统的细胞气-液界面的气体层,以实现卷烟烟气(包括粒相成分和气相成分)对人呼吸系统细胞暴露的实际状况模拟,具有可以实时、全面反映卷烟烟气的生物学效应的优点[6-7]。由于吸烟直接暴露作用靶点是人呼吸系统,本研究选用人支气管上皮细胞Beas-2b这种被广泛用于体外研究与呼吸系统疾病相关研究的细胞模型,利用全烟气气-液界面系统暴露染毒Beas-2b细胞模拟人体肺支气管暴露烟气环境,探讨两种焦油释放量卷烟对Beas-2b细胞引起的细胞毒性、炎症因子释放水平和细胞凋亡情况,初步比较不同焦油释放量卷烟对细胞的毒性效应。
1 材料与方法
1.1 细胞和受试物
Beas-2b购自美国模式培养物集存库(American type culture collection,ATCC);国际标准化组织(International Organization for Standardization,ISO)规定抽吸方式下焦油释放量分别为每支9.4 mg的卷烟样品1和每支14.0 mg的卷烟样品2。
1.2 主要试剂和仪器
Bronchial Epithelial Cell Growth Medium BulletKitTM(BEGMTM)购自美国Lonza公司;中性红染料购自美国Sigma公司;Annexin V-FITC细胞凋亡检测试剂盒购自碧云天公司;人CXCL8/IL-8、CXCL6/IL-6 Quantikine ELISA试剂盒购自美国R&D公司。SWCJ-2FD超净工作台购自江苏省苏州安泰空气技术有限公司;10 cm培养皿、96孔板、12 mm插入式细胞培养皿(Transwell)均购自美国Corning Costar公司;SpectraMax 190酶标仪购自美国MD公司;VITROCELL®系统购自德国Vitrocell公司。
1.3 细胞培养
处于指数期的Beas-2b细胞经胰酶消化,制成细胞悬液,接种于Transwell小室,每个小室1×105个细胞,在37℃、CO2体积分数为5%条件下于BEGM培养基中培养24 h,随后进行烟气暴露实验。
1.4 全烟气暴露染毒
使用VITROCELL系统进行卷烟全烟气气-液界面暴露实验。该系统由VC10吸烟机、烟气稀释系统和烟气暴露装置组成。移除Transwell小室内液体,将小室置于烟气暴露装置中,每个烟气暴露装置中置3个小室。卷烟于ISO规定抽吸参数下抽吸(相关参数见表1),吸烟机抽吸产生的主流烟气分别与不同流速的洁净空气(7.50、3.00、1.00、0.25 L/min)混合稀释后以恒定流速进入烟气暴露装置中,每个染毒组抽吸2支卷烟;卷烟对照组细胞暴露于洁净空气中。Transwell小室微孔膜上层为烟气或洁净空气环境,下层为培养液,生长在微孔膜上的细胞处于气-液交界面处,于不同稀释比例的卷烟烟气或洁净空气中暴露培养;烟气剂量以进入到烟气暴露装置中的卷烟主流烟气占产生的卷烟主流烟气的百分比表示(单位为支),按下列公式[8]计算后,则洁净空气对照组染毒剂量为0支,处理组烟气剂量分别为0.12%支、0.27%支、0.57%支、1%支。


表1 全烟气暴露染毒相关参数
1.5 指标检测
全烟气暴露结束后,将Transwell小室转入12孔板中,每小室补0.5 mL培养基后,各组Beas-2b细胞于37℃、CO2体积分数为5%的条件下继续培养24 h,进行以下实验。吸去培养液,PBS洗一次,中性红试验按照企业标准检测细胞毒性。使用GraphPad Prism软件计算半数抑制浓度(IC50)。收集细胞培养上清液,试验按照人CXCL6/IL-6 Quantikine ELISA、人CXCL8/IL-8 Quantikine ELISA试剂盒提供步骤检测IL-6、IL-8水平。按照Annexin V-FITC/PI细胞凋亡检测试剂盒提供的步骤检测细胞凋亡水平。
1.6 统计分析
2 结果
2.1 样品卷烟全烟气气-液界面暴露对细胞存活率的影响
用卷烟样品1和样品2全烟气气-液界面暴露染毒Beas-2b细胞时,两种卷烟烟气对Beas-2b细胞的存活均有抑制作用且呈剂量-效应关系(图1),即随着染毒烟气剂量的不断增加,细胞存活率不断降低(P<0.05),其中样品1和样品2的卷烟烟气对Beas-2b细胞存活率的IC50值分别为(0.89±0.10)%支和(0.52±0.05)%支。且在相同0.57%支和1%支的烟气剂量下,样品2卷烟烟气染毒后的Beas-2b细胞存活率低于样品1卷烟烟气染毒的细胞存活率(P<0.05);在相同0.12%支和0.27%支的烟气剂量下,样品2卷烟烟气染毒后的Beas-2b细胞存活率与样品1卷烟烟气染毒细胞存活率间的差异无统计学意义(P>0.05)。
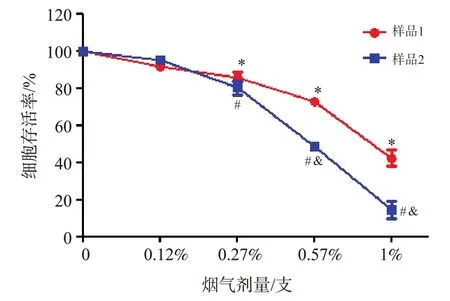
样品1卷烟烟气染毒组与洁净空气对照组相比,*P<0.05;样品2卷烟烟气染毒组与洁净空气对照组相比,#P<0.05;样品2卷烟烟气染毒组与样品1卷烟烟气染毒组相比,&P<0.05.图1 样品1和样品2卷烟烟气对Beas-2b细胞存活率的影响
2.2 样品卷烟全烟气气-液界面暴露对Beas-2b细胞IL-6、IL-8释放水平的影响
由2.1实验结果,选取样品1和样品2卷烟烟气引起Beas-2b细胞85%细胞存活的染毒剂量对Beas-2b细胞进行全烟气气-液界面暴露,研究两种卷烟样品烟气对Beas-2b细胞IL-6、IL-8释放水平的影响。即样品1、样品2烟气暴露剂量均为0.12%支。ELISA法检测IL-6、IL-8表达水平结果见图2,与洁净空气对照组相比,样品1、样品2烟气暴露剂量在0.12%支时,IL-6、IL-8释放水平显著增加(P<0.05);且在相同0.12%支烟气剂量下,样品2与样品1卷烟烟气引起的IL-6、IL-8炎症释放水平间差异无统计学意义(P>0.05)。

A:各组Beas-2b细胞IL-6释放水平;B:各组Beas-2b细胞IL-8释放水平.样品1卷烟烟气染毒组与洁净空气对照组相比,*P<0.05;样品2卷烟烟气染毒组与洁净空气对照组相比,#P<0.05.图2 样品1和样品2卷烟烟气对Beas-2b细胞IL-6、IL-8释放水平的影响
2.3 样品卷烟全烟气气-液界面暴露对Beas-2b细胞凋亡的影响
由2.1实验结果,选取样品1和样品2卷烟烟气引起Beas-2b细胞85%细胞存活的染毒剂量对Beas-2b细胞进行全烟气气-液界面暴露,研究两种卷烟样品烟气对Beas-2b细胞凋亡的影响。即样品1、样品2烟气暴露剂量均为0.12%支。Annexin V-FITC/PI流式细胞分析法检测细胞凋亡水平结果见图3,与对应洁净空气对照组相比,样品1、样品2烟气暴露剂量在0.12%支时,细胞凋亡率显著增加(P<0.05);且在相同0.12%支烟气剂量下,样品2与样品1引起的细胞凋亡率间的差异无统计学意义(P>0.05)。

A:流式细胞术检测洁净空气对照组Beas-2b细胞凋亡情况的散点图;B:流式细胞术检测样品1卷烟烟气染毒组Beas-2b细胞凋亡情况的散点图;C:流式细胞术检测样品2卷烟烟气染毒组Beas-2b细胞凋亡情况的散点图;D:各组Beas-2b细胞凋亡率统计分析.样品1卷烟烟气染毒组与洁净空气对照组相比,*P<0.05;样品2卷烟烟气染毒组与洁净空气对照组相比,#P<0.05.图3 样品1和样品2卷烟烟气对Beas-2b细胞凋亡的影响
3 讨论
呼吸道受到外界刺激时,可引起呼吸道细胞损伤、细胞凋亡和炎症因子如IL-6、IL-8等分泌参与自身免疫、炎症过程[4]。本研究中,利用VITROCELL气-液界面暴露系统将人支气管上皮细胞Beas-2b暴露于两种不同焦油释放量的卷烟产生的烟气中以模拟人体暴露烟气环境,结果发现样品1、样品2卷烟烟气均可诱导Beas-2b细胞毒性,IL-6、IL-8的分泌和细胞凋亡;这一研究结果与文献[9-13]研究结果卷烟烟气可引起人支气管上皮细胞细胞存活率降低,肺细胞凋亡及促炎细胞因子IL-6、IL-8释放增加一致。
焦油是卷烟烟气中许多物质混合而成的粒相物,其包括醛类[14]、砷[15]、NNK[16]和苯并[a]芘[17-18]等,研究表明,这些成分均可引起细胞存活率降低、引起支气管炎症和细胞凋亡等。且研究发现在降低卷烟焦油释放量的同时也降低了卷烟烟气中其他粒相成分[19]、气相成分如CO[20-21]和挥发性羰基物(甲醛、巴豆醛、乙醛)等有害成分的释放量[22]。因此,这可能是引起在相同0.57%、1%支烟气剂量下,样品1卷烟烟气致Beas-2b存活率小于样品2卷烟烟气的原因。另外,在0.12%支烟气剂量下,样品1卷烟烟气致Beas-2b存活率、引起的炎症因子释放水平和细胞凋亡水平与样品2卷烟烟气差异无统计学意义,这一结果可能是由于在相同该烟气剂量下,两种焦油释放量卷烟的焦油剂量差较低(0.12%支烟气剂量下,样品1烟气组和样品2烟气组换算焦油剂量分别为11.3和16.8μg,0.57%支烟气剂量下,样品1烟气组和样品2烟气组换算焦油剂量分别为53.6和79.8μg)引起的。事实上,烟气成分复杂,与卷烟配方、辅助材料和加工工艺等有关,另外卷烟烟气暴露引起细胞毒性、促炎和细胞凋亡机制还需进一步研究,在改变焦油释放量的同时烟气化学组成也发生了相应的变化,因此有关烟草制品烟气化学成分分析、烟气体外毒性机制测试及临床研究仍需进一步研究,以期为烟草制品的健康风险评估提供基础数据。
总之,本研究结果表明,两种不同焦油释放量卷烟样品均可引起细胞毒性、促炎症因子释放和细胞凋亡作用。在0.12%支的烟气剂量范围内,两种卷烟致细胞毒性、炎症因子释放水平和细胞凋亡率并无显著性差异,在0.57%支~1%支烟气剂量范围内,具有高焦油释放量的卷烟烟气引起的细胞毒性强于低焦油释放量的卷烟烟气。
