何首乌、虎杖、大黄水提物中游离蒽醌含量的测定及对人正常肝细胞的毒性作用
2020-06-04王呈谕刘晓璇李轶群李登科孙震晓
王呈谕,刘晓璇,李轶群,李登科,孙震晓*
(北京中医药大学生命科学学院,北京 102488)
何首乌(Polygoni Multiflori Radix)、虎杖(Polygoni Cuspidati Rhizoma et Radix)、大黄(Rhei Radix et Rhizoma)为临床常用中药[1],近年来其在临床及动物试验中多有致肝损伤报道,如何首乌与制何首乌及二者相关制剂可引起患者肝损害[2],临床调研发现含虎杖复方制剂可致肝功能异常[3],动物实验表明大黄可致老年大鼠肝细胞坏死及轻度胆道增生[4]。前期研究表明,何首乌和大黄的肝毒性可能与其含有的游离蒽醌(如大黄素、大黄素甲醚、芦荟大黄素、大黄酸、大黄酚等)有关[5-6]。3种中药均含游离蒽醌,虽然所含游离蒽醌种类及含量不同,但游离蒽醌在体内可以相互转化[7],因而比较3种药材游离蒽醌含量与其肝细胞毒性的关系可为阐明3种中药可能的肝毒性物质基础及机制提供思路。
游离蒽醌含量测定常采用高效液相色谱色谱法(high performance liquid chromatography,HPLC)[8]。HepaRG细胞为人正常肝祖细胞,分离于慢性丙肝患者肝组织,可在体外长期继代培养,一定条件下能分化为明显的肝细胞形态和胆管样结构,能表达正常肝细胞相关的Ⅰ相和Ⅱ相药物代谢酶,如CYP450及UGT1A1等,是体外研究药物肝毒性的良好工具[9-11]。本研究主要通过比较3种中药水提物中游离蒽醌含量及其对人正常肝细胞的毒性作用探究游离蒽醌与3种中药肝细胞毒性的关系。
1 材料与方法
1.1 药品与试剂
实验用何首乌(产地湖北,批号01106600)、大黄(产地甘肃,批号401004095)、虎杖(产地浙江,批号401004461)饮片均购自北京同仁堂(亳州)饮片有限责任公司,经北京中医药大学中药学院刘春生教授鉴定,均为正品。大黄素(批号wkq16071004)、大黄素甲醚(批号wkq16070403)、芦荟大黄素(批号140827)、大黄酸(批号140526)、大黄酚(批号140219)均购买于四川省维科奇生物科技有限公司(各成分HPLC检验含量均≥98%)。甲醇(色谱纯)购自Fisher公司,液相用水来源于杭州娃哈哈集团有限公司。RPMI 1640培养基购自Gibco公司,胎牛血清购自Visual Technologies Inc,胰蛋白酶、乙二胺四乙酸二钠(EDTA-Na2)购自北京拜尔迪生物科技有限公司,甲醇(分析纯)、磷酸、无水乙醇、二氯甲烷、石油醚、乙酸乙酯、NaHCO3、NaCl、KCl、Na2HPO4·12H2O、KH2PO4等均购自北京化工厂,噻唑兰(methylthiazolyldiphenyl-tetrazolium bromide,MTT)购自北京兰博利德生物技术有限公司,AnnexinⅤ-FITC/PI双染细胞凋亡检测试剂盒购自江苏凯基生物技术股份有限公司。
1.2 仪器
高效液相色谱仪,购于Waters公司;ME204E/02分析天平,购于梅特勒-托利多仪器(上海)有限公司;EPOCH酶标仪,购于美国伯腾仪器有限公司;SCIENTZ-10N冷冻干燥机,购于宁波新芝生物科技股份有限公司;A00-1-1102流式细胞仪,购于贝克曼库尔特有限公司。
1.3 细胞株
HepaRG人肝祖细胞,购自中国科学院上海生命科学院细胞资源中心。
1.4 中药水提物的制备
称量3种受试饮片,加入圆底烧瓶中。第1次取10倍量超纯水,煎煮2 h,药液过滤留存;第2次取8倍量超纯水,煎煮1.5 h,药液滤出后与第1次留存药液合并。
使用大容量旋转蒸发仪和恒温水浴去除多余水分。放至室温,-20℃预冻1 d,-80℃预冻1 d,置于真空冷冻干燥机进行干燥后,研磨成细粉,避光干燥保存。
1.5 溶液配制
1.5.1 HPLC供试品溶液制备 分别称取上述何首乌水提物粉末0.203 9 g,虎杖水提物粉末0.203 1 g,大黄水提物粉末0.204 6 g,各加甲醇25 mL后称重,超声溶解40 min后,用甲醇补充至原始质量,以0.45μm滤膜过滤,即得供试品溶液。
1.5.2 HPLC标准品溶液制备 称取各标准品(芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚),加甲醇溶解定容,分别得到浓度为360、213、404、418、456μg/mL的标准品溶液。分别吸取上述标准品溶液各1.0 mL置于同一10 mL容量瓶中,加甲醇定容,摇匀,以0.45μm滤膜过滤,制成混合标准品溶液。
1.5.3 细胞实验药液制备 称取1.4中得到的受试饮片水提物粉末,加RPMI 1640完全培养基超声溶解1 h,得浓度为6 mg/mL的水提物母液(水提物溶液浓度均以生药计),经0.45μm滤器过滤,再经0.22μm无菌滤器过滤后备用。细胞给药时,以RPMI 1640完全培养基梯度稀释水提物母液,得到浓度为1.0、1.5、2.0、2.5、3.0 mg/mL(均以生药计)的水提物药液,备用。
1.6 中药水提物中游离蒽醌含量测定
本研究采用HPLC法对3种中药水提物中的各游离蒽醌进行含量检测。
1.6.1 色谱条件 色谱柱:CAPCELL AK-C18(250×4.6 mm,5μm);流动相:甲醇(A),0.1%磷酸水溶液(B);检测器:UV检测器;检测波长:254 nm;流速:1 mL/min;进样体积:10μL;柱温:室温。梯度洗脱程序见表1。
1.6.2 线性关系考察 按梯度体积,各吸取上述标准品溶液5次于容量瓶中,各自加甲醇定容,摇匀,0.45μm滤膜过滤,备用。进样10μL,记录峰面积,以峰面积为纵坐标,标准品浓度为横坐标绘制标准曲线。
1.6.3 精密度 吸取供试品溶液10μL,连续进样6次,测定峰面积,计算各成分峰面积平均值及相对标准偏差(relative standard deviation,RSD)值。
1.6.4 稳定性 吸取供试品溶液,室温放置,分别于制备后0、2、4、8、12、24 h进样10μL,测定各成分峰面积,计算峰面积平均值及RSD值。
1.6.5 重复性 取同一批水提物粉末6份,按照1.5.1中所述方法制备供试品溶液,测定各成分含量,计算各成分含量平均值及RSD值。
1.6.6 加样回收率考察 称取已知各成分含量的各药材水提物6份,每份约0.1 g,分别添加各标准品溶液适量,按照1.5.1中所述方法制备供试品溶液。测定各成分峰面积,计算各成分含量和各成分的加样回收率及RSD值。
1.6.7 游离蒽醌含量测定 按照1.5.1中所述方法制备供试品溶液,单次进样10μL,测定各游离蒽醌峰面积,按标准曲线外标法计算各游离蒽醌的含量。
1.7 细胞培养
HepaRG细胞在含10%胎牛血清,1%双抗的RPMI 1640培养基中,于37℃、CO2体积分数为5%的条件下进行常规培养,取对数生长期细胞进行实验。
1.8 MTT法测定细胞活力
选取处于对数生长期的HepaRG细胞,使用0.25%的胰酶消化成单个细胞,使用培养基将细胞浓度调整为3×104个/mL。将细胞接种于96孔板,每孔100 μL,置于CO2培养箱中培养24 h。将培养液去除,加入培养基或不同浓度的各种中药水提物溶液(1.0、1.5、2.0、2.5、3.0 mg/mL),每组平行4孔,每孔150 μL(预实验测定各组pH值、渗透压均在正常范围以内),置于培养箱中培养48 h。弃去药液,加入MTT工作液(0.5 mg/mL),每孔100μL,置于培养箱中孵育4 h。弃去孵育液,每孔加入DMSO 150μL,溶解结晶,使用酶标仪在570 nm波长下检测吸光度D(570),计算细胞存活率。

1.9 AnnexinⅤ/PI双染法测定细胞凋亡
选取处于对数生长期的HepaRG细胞,使用0.25%无EDTA的胰酶消化成单个细胞,使用培养基将细胞密度调整为8×104个/mL。将细胞接种于6孔板,置于培养箱中培养24 h。将培养液去除,加入培养基或不同浓度的各种中药水提物溶液(1.5、2.0、2.5mg/mL),每组平行3孔,每孔3 mL,置于CO2培养箱中培养48 h。收集全细胞至离心管,2 000 r/min,离心2 min;用PBS洗涤细胞两次(2 000 r/min,离心2 min);按照试剂盒说明书加入结合缓冲液500μL,重悬细胞;加入5μL AnnexinⅤ-FITC混匀后,加入5 μL碘化丙锭混匀;室温条件下,避光孵育5~15 min;1 h内使用流式细胞仪检测荧光强度。在仪器上,参考对照组散点图,可将实验组分为正常细胞、早期凋亡细胞、晚期凋亡细胞和坏死细胞,并分别显示各类细胞所占细胞总量的百分比。
1.10 统计学分析
实验数据均采用SPSS 19.0统计软件进行回归分析,以表示。在细胞活力与凋亡程度方面,对照组和实验组间样本差异的分析采用单因素方差分析(one-way ANOVA)。
2 结果
2.1 方法学考察
2.1.1 标准曲线 按上述色谱条件测定峰面积,以峰面积为纵坐标,标准品浓度为横坐标,绘制标准曲线,计算回归方程见表2。
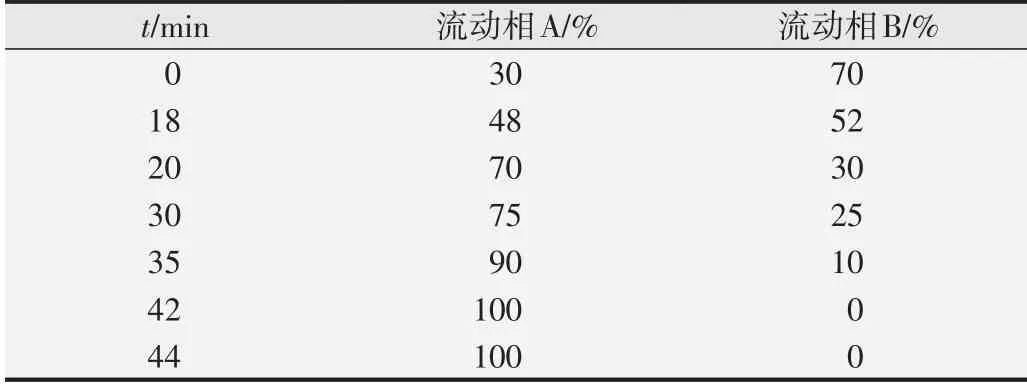
表1 梯度洗脱程序
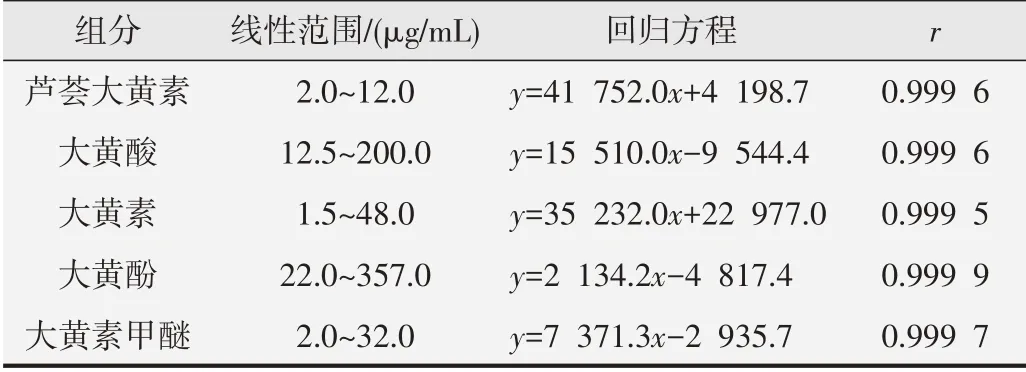
表2 线性关系测定结果
2.1.2 精密度考察 何首乌中大黄素和大黄素甲醚峰面积值的RSD分别为2.67%和1.32%;虎杖中大黄素和大黄素甲醚峰面积值的RSD分别为2.73%和2.95%;大黄中芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚峰面积值的RSD分别为1.29%、1.72%、2.36%、1.54%和0.66%。所有RSD值均小于3.0%(n=5),表明方法的精密度良好,符合实验要求。
2.1.3 稳定性考察 何首乌中大黄素和大黄素甲醚峰面积值的RSD分别为2.98%和2.53%;虎杖中大黄素和大黄素甲醚峰面积值的RSD分别为1.20%和0.97%;大黄中芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚峰面积值的RSD分别为2.96%、1.10%、2.73%、2.87%和2.68%。所得的所有RSD值均小于3.0%(n=5),表明供试品溶液在室温放置24 h之内基本稳定。
2.1.4 重复性考察 何首乌中大黄素和大黄素甲醚峰面积值的RSD分别为2.81%和1.29%;虎杖中大黄素和大黄素甲醚峰面积值的RSD分别为1.88%和1.92%,;大黄中芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚峰面积值的RSD分别为2.31%、1.42%、2.91%、2.71%和1.67%。所得RSD值均小于3.0%(n=5),表明该方法的重复性良好,3种药材水提物中各成分测定含量稳定。
2.1.5 加样回收率考察 按上述进行加样回收率的考察,结果见表3,3种药材水提物中各游离蒽醌加样回收率均处于95%~105%之间,RSD值均小于3.0%(n=5),表明该方法的回收率良好。
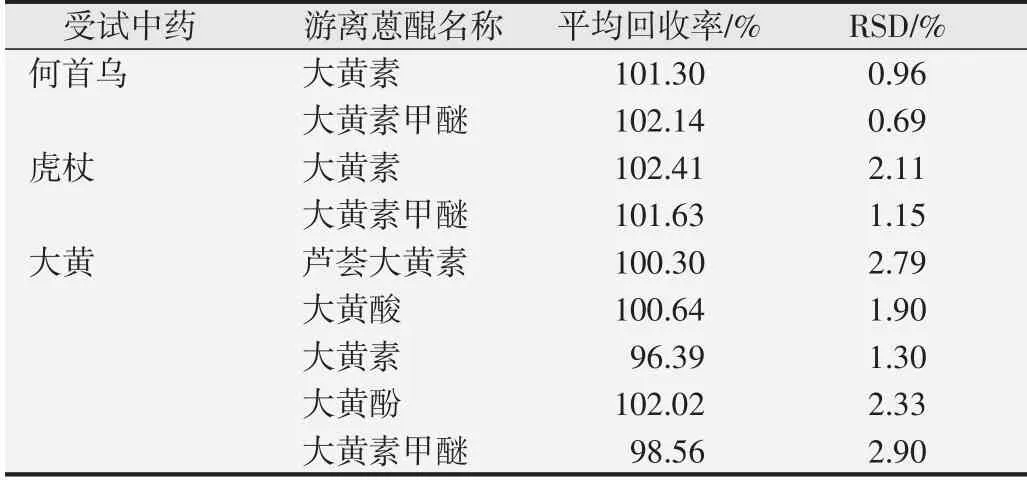
表3 3种中药水提物加样回收率考察结果
2.2 何首乌、虎杖、大黄游离蒽醌含量测定
3种中药水提物及生药中游离蒽醌含量见表4,何首乌为0.229%,虎杖为0.545%,大黄为2.593%,各中药水提物中5种主要游离蒽醌总含量顺序:何首乌<虎杖<大黄。
2.3 中药饮片水提物对体外培养HepaRG细胞活力的影响
3种中药水提物对HepaRG细胞存活率的影响见图1,何首乌在2.0、2.5、3.0 mg/mL浓度下表现出明显的抑制细胞活力的作用;虎杖在1.5、2.0、2.5、3.0 mg/mL浓度下表现出显著的抑制作用;大黄在所设全部浓度1.0、1.5、2.0、2.5、3.0 mg/mL下均表现出显著的抑制作用,3种中药水提物对人正常肝细胞的抑制作用均成剂量依赖性,抑制作用顺序为何首乌<虎杖<大黄。除何首乌IC50值为3.17 mg/mL,在所设浓度范围之外,虎杖和大黄的均在所设浓度范围之内,分别为2.23、1.91 mg/mL。
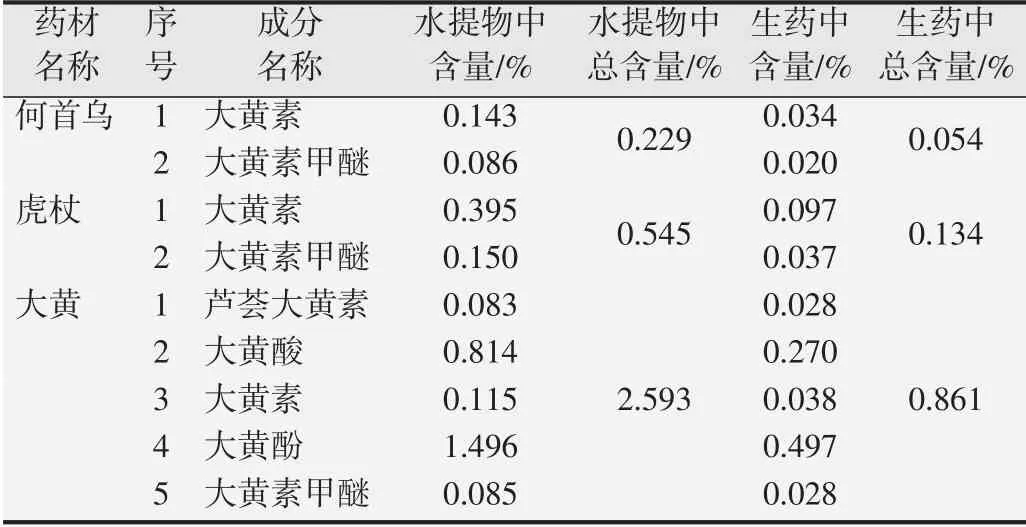
表4 3种中药水提物中游离蒽醌的含量
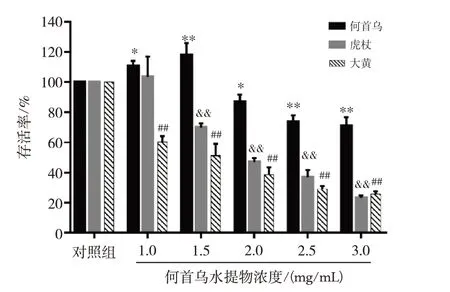
何首乌水提物各剂量组与对照组比较,*P<0.05,**P<0.01;虎杖水提物各剂量组与对照组比较,&&P<0.01;大黄水提物各剂量组与对照组比较,##P<0.01.图1 何首乌、虎杖、大黄水提物作用HepaRG细胞48 h后的细胞存活率
2.4 中药饮片水提物对体外培养HepaRG细胞凋亡的影响
3种中药饮片水提物对HepaRG细胞凋亡的影响见表5,在1.5、2.0、2.5 mg/mL浓度下,何首乌水提物诱导人正常肝细胞总凋亡率分别为(2.52±0.95)%、(7.23±0.12)%、(23.36±1.91)%,虎杖水提物分别为(15.47±2.49)%、(52.91±0.37)%、(74.4±0.76)%,大黄水提物分别为(56.24±3.08)%、(82.36±0.53)%、(85.67±0.31)%,与对照组总凋亡率(0.04+0.01)%相比,3种中药水提物均明显诱导人正常肝细胞凋亡,各浓度下对细胞凋亡的影响大小顺序为何首乌<虎杖<大黄。
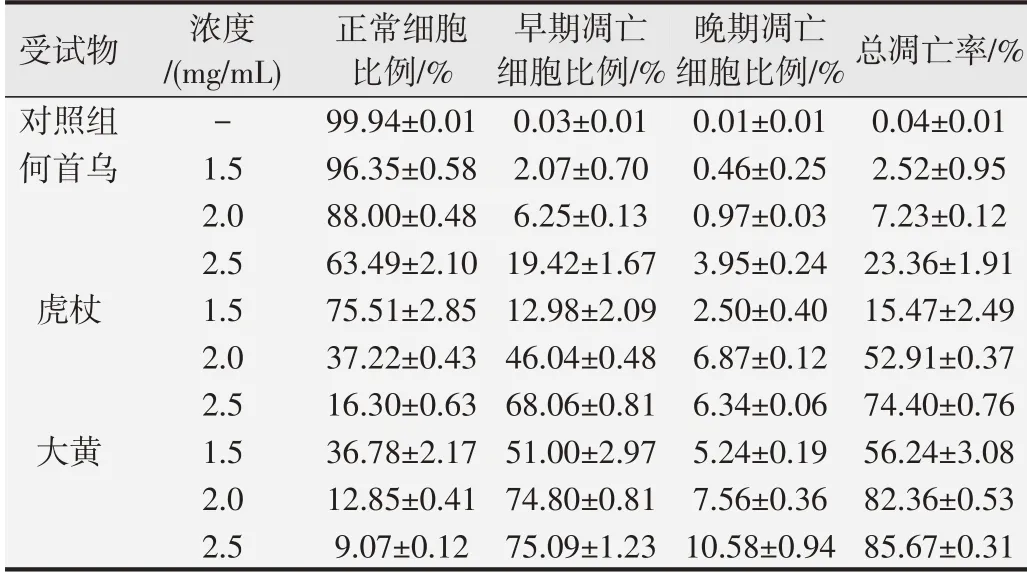
表5 何首乌、虎杖、大黄对HepaRG细胞凋亡的影响
3 讨论
本研究采用HPLC法测定了3种中药何首乌、虎杖、大黄主要游离蒽醌大黄素、大黄素甲醚、芦荟大黄素、大黄酸、大黄酚含量,比较了3种中药水提物中游离蒽醌的含量,发现大黄中的游离蒽醌以大黄酚和大黄酸较高,其次为大黄素、大黄素甲醚、芦荟大黄素,而虎杖和何首乌则仅检测出大黄素和大黄素甲醚,整体来看,游离蒽醌的含量排序为何首乌<虎杖<大黄。本研究选用人正常肝祖母细胞HepaRG比较研究了3种中药水提物体外肝细胞毒性,细胞活力及凋亡实验均表明,3种中药提取物的肝细胞毒性为何首乌<虎杖<大黄,与游离蒽醌含量顺序一致,提示3种中药游离蒽醌含量与其肝细胞毒性有一定相关性。
已有多个课题组报道过游离蒽醌对肝细胞的毒性作用。如我们课题组前期研究发现,大黄素可以诱导人肝实质L02细胞凋亡[5]。窦志华等用大黄游离蒽醌提取物灌胃大鼠获得含药血清(含5种原型成分、15种代谢产物),并以不同剂量含药血清处理HL-7702细胞,检测其谷草转氨酶的泄漏情况,发现大黄蒽醌类成分具有肝毒性,且游离蒽醌为效应物质之一[6]。贾歌刘畅的细胞实验表明何首乌醇提物以及大黄素、大黄酸等对人正常肝细胞有一定的诱导凋亡作用,且大黄素的作用要强于大黄酸[12]。刘德明等使用大黄素作用于L02细胞,发现一定浓度的大黄素对L02细胞具有明显的毒性,能够显著提升L02细胞内的ROS水平,激活caspase-8[13]。卫培峰等对大鼠连续3个月经口灌胃大黄素、大黄酸和大黄酚,发现大黄素、大黄酸并不能促进大鼠体内肝细胞凋亡,但大黄酚可以导致大鼠肝细胞凋亡[14]。任璐等对大鼠连续14 d经口灌胃给药大黄素甲醚,未见明显的与大黄素甲醚有关的肝毒性[15]。上述研究表明,游离蒽醌有肝细胞毒性,但是各个单体的贡献及在体内的实际作用还需要进一步研究阐明。汪美汐等使用大黄素处理L02细胞,通过测定细胞活力、细胞损伤和CYP450 mRNA的表达水平,发现大黄素对人正常肝细胞有一定的损伤作用,推测大黄素可以通过诱导CYP1A1 mRNA的表达促进相应底物活化,诱发肝毒性或通过诱导CYP7A1 mRNA的表达,导致胆汁淤积型肝损伤[16]。我们课题组前期研究发现,何首乌水提物及游离蒽醌均可抑制大部分大鼠肝药酶的表达[17-18],同时发现何首乌肝毒性与大鼠肝脏CYP1A2或CYP2E1的低活性相关[19],敲除人肝细胞中某些肝药酶可显著增加大黄素等游离蒽醌的肝细胞毒性[20],推测临床上何首乌特异质肝毒性可能与人群中基因多态性造成的肝药酶低表达与何首乌中游离蒽醌所致肝药酶活性降低双重作用有关。
本研究结果显示,何首乌、虎杖、大黄水提物的肝细胞毒性与其游离蒽醌含量成正相关,提示研究这3种中药肝毒性需重点关注药材中游离蒽醌含量及游离蒽醌体内代谢情况,如药物代谢酶基因表达及活性等,为临床上3种中药的安全、精准使用提供参考。
