一个家族性高胆固醇血症家系的基因突变筛查与评估
2020-06-04张佳虹张庆英张燕虹陈甲连刘锐国吴龙飞
张佳虹,张庆英,*,张燕虹,陈甲连,谢 芳,刘锐国,吴 容,吴龙飞
(1.汕头大学医学院公共卫生与预防医学教研室,广东 汕头 515041;2.云南省玉溪市红塔区疾病预防控制中心慢性病防治科,云南 玉溪653100)
家族性高胆固醇血症(familial hypercholesterolemia,FH)是一种常见的常染色体遗传性代谢疾病,其特征是血清低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)的显著升高,甚至有早发的动脉粥样硬化性疾病和心血管疾病[1]。FH的患病率约为1/250,全世界估计有1 400万~3 400万名患者[2]。中国仅有的人群流行病学调查来自江苏省9 324人的营养研究,数据显示FH患病率为0.28%(标化率为0.18%)[3]。FH的心血管疾病患病风险较高,有研究表明,与无突变且血脂正常的人相比,无突变但LDL-C高于4.9 mmol/L的人患心血管疾病的风险是前者的6倍,而携带FH致病突变且血脂异常的人患心血管疾病的风险则高达22.3倍[4]。DO等对早发性心肌梗死患者的研究显示,约2%患者携带FH的基因致病性突变[5]。尽管FH对心血管系统的危害较大,但全世界FH的诊断率和治疗率仍较低,大多数国家的诊断率不足1%[2,6]。目前我国关于FH的研究仍然较少,其诊断主要依据临床表现,对于相应的遗传变异情况不明,尚需结合基因检测。近年来,随着分子生物学技术的发展,全基因组测序应用于临床辅助诊断有望实现[7-8]。FH的早期筛查和诊断有助于患者的早期治疗,降低心血管疾病患病风险和预防早死,改善预后和促进康复。故本研究以一个临床诊断的FH家系为调查对象,结合家系成员的临床指标和基因筛查结果,重点对LDLR、APOB、PCSK9、LDLRAP1这4个公认的与FH相关的基因进行筛查,并进行生物信息学的SNP功能预测,以寻找该家系的致病基因,为其维持合适的血脂水平和促进健康提供指导作用。
1 材料与方法
1.1 研究对象
研究对象来源于云南省玉溪市某社区流行病学项目筛查发现的血脂异常的高胆固醇血症患者,选取其中1名总胆固醇(total cholesterol,TC)达8.71 mmol/L的患者为研究对象,进一步筛查其家庭成员的血脂情况。根据《中国成人血脂异常防治指南》[9],美国国家脂质协会血脂异常治疗指南建议[10]、陈在嘉主编的《临床冠心病学》[11]综合考量,制定FH诊断标准[12]:接受调脂药物治疗的患者血清TC水平≥6.22 mmol/L,未接受调脂药物治疗的患者血清TC水平≥7.8 mmol/L,同时至少具有下列特征之一:①患者本人或其直系亲属中有肌腱黄色瘤者;②患者直系亲属中有高胆固醇血症者;③患者家庭成员中有儿童期就被检出有高胆固醇血症者。
根据筛查结果,发现该家系有2名成员符合FH诊断标准,因此将所有家庭成员同时纳入进行进一步的基因检测,并绘制家系图,Ⅰ表示第一代人,Ⅱ表示第二代人,每一代成员序号则从左往右由1开始依次编号。
1.2 血样采集
在取得调查对象知情同意后,受试者禁食后于清晨空腹采集外周静脉血,送玉溪市第三人民医院检验科采用全自动生化仪检测总胆固醇、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇和高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)4项生化指标。
1.3 全基因组外显子测序
将采集的血液送华大基因,提取白细胞DNA进行全基因组外显子测序。测序结果应用Burrows-Wheeler Aligner(BWA)进行序列比对,SOAPsnp,SAMtools或GATK软件进行单核苷酸多态性(single nucleotide polymorphisms,SNP)位点检测。AnnoDB用于注释SNP。质量控制贯穿整个数据处理的过程。
1.4 数据分析
本研究重点对4个公认的FH致病基因LDLR、APOB、PCSK9、LDLRAP1进行生物信息学分析,采用Polyphen-2(http://genetics.bwh.harvard.edu/pph2/)和SIFT(https://sift.bii.a-star.edu.sg/)这两个常用的具有代表性的数据库对各个位点进行功能和保守性危害预测。PolyPhen-2考虑了蛋白质结构和比较进化,通过机器学习来预测氨基酸替换对人类蛋白质稳定性和功能的可能影响[13],并作定性评价:得分0.909~1.000为很可能致病,0.447~0.908为可能致病,0~0.446为良性。SIFT则基于氨基酸保守程度,通过与近似的序列进行比对,计算碱基发生替换的概率,对引起氨基酸改变的非同义的SNP进行功能预测,得分≤0.05提示有害,>0.05提示可容忍。
2 结果
2.1 血脂情况和家系情况
据调查,该家系4名成员均未发现肌腱黄色瘤,均未服用调脂药物。家系图和成员编号见图1。成员Ⅰ-1的血清TC达8.71 mmol/L,其儿子为高胆固醇血症者,故Ⅰ-1符合FH诊断标准。成员Ⅱ-1的血清TC达8.05 mmol/L,其母亲为高胆固醇血症者,故Ⅱ-1也符合FH诊断标准。该家系有Ⅰ-1和Ⅱ-1这2名成员患FH,具体情况见表1。

图1 FH家系图
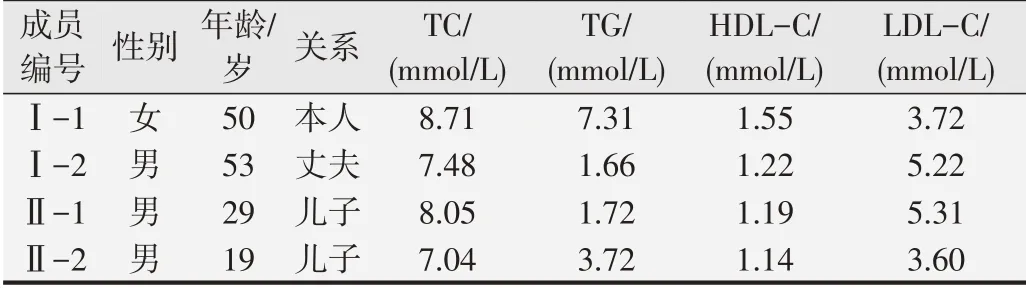
表1 FH家系成员血脂情况
2.2 测序结果和危害分析
该家系中共发现了10个SNP位点,分别位于APOB,PCSK9和LDLRAP1基因上,位点情况详见表2。经Polyphen-2软件预测,APOB基因上2个SNP位点rs676210和rs679899得分分别为0.999和0.998,均提示很可能致病;2个新位点c.10094A>T和c.9937C>G得分分别为0.829和0.770,均提示可能致病。上述4个位点经SIFT软件预测均为有害的。APOB基因的其他位点、PCSK9和LDLRAP1基因上的位点均被预测为良性。未发现LDLR基因的SNP位点。
该家系中2名患者和2名未患病者均携带rs676210和rs679899位点,另有未患病者Ⅰ-2携带两个新位点c.10094A>T和c.9937C>G,说明这些位点均不与疾病表型共分离。
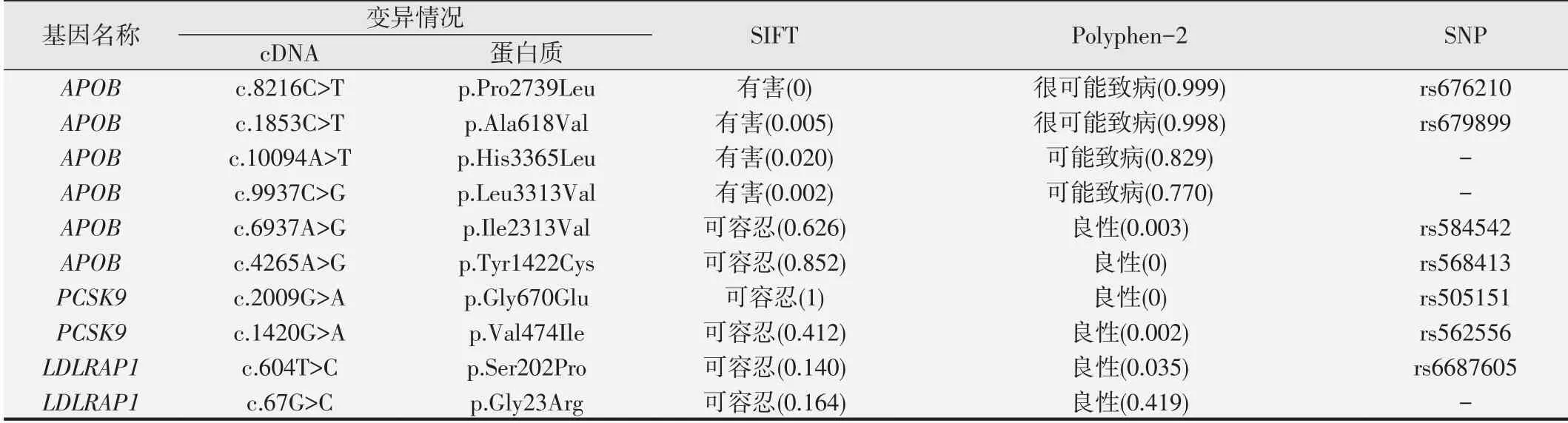
表2 家族性高胆固醇血症家系的APOB、PCSK9、LDLRAP1基因SNP位点情况
3 讨论
本研究通过社区发现了一个FH家系,重点对LDLR、APOB、PCSK9、LDLRAP1基因进行筛查后发现了APOB基因上4个可能与血脂增高有关的SNP位点,其中rs676210和rs679899为前人报道过的与血脂相关的位点,c.10094A>T和c.9937C>G为本研究发现的新位点,但在该家系中这些SNP位点均不与疾病表型共分离,这些位点的功能还有待进一步探讨。
FH的分子遗传机制复杂,目前至少已发现9个致病基因上千个致病位点,包括LDLR、APOB、PCSK9、LDLRAP1、APOE、STAP1、LIPA、ABCG5和ABCG8基因[7]。遗传图谱和下一代测序结果表明在杂合子FH患者中,80%~85%存在LDLR基因变异,5%~10%存在APOB基因变异,PCSK9和LDLRAP1贡献的比例均不到1%[7]。目前,国内FH诊断的金标准是检测到LDLR、APOB、PCSK9、LDLRAP1基因的致病性突变[14],但也有许多患者达到了临床诊断的标准,但却未发现致病突变[15-16]。因此专家建议更准确的FH诊断需结合临床诊断和基因检测结果[14]。而临床诊断和基因诊断不一致的患者心血管疾病的风险依旧相当高,仍然需要我们持续关注。
APOB基因位于人2号染色体的短臂上(2p24.1),有29个外显子。APOB是乳糜微粒、低密度脂蛋白、极低密度脂蛋白、中密度脂蛋白和脂蛋白a的载体蛋白,主要以两种亚型存在:小肠合成的ApoB48和肝脏合成的ApoB100[17]。每个LDL颗粒上都有一个ApoB100分子,用于结合LDL受体,在LDLR的介导下发生内吞作用,进入肝脏代谢,从而清除血液中的LDL-C。APOB基因在脂质的转运和分解过程中发挥着重要的作用,而该基因突变引起血清APOB升高,可能会导致LDL-C升高和其他脂代谢紊乱、及在正常的LDL-C水平下使冠心病风险增加[7]。
此前Gu等对631名中国裕固族居民的研究显示,与TT突变基因型相比,APOB基因SNP位点rs676210的CT和CT+CC基因型居民患高血脂的风险分别是1.72倍和1.67倍,携带C等位基因的人可能更易患高脂血症,该位点可能成为裕固族中老年人群高脂血症筛查的新位点;而在该人群中rs679899不同基因型对血脂的影响未见差别[18]。WOJCZYNSKI等对958人采用非诺贝特治疗后发现,rs676210 CC、CT和TT基因型的TG水平分别降低了24.7%、28.3%和34.5%,该位点可能有助于识别对非诺贝特降脂治疗敏感的患者[19]。另一项采用遗传易感性评分的病例对照研究显示,冠心病患者rs679899各基因型分布有差异,且T等位基因出现的频率比对照组高[20]。BENN等对哥本哈根心脏队列研究9185人基因分型结果显示,与野生基因型相比,rs676210和rs679899位点杂合基因型的血浆LDL-C分别降低了0.14和0.12 mmol/L,rs679899位点纯合突变型的LDL-C降低了0.18 mmol/L[21]。rs676210所在的区域参与VLDL转化为LDL过程中ApoB的结构变化过程[22],而rs679899则位于调控新生ApoB脂质化的关键区 域[23],二者在ApoB的形成和生物学功能发挥过程中都起着重要作用,值得我们进一步地探究。而两个新位点c.10094A>T和c.9937C>G是否在血脂代谢过程中发挥生物学作用,还需进一步的人群研究和功能实验来佐证。
本研究未发现PCSK9和LDLRAP1基因上的有害变异。PCSK9和LDLRAP1基因突变通常与家族性高胆固醇血症有关。研究表明PCSK9通过诱导LDL受体(LDLR)的降解来参与脂质代谢,使血液中LDL-C水平升高[24]。PCSK9功能获得型突变通常引起胆固醇升高,临床上PCSK9抑制剂多与他汀类联合用药来控制血脂[25]。LDLRAP1基因编码的蛋白通常与LDLR蛋白结合,参与LDL的内化、LDLR的循环利用或降解过程[7]。
目前,FH有1 097个致病或可能致病位点,但85%的位点体外功能研究证据缺乏[26],新位点的发现和功能研究是阐明潜在的生物学机制和药物作用靶点的关键,对FH患者的筛查识别和预后也至关重要[26-27]。因此,建议有条件的疑似或临床诊断FH患者进行基因检测,做到早发现早治疗。本研究也存在一定的局限性,如仅针对一个家系进行研究,未检测血液APOB水平,未进行功能验证实验等,后续还需继续扩大样本量,增加检测指标,从多方面验证SNP与疾病的关系。
