紫铆花素抑制脂多糖诱导的骨髓源性巨噬细胞炎症反应的研究
2020-06-04陈子卓徐宇航姜晓旭赵九洲朱敬朴郑义鹏吴浩芝李文丽海春旭于卫华
陈子卓,徐宇航,#,姜晓旭,赵九洲,朱敬朴,郑义鹏,吴浩芝,李文丽,王 欣,*,海春旭,*,于卫华,*
(1.空军军医大学基础医学院,陕西 西安710032;2.空军军医大学第一附属医院综合诊疗科,陕西 西安 710032;3.空军军医大学军事预防医学院军事毒理学与防化医学教研室,陕西省自由基生物学与医学重点实验室,特殊作业环境危害评估与防治教育部重点实验室,陕西 西安 710032)
紫铆花素(butein)是一种由植物中分离提取的多酚类单体化合物,是传统中草药锦鸡儿和降香的主要活性成分[1]。研究发现,紫铆花素具有抗菌、抗病毒、抗寄生虫、抗纤维化和抗肿瘤等生物学效应,具有良好的药物开发价值和前景[2]。脂多糖(lipo poly saccharide,LPS)是革兰阴性菌细胞壁的重要活性成分,可与巨噬细胞膜上Toll样受体4(Toll-like receptor 4,TLR4)结合,诱导巨噬细胞炎症反应的发生。Janus激酶(Janus kinases,JAKs)是一种非受体型酪氨酸蛋白激酶,可在细胞因子作用下发生磷酸化,并通过信号转导子和转录激活子(signal transducers and activators of transcription,STATs)启动下游靶基因,发挥生物调控作用。STAT3是STATs家族的成员,可在胞浆内与多种细胞因子受体结合,进而转移至核内发挥转录调控作用[3]。大量研究表明,JAK2-STAT3活化与细胞增殖、分化和免疫调节密切相关,在炎症和肿瘤进展中发挥关键作用[4]。敲减JAK2和STAT3可阻断多种炎症因子诱导的巨噬细胞活化[5]。而在小鼠脓毒血症模型中,使用JAK2-STAT3通路抑制剂,可有效阻断核转录因子NFκB激活,提高小鼠的生存率[6]。最新研究发现,紫铆花素是一种特殊的蛋白质酪氨酸激酶抑制剂,可显著阻断表皮生长因子受体磷酸化[7-8]。那么,JAK2作为一种酪氨酸蛋白激酶,是否受到紫铆花素调控,目前并不清楚。因此,本研究旨在探讨butein是否对LPS诱导炎症具有抑制作用,及JAK2-STAT3通路在其中发挥的作用。
1 材料与方法
1.1 材料
1.1.1 动物和试剂 C57BL/6小鼠由第四军医大学动物中心提供;紫铆花素标准品购自中国药品生物制品中心,纯度98%;LPS购自Sigma公司;H2DCFH-DA荧光探针购自Invitrogen公司;小鼠TNF-α、IL-6和NO酶联免疫试剂盒购自武汉华美生物工程有限公司;iNOS、p-JAK2、JAK2、p-STAT3、STAT3和βactin抗体均购自Birobyt生物公司;RMPI 1640培养液、胎牛血清、红细胞裂解液、PBS均购自上海吉诺医药生物技术公司。
1.1.2 仪器 垂直流超净工作台购自ESCO公司,型号SCV-4A1;CO2培养箱为Thermo公司的3111/371型号;全波段酶标仪购自infinite公司,型号M200 PRO;流式细胞仪购自BD公司,型号Accuri C6;倒置显微镜购自Olympus公司,型号IX73;电泳仪、转膜仪和凝胶成像系统均购自Bio-Rad公司。
1.2 方法
1.2.1 骨髓源性巨噬细胞的分离培养 取8周龄小鼠胫骨和股骨,无菌环境中RMPI 1640培养基冲洗骨髓细胞。裂解红细胞后,用40 ng/mL巨噬细胞集落刺激因子(GM-CSF)刺激7 d,分化为骨髓源性巨噬细胞(bone marrow-derived macrophages,BMDM),通过贴壁筛选,获得纯化BMDM。采用含10%胎牛血清(FBS)的RMPI 1640培养基,置于CO2体积分数为5%的37℃恒温培养箱中培养。
1.2.2 细胞处理以及实验分组 BMDM采用500 ng/mL的LPS刺激12 h建立炎症模型,受试物干预组使用5、10、20μmol/L的butein与LPS共处理,阴性对照组为20μmol/L的butein单独处理12 h,并设立空白对照组,每组3个重复。
1.2.3 细胞培养基中TNF-α、IL-6和NO含量检测采用ELISA法检测培养基中TNF-α,IL-6和NO含量。细胞处理完成后,收集培养基,2 000 r/min离心10 min去除细胞。按照试剂盒说明书加入待测样品和标准品,37℃环境下孵育2 h。清洗后加入检测工作液,孵育30 min,酶标仪在450 nm波长下测定吸光度,并根据标准品吸光度曲线推算样品中TNF-α和IL-6含量。
1.2.4 细胞ROS水平检测 DCFH-DA是细胞内ROS测定的特异性荧光探针。DCFH-DA进入细胞后,可被水解为无荧光的DCFH,进而被ROS氧化为有荧光的DCF。DCF荧光越强,表明细胞内ROS水平越高。处理完成后,细胞中加入终浓度为10μmol/L的DCFH-DA,37℃环境下孵育30 min,流式细胞仪检测荧光强度。
1.2.5 Western blot测定细胞内蛋白表达 细胞处理完成后,RIPA裂解液裂解细胞。BCA法进行蛋白定量,每组上样20μg。选用10%凝胶,90 V电压15 min,然后150 V电压电泳约1 h结束。25 V、30 min条件下将凝胶蛋白转至NC膜。5%BSA,37℃条件下封闭40 min。加入按要求稀释的iNOS、p-JAK2、JAK2、p-STAT3、STAT3和β-actin一抗,4℃孵育过夜。TBST洗膜3次,每次10 min。加入1∶5 000稀释的二抗,37℃孵育60 min。TBST洗膜4次,每次15 min。凝胶成像系统拍照。采用Quantity One软件分析蛋白表达变化,并以对照组为基准进行标准化。计算p-JAK2/JAK2和p-STAT3/STAT3蛋白条带灰度比值变化,并以对照组为基准进行标准化。
1.3 统计学方法
实验数据以平均数±标准差表示,采用方差分析检测组间方差是否齐性。两组之间差异采用LSD t检验作比较,P<0.05表示组间差异有统计学意义,数据统计分析采用SPSS 13.0软件。
2 结果
2.1 紫铆花素抑制LPS诱导的小鼠骨髓源性巨噬细胞促炎因子分泌
巨噬细胞在LPS等刺激下,可释放大量促炎因子如TNF-α、IL-6、IL-1β等。ELISA检测BMDM培养液中促炎因子浓度的结果见图1A和图1B。我们使用500 ng/mL的LPS刺激BMDM 12 h,ELISA法测定细胞上清中TNF-α和IL-6含量。结果发现,LPS刺激后BMDM培养基中TNF-α和IL-6浓度显著升高(P<0.05)。而5、10和20μmol/L的butein共处理后BMDM培养基中TNF-α和IL-6浓度明显降低。其中,20 μmol/L的butein对TNF-α分泌的抑制率为68.6%,对IL-6分泌的抑制率为84%。
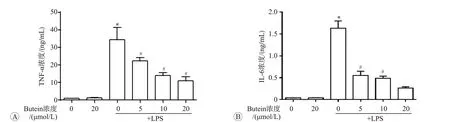
A:TNF-α浓度;B:IL-6浓度.n=3.与空白对照组比较,*P<0.05;与LPS单独处理组比较,#P<0.05.图1 ELISA法检测小鼠骨髓源性巨噬细胞培养液中的促炎因子浓度
2.2 紫铆花素抑制LPS诱导的小鼠骨髓源性巨噬细胞NO合成
NO在机体炎症和免疫调节中发挥关键作用。在炎症因子刺激作用下,巨噬细胞激活并释放大量NO,具有杀菌和杀伤肿瘤细胞的作用。ELISA检测BMDM培养液中NO浓度的结果见图2A。LPS刺激下BMDM培养基中NO浓度显著升高,而5、10和20 μmol/L的butein共处理显著降低NO的合成(P<0.05)。iNOS是巨噬细胞内调控NO合成的关键酶,iNOS表达和活性水平决定细胞NO的合成能力。Western blot检测BMDM中iNOS表达水平的结果见图2B,LPS活化BMDM的iNOS蛋白表达增加,而给予butein干预显著降低iNOS表达(P<0.05)。
2.3 紫铆花素抑制LPS诱导的小鼠骨髓源性巨噬细胞ROS生成
在感染和炎症条件下,巨噬细胞会释放大量ROS,用于杀灭入侵病原菌。因此,ROS生成增多是M1型活化巨噬细胞的重要特征。DCFH-DA染色后流式细胞术检测ROS生成的结果见图3。LPS刺激下BMDM内DCF信号增强约30倍(P<0.05),表明LPS诱导BMDM生成ROS。而使用5、10和20μmol/L的butein共处理,DCF荧光曲线明显左移(P<0.05),表明butein抑制了LPS诱导的ROS生成。
2.4 紫铆花素抑制LPS诱导的小鼠骨髓源性巨噬细胞JAK2激活

A:ELISA法检测细胞培养基中NO浓度;B:Western blot检测细胞内iNOS蛋白表达.n=3.与空白对照组比较,*P<0.05;与LPS单独处理组比较,#P<0.05.图2 紫铆花素抑制LPS诱导的小鼠骨髓源性巨噬细胞NO合成
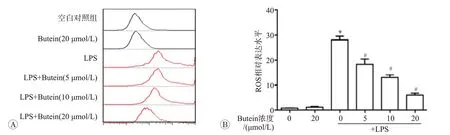
A:流式细胞术检测细胞培养基中DCFH-DA荧光强度;B:DCF平均荧光强度统计.n=3.与空白对照组比较,*P<0.05;与LPS单独处理组比较,#P<0.05.图3 紫铆花素抑制LPS诱导的小鼠骨髓源性巨噬细胞ROS生成
JAK2是一种非受体型酪氨酸蛋白激酶,可在众多细胞因子作用下激活,并通过STAT3启动下游靶基因。Western blot检测p-JAK2与JAK2表达水平的结果见图4。LPS刺激下BMDM中JAK2蛋白表达无明显变化,但p-JAK2表达增多,且p-JAK2与JAK2蛋白条带灰度比值显著升高(P<0.05)。研究表明,紫铆花素是一种酪氨酸激酶抑制剂。我们发现,与LPS组相比,butein共处理组p-JAK2表达降低,且p-JAK2/JAK2比值减少,以20μmol/L组最为明显(P<0.05)。
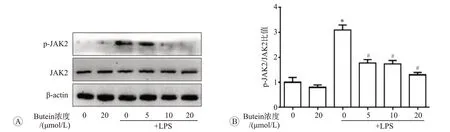
A:Western blot检测细胞内p-JAK2和JAK2蛋白表达;B:p-JAK2/JAK2比值的统计分析.n=3.与空白对照组比较,*P<0.05;与LPS单独处理组比较,#P<0.05.图4 紫铆花素抑制LPS诱导的小鼠骨髓源性巨噬细胞JAK2激活
2.5 紫铆花素抑制LPS诱导的小鼠骨髓源性巨噬细胞STAT3激活
STAT3是细胞浆内重要的信号转导和转录调节因子,在细胞因子刺激下STAT3磷酸化并转位至细胞核,启动下游靶基因转录。Western blot检测内p-STAT3和STAT3表达水平的结果见图5。LPS刺激下BMDM中p-STAT3表达增多,且p-STAT3与STAT3蛋白条带灰度比值显著升高(P<0.05)。与LPS单独处理组相比,butein共处理后BMDM内p-STAT3表达降低,且p-STAT3/STAT3比值减少,以20μmol/L组最为明显(P<0.05)。
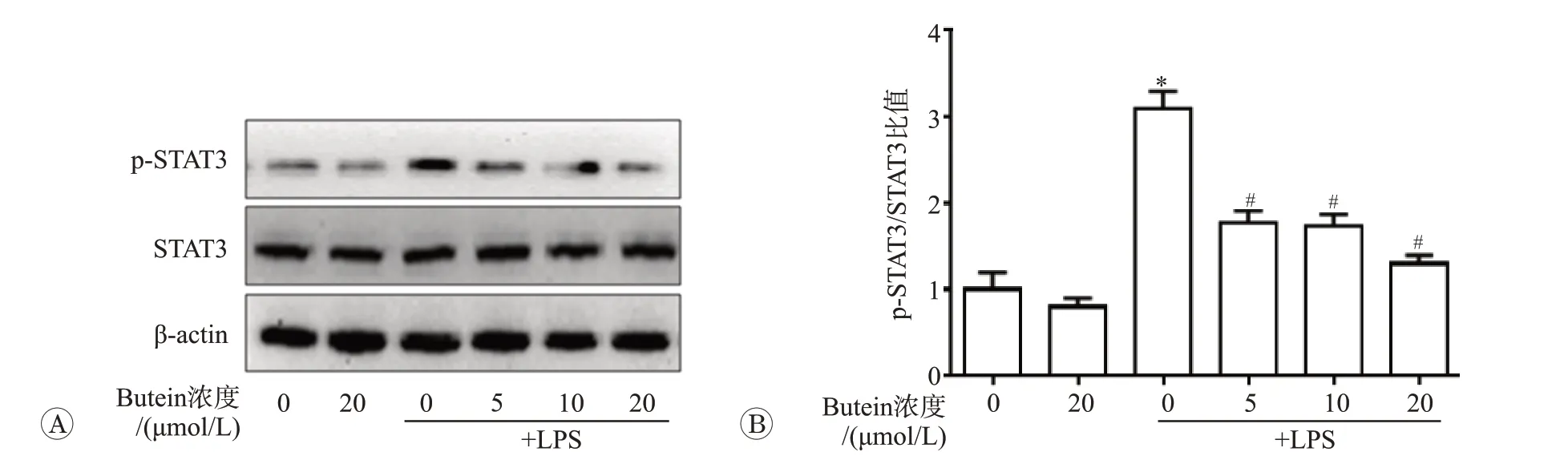
A:Western blot检测细胞内p-STAT3和STAT3蛋白表达;B:p-STAT3/STAT3比值的统计分析.n=3.与空白对照组比较,*P<0.05;与LPS单独处理组比较,#P<0.05.图5 紫铆花素抑制LPS诱导的小鼠骨髓源性巨噬细胞STAT3激活
3 讨论
炎症与健康息息相关,一方面发挥免疫杀伤作用,可清除病原菌和恶性转化细胞,另一方面通过损伤机体导致多种急慢性疾病。研究表明,90%以上临床疾病均存在炎症细胞的浸润和炎症反应的发生,例如感染、脓毒血症、肥胖和肿瘤等[9-10]。巨噬细胞是体内最主要的炎症效应细胞,广泛存在于诸多组织和器官内。在脂多糖等致炎因子刺激作用下,巨噬细胞发生M1型极化。本研究通过分离小鼠骨髓,并使用GM-CSF诱导分化为BMDM[11]。在500 ng/mL的LPS刺激下,BMDM激活,并释放一系列炎症因子,包括TNF-α、IL-6和NO等。同时氧化应激与炎症关系密切,巨噬细胞在炎症因子刺激下可释放大量ROS,而ROS可通过NFκB和COX2调控炎症反应。我们在本研究中发现,LPS刺激下BMDM内炎性因子和ROS水平显著升高,结果表明成功建立了LPS刺激BMDM的体外炎症模型。
紫铆花素是一种由中药中提取的多酚类单体化合物,具有多种生物学活性[12]。大量研究表明,紫铆花素具有抗菌、抗肿瘤、神经保护和心血管保护功能[13-14]。而有关紫铆花素与炎症相关研究较少,本研究中我们使用5、10和20μmol/L紫铆花素与LPS共同处理BMDM 12 h。结果发现紫铆花素可抑制LPS诱导的BMDM炎症反应并呈剂量-效应关系,降低培养基中TNF-α、IL-6和NO含量。其中NO既是一种重要炎症介质,又是一种活性较强的ROS,在体内具有重要生物学作用[15]。而NO合成依赖于iNOS,紫铆花素抑制了iNOS的表达,进而降低了培养基中NO含量。此外,DCFH-DA染色结果也证实,紫铆花素抑制了LPS诱导的巨噬细胞ROS生成。近年来研究表明,炎症反应与氧化应激既存在交互作用,又存在独立作用,因此单纯抗炎或者抗氧化往往不足以根除炎症[16]。因此,我们研究认为紫铆花素兼具抗炎和抗氧化作用,是一种具有研究和开发价值的抗炎药物。
JAK-STAT是细胞内重要的信号传导和转录通路,可以通过与多种细胞因子和生长因子结合,参与机体细胞的增殖、分化、凋亡和免疫调节功能[17]。细胞因子与JAK受体结合后形成二聚体,并促进JAK的酪氨酸的磷酸化,活化的JAK可与STAT结合,引起STAT磷酸化以及核转位,进而启动下游靶基因转录[18]。近年来研究发现,JAK-STAT信号通路与巨噬细胞激活和炎症反应密切相关[5]。敲减或抑制JAK2可显著抑制脂多糖诱导的巨噬细胞TNF-α和IL-6表达。而JAK2可通过活化STAT3诱导巨噬细胞HMGB1和IL-6的转录表达,使用JAK2-STAT3通路抑制剂,可降低上述促炎因子的表达[19]。我们发现LPS刺激下BMDM中JAK2和STAT3的磷酸化显著升高,表明该通路激活。紫铆花素被认为是一种酪氨酸激酶抑制剂,而JAK2作为一种非受体型酪氨酸蛋白激酶,紫铆花素是否通过JAK2影响STAT3转录活性目前并不清楚。本研究表明紫铆花素可显著阻断LPS活化BMDM的JAK2和STAT3的磷酸化。因此,我们认为紫铆花素可能是通过JAK2-STAT3信号通路发挥抗炎效应。
综上所述,紫铆花素可显著抑制LPS诱导的BMDM活化,降低炎症因子和ROS生成。作为一种酪氨酸激酶抑制剂,紫铆花素可能通过抑制JAK2-STAT3发挥抗炎效应。本研究证实紫铆花素是一种新的抗炎候选药物,为炎症相关疾病防治提供了新的策略。
