新型壳寡糖γ-氨基丁酸衍生物的制备及其对小麦幼苗抗旱作用的研究
2020-06-03尹秀晶秦玉坤邢荣娥于春林李克成李鹏程
尹秀晶 , 刘 松 秦玉坤 邢荣娥 于春林 , 李克成 李鹏程
(1. 中国科学院海洋研究所 实验海洋生物学重点实验室, 山东 青岛 266071; 2. 青岛海洋科学与技术试点国家实验室 海洋药物与生物制品功能实验室, 山东 青岛 266237; 3. 中国科学院 海洋大科学研究中心, 山东青岛 266071; 4. 中国科学院大学, 北京 100049)
植物在生长周期内总是会受到高温、干旱、盐渍和病虫害等非生物和生物胁迫的影响。其中土地干旱或种植期间少雨是常见的非生物环境胁迫, 这极大的限制了世界各地部分地区作物产量。近年来,全球气温变暖、土壤沙漠化等环境问题日益突出, 我国干旱、半干旱地区占陆地面积的52.5%, 干旱缺水对我国农业造成严重影响, 据中华人民共和国应急管理部发布的“2019年上半年全国自然灾害基本情况”记载, 干旱灾害在全国范围内共造成1 585.7公顷农作物受灾, 直接经济损失 71.2亿元, 干旱胁迫已成为制约农业发展的主要因素之一。
小麦不仅是世界上重要的粮食作物, 也是我国第二大粮食作物, 小麦的产量直接关系到人民的生活状态, 与国民经济发展紧密相关。在小麦的萌发、发育、生长期内常常受到干旱、少雨等胁迫, 尤其在萌发期和幼苗期, 小麦的抵抗力较弱, 容易造成大面积的不出苗以及幼苗失水萎蔫、叶片衰退早、光合系统受到损伤等不良状态, 不利于小麦后期的生长和发育, 最终影响产量。
目前, 人们对于天然来源的植物生长调节剂关注密切, γ-氨基丁酸(γ-aminobutyric amino acid, GABA)属于非蛋白质氨基酸, 植物如参属、豆薯等的种子中含有GABA, 此外在一些植物的根茎中也都含有GABA。近年来发现外源GABA对植物在干旱[1-2]、盐压[3]、低温[4]、低氧[4]等逆境抵抗中有重要作用[5]。壳聚糖是由来源于虾、蟹等节肢动物外骨骼中的甲壳素脱乙酰得到, 据文献报道,壳聚糖可以促进植物的生长[6]、提高植物抗旱、寒、盐的能力[7], 作为潜在的作物抗逆剂、种子包衣剂、土壤改良剂、植物生长调节剂[8-9]。壳寡糖是壳聚糖经过降解得到的聚合度在2~20之间的低聚糖[10], 与壳聚糖相比壳寡糖有更好的水溶性,应用范围更广, 壳聚糖与壳寡糖在植物抗非生物胁迫方面活性相差较大[11-12]。
但是这些活性物质单独使用往往作用效果有限,因此利用活性分子拼接原理, 将具有抗旱活性的壳寡糖、γ-氨基丁酸有机合成为一个分子, 设计合成具有更高抗旱活性的新型壳寡糖 γ-氨基丁酸衍生物,并研究衍生物处理对小麦出苗期干旱胁迫下生理生化指标的影响。
1 实验部分
1.1 主要实验药品与试剂
壳寡糖(COS 1K, 相对分子量1 000 Da)购买于青岛云宙生物科技有限公司; γ-氨基丁酸(G), 源叶生物, BR; 1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐 (EDC·HCl), Solarbio; N-羟基琥珀酰亚胺 (NHS),源叶生物, BR; 吗啉乙磺酸(MES), aladdin, 99%; 透析袋(Spectra/Por CE dialysis tubing, 截留分子量100-500 Da), 光谱医药; 小麦种子(长丰2112)。
1.2 主要仪器与设备
PHS-3C型pH计, 上海雷磁公司; HH-ZK4型恒温水浴锅, 巩义市予华仪器有限责任公司; 超低温冰箱, 北京天寒科技有限公司; 冷冻干燥机, 北京博医康实验仪器有限公司; 78-1 型磁力加热搅拌器,常州国华电器有限公司; TU-1810 型紫外可见分光光度计, 北京普析通用仪器有限责任公司; iMark 酶标仪, 美国BIO-RAD 公司; SARTORIUS 电子天平,赛多利斯科学仪器(北京)有限公司; 红外光谱仪(Nicolet Magna-Avatar 360), Nicolet Magna 公司核磁共振光谱仪(JNM-ECP600NMR spectrometer), 日本JEOL 公司; CT18RT台式高速冷冻离心机, 上海天美生化仪器设备工程有限公司; DDA-11A型电导率仪, 上海锦幻仪器仪表公司。
1.3 壳寡糖氨基丁酸衍生物的合成
参照前期研究的方法进行改进[13-14], γ-氨基丁酸(G)和壳寡糖(COS 1K)的摩尔比参照壳寡糖的聚合度设置为 7∶1, γ-氨基丁酸和 EDC·HCl、NHS的摩尔比为1∶3∶3。称取0.360 9 g γ-氨基丁酸溶于50 mL 0.1 mol/L pH 5.5的MES缓冲液中, 加入2.012 9 g EDC·HCl作为缩合剂, 加入1.208 4 g NHS作为偶联剂, 全部溶解后室温搅拌 3小时对氨基丁酸的羧基进行活化, 然后向混合溶液中加入0.500 0 g的1 000 Da的壳寡糖, 2 000 r/min室温搅拌24小时进行酰胺化反应, 反应结束后将反应液转移到截留分子量为100~500 Da的透析袋中, 用去离子水透析4天, 然后将透析液冷冻干燥。合成路线如图1所示。

图1 壳寡糖γ-氨基丁酸衍生物的合成路线Fig. 1 Synthesis scheme of basic γ-aminobutyric acid-modified chitooligosaccharide derivatives
1.4 壳寡糖γ-氨基丁酸衍生物的抗干旱实验
浸种: 选取品相均一的小麦种子约300粒, 室温下用25 mL 500 mg/L的各处理组溶液对小麦种子进行浸种8小时处理, 浸种液编号和成分表如表1所示。

表1 浸种液组别和成分表Tab. 1 Numbers and ingredients used in liquid to soak seeds
催芽: 将浸种液倒掉后吸干种子上的水分, 摆放在铺了四层纱布的大培养皿中, 纱布上加8 mL去离子水润湿, 室温下在暗处避光处理 24小时, 期间不断补充水分保持纱布湿润。
土壤处理: 将土壤和细沙高温灭菌后, 按土∶沙=3∶1混合均匀, 设置干旱组土壤重量含水量为10%,即混合均匀的土壤中加入的水占总重的 10%, 正常组设置为30%。
播种: 本研究共六个处理组, ① c ontrol:正常组,土壤含水量为30%, 去离子水浸种; ②drought: 干旱组, 土壤含水量10%, 去离子水浸种; ③G + drought:土壤含水量10%, γ-氨基丁酸浸种; ④ COS 1K + drought:土壤含水量10%, 1 000 Da壳寡糖浸种; (1K⑤-G) +drought: 土壤含水量 10%, 壳寡糖 γ-氨基丁酸衍生物浸种。每盆播种发芽的小麦种子50粒, 播种于土壤下3 cm深。每天20: 00称重补充水分。
培养: 此实验是在光照培养箱中进行, 光照设置情况: 光照周期14/10 h(昼/夜)、温度25/20(℃昼/夜)、光照强度 60%/0(昼/夜)、相对湿度 70%。培养至两叶一心后进行相关指标的测定。
1.4.1 抗干旱相关指标测定
将小麦的倒二叶剪下后用液氮研磨成粉保存于超低温冰箱中备用。参考张宪政[15]的方法, 利用硫代巴比妥酸和三氯乙酸试剂进行试验, 测定 450 nm、532 nm、600 nm波长的吸光度, 计算叶片中丙二醛的含量; 利用电导率仪测定细胞膜电解质渗出率。参考邹平[7]的方法, POD活性利用愈创木酚和过氧化氢测定在470 nm处每分钟吸光度变化; CAT活性利用过氧化氢测定在 240 nm处每分钟吸光度的变化。SOD的活性利用超氧化物歧化酶试剂盒测定。参考李和生[16]的方法, 提取色素试剂为 95%乙醇, 测定665 nm、649 nm、470 nm波长下的吸光度, 计算光合色素含量。参考张宪政[15]的方法, 利用浓硫酸和苯酚试剂进行试验, 测定485 nm波长的吸光度, 计算叶片中可溶性糖的含量; 利用磺基水杨酸和酸性茚三酮试剂进行试验, 测定520 nm波长的吸光度, 计算叶片中游离脯氨酸的含量。
1.4.2 统计分析
采用 Origin 8.5对数据进行处理, 采用 SPSS 19.0软件进行统计分析和差异显著性分析。柱状图中不同字母代表具有显著性差异(P<0.05)。
2 结果与分析
2.1 壳寡糖氨基丁酸衍生物的结构表征
2.1.1 红外光谱测定
壳寡糖(COS 1K)与 γ-氨基丁酸的衍生物(1K-G)的红外光谱图如图2所示。从图中可以看出, 壳寡糖原料中在 1 603 cm-1有一个-NH2的吸收峰, 对比壳寡糖(COS 1K)发现, 衍生物(1K-G)在1 603 cm-1处的峰消失, 反而在1 630~1 640 cm-1以及1 540~1 555 cm-1之间出现两个明显的吸收峰, 经查阅文献[13, 17]可知, 1 630~1 640 cm-1是仲酰胺的酰胺Ⅰ带吸收峰, 1 540~ 1 555 cm-1是酰胺Ⅱ带的N-H变形振动吸收峰,说明衍生物中存在新的酰胺键, 证明 γ-氨基丁酸通过羧基与壳寡糖的氨基进行了酰化反应接枝到了壳寡糖上。
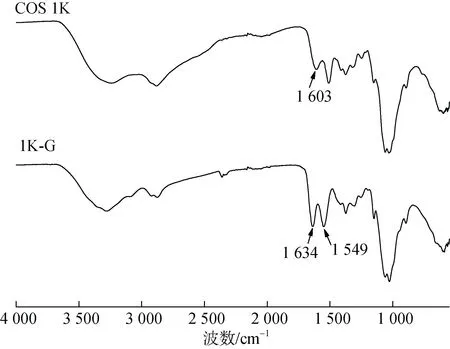
图2 壳寡糖及γ-氨基丁酸修饰壳寡糖的红外谱图(FT-IR)Fig. 2 FT-IR spectra of chitooligosaccharide and γ-aminobutyric acid-modified chitooligosaccharide
2.1.2 核磁共振氢谱(1H-NMR)测定
壳寡糖(COS 1K)与 γ-氨基丁酸的衍生物(1K-G)的核磁共振氢谱(1H-NMR)如图 3所示。根据文献[13,18-19]记载, 在两个谱图中3.45 ppm~3.92 ppm为壳寡糖糖环中的H6, H4, H3, H5的重叠峰, 4.60 ppm为壳寡糖糖环上的H1的吸收峰, 3.00 ppm附近的峰为壳寡糖糖环上的H2的吸收峰, 1.78 ppm为壳寡糖上未脱乙酰基的甲基质子吸收峰。γ-氨基丁酸修饰的壳寡糖的产物(1K-G)除保持壳寡糖(COS 1K)的各质子峰之外, 在3.27 ppm, 2.27 ppm, 1.61 ppm处多了三个质子的吸收峰, 经研究[13,18], 这三个质子峰分别对应γ-氨基丁酸接枝到壳寡糖上之后的H9, H7, H8的吸收峰。氨基丁酸成功接枝到壳寡糖上。
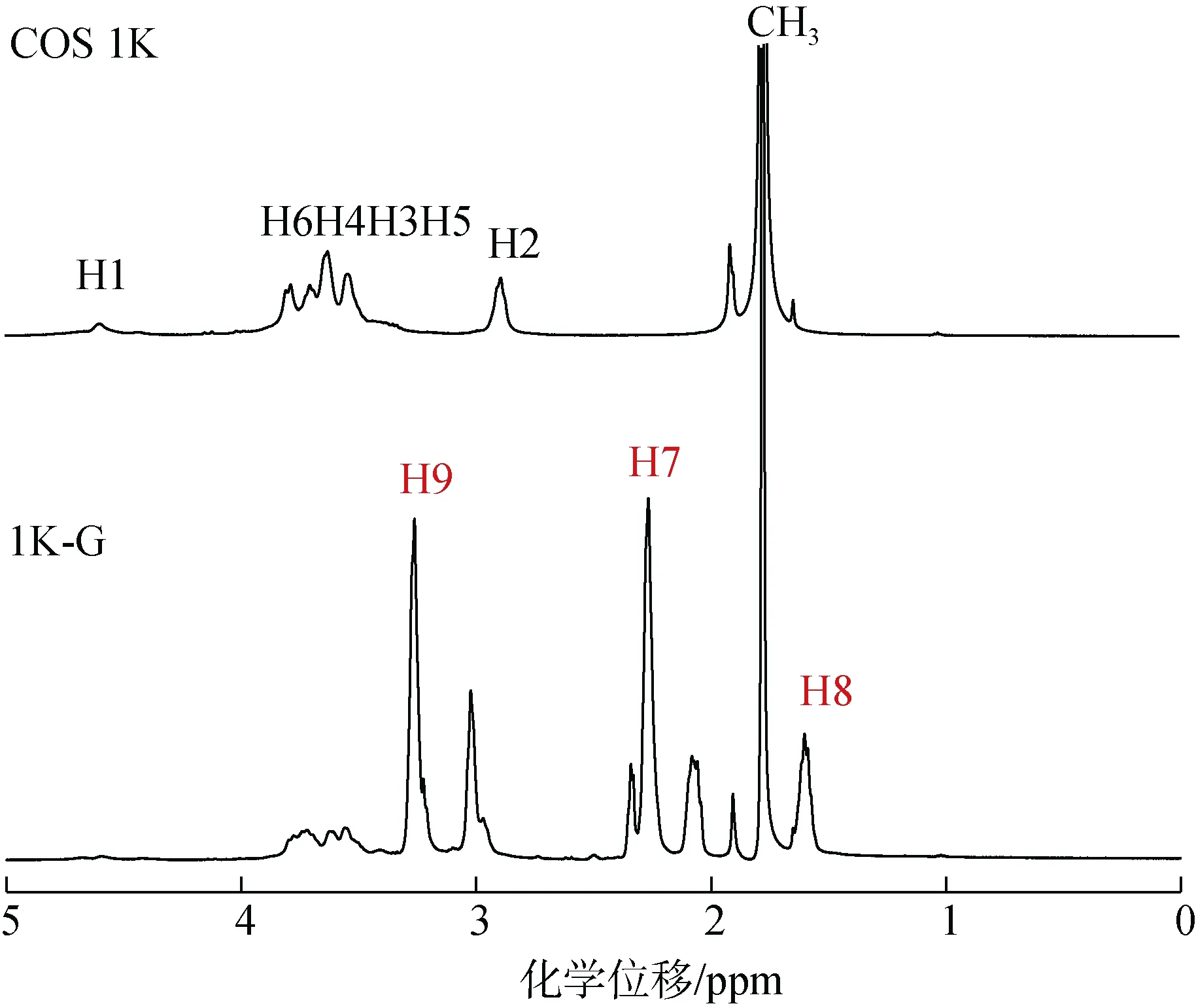
图3 壳寡糖及γ-氨基丁酸修饰壳寡糖衍生物的核磁共振氢谱(1H-NMR)Fig. 3 1H-NMR spectra of chitooligosaccharide and γ-aminobutyric acid-modified chitooligosaccharide
2.1.3 核磁共振碳谱(13C-NMR)测定
壳寡糖(COS 1K)与壳寡糖 γ-氨基丁酸衍生物(1K-G)的核磁共振氢谱(1H-NMR)如图 4所示。根据文献[13-14, 20]记载, 在两个谱图中180.00 ppm为壳寡糖未脱乙酰基中羰基碳(-C=O)的吸收峰, 97.86~98.76 ppm、76.50 ppm、74.60 ppm、70.30~71.20 ppm、59.85 ppm、56.13 ppm分别为壳寡糖糖环上的C1, C4,C5, C3, C6, C2的吸收峰, 22.83 ppm为壳寡糖上未脱乙酰基的甲基碳(CH3)的吸收峰。γ-氨基丁酸修饰的壳寡糖衍生物(1K-G)除保持壳寡糖的吸收峰之外, 在173.70 ppm、38.00~39.00 ppm、35.00 ppm、25.00 ppm多了四个位置的吸收峰, 经研究[14,21], 这四个位置的吸收峰分别为γ-氨基丁酸接枝到壳寡糖上新形成的酰胺键的羰基碳(C=O), 以及γ-氨基丁酸上的亚甲基碳(C9, C7, C8), 核磁碳谱上每一个峰对应一个碳原子, 分析谱图发现173.70 ppm、38.00~39.00 ppm、35.00 ppm、25.00 ppm四个位置都不止一个峰, 通过合成实验的原理: 氨基丁酸的羧基经过缩合剂和偶联剂活化后与壳寡糖中的氨基进行酰化反应形成酰胺键可知, 由于 γ-氨基丁酸中也存在氨基基团, 所以游离 γ-氨基丁酸中活化了的羧基也会和接枝到壳寡糖上的氨基丁酸的氨基进行反应, 所以合成的衍生物中部分为多聚氨基丁酸取代, 图 1所示的衍生物中 n1为 2, 即衍生物中部分取代基团为两个氨基丁酸链, 部分取代基团为一个氨基丁酸。γ-氨基丁酸成功接枝到壳寡糖上。
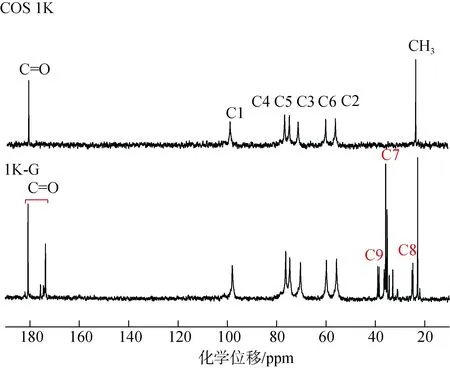
图 4 壳寡糖及 γ-氨基丁酸修饰壳寡糖的核磁共振碳谱(13C-NMR)Fig. 4 13C-NMR spectra of chitooligosaccharide and γ-aminobutyric acid-modified chitooligosaccharide
2.1.4 衍生物取代度计算
根据核磁共振氢谱计算衍生物的取代度结果如表2所示。

表2 壳寡糖氨基丁酸衍生物的取代度Tab. 2 Substitution of aminobutyric acid-modified chitooligosaccharide
2.2 壳寡糖氨基丁酸衍生物的抗干旱实验
2.2.1 壳寡糖及其衍生物对小麦幼苗丙二醛含量的影响
干旱胁迫会促使植物产生大量的活性氧, 加剧脂质过氧化程度, 而丙二醛作为脂质过氧化的产物之一, 其含量代表膜过氧化程度[7]。干旱胁迫下壳寡糖、γ-氨基丁酸及其衍生物等对小麦幼苗丙二醛含量的影响如图5所示, 干旱胁迫下(drought)小麦幼苗中的丙二醛含量较正常对照组(control)高 52.9% (P<0.05,下同), 而经过 γ-氨基丁酸、壳寡糖、衍生物等浸种处理后都明显降低了小麦幼苗叶片中丙二醛含量,分别较干旱胁迫组低 4.2%、17.4%、12.6%, 三个处理组之间的差异均显著(P<0.05)。综上, COS 1K组、1K-G组作用效果好于 G组。研究表明, 壳寡糖 γ-氨基丁酸衍生物可以显著降低丙二醛含量, 缓解干旱胁迫对小麦幼苗的活性氧损伤。

图5 壳寡糖及其衍生物处理对干旱胁迫下的小麦幼苗叶片丙二醛含量的影响Fig. 5 Effect of chitooligosaccharide and derivatives on malonaldehyde (MDA) of wheat leaves under drought stress
2.2.2 壳寡糖及其衍生物对小麦幼苗细胞膜透性的影响
干旱胁迫会造成大量活性氧的产生, 而这些过量的活性氧会进一步损伤细胞膜, 从而造成细胞膜透性增加[22], 细胞内的电解质大量外渗从而导致电导率增加, 所以小麦幼苗细胞膜透性通常用相对电导率表示。壳寡糖及其衍生物对小麦幼苗细胞膜透性的影响如图6所示, 干旱胁迫下(drought)小麦细胞膜透性较正常对照组(control)高 41.8%(P<0.05), 而小麦种子经过不同物质浸种处理后小麦幼苗的细胞膜透性会显著下降。结果如图所示, 各处理除了COS 1K组之外与干旱组之间存在显著性差异, 细胞膜透性分别较干旱组低 11.2%、24.5%(P<0.05), 1K-G处理组甚至降低到正常组水平以下。可知, 壳寡糖 γ-氨基丁酸衍生物可以缓解干旱胁迫对细胞膜的损伤程度, 作用效果明显好于其他处理组。

图6 壳寡糖及其衍生物处理对干旱胁迫下的小麦幼苗叶片细胞膜透性的影响Fig. 6 Effect of chitooligosaccharide and derivatives on cell membrane permeability of wheat leaves under drought stress
2.2.3 壳寡糖及其衍生物对小麦抗氧化酶活性的影响
过量活性氧的清除主要通过酶促清除系统和非酶促清除系统[16,23], 其中酶促清除系统包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等; 非酶促清除系统包括抗坏血酸、谷胱甘肽、维生素E、甘露醇等。本研究测定了超氧化物歧化酶、过氧化氢酶和过氧化物酶活性。壳寡糖及其衍生物对小麦幼苗抗氧化酶的影响如图 7所示, 干旱胁迫下(drought)SOD和POD的活性显著上升, 分别较正常组(control)高 23.1%、96.9%(P<0.05), 干旱胁迫下CAT的活性较正常组没有显著变化。
各处理组对小麦叶片中 SOD活性的影响分析:经过G、COS 1K、1K-G处理后, SOD的活性与正常组有显著性差异(P<0.05), 活性均明显提高, 1K-G和COS 1K效果强于G, 但均小于干旱胁迫组; 各处理组对小麦叶片中CAT活性的影响分析: 经过G、COS 1K处理后, CAT活性与正常组和干旱胁迫组没有明显差异(P>0.05), 1K-G处理后与正常组有显著性差异, CAT活性提高 36.7%(P<0.05), 与干旱胁迫组没有明显差异; 各处理组对小麦叶片中POD活性的影响分析: 经过G、1K-G处理后, POD活性较正常组分别高61.2%、48.8%(P<0.05), 经过COS 1K处理后,POD活性与正常组无明显差异。

图7 壳寡糖及其衍生物处理对干旱胁迫下的小麦幼苗叶片超氧化物歧化酶(a)、过氧化氢酶(b)、过氧化物酶(c)的影响Fig. 7 Effect of chitooligosaccharide and derivatives on superoxide dismutase (a), catalase (b), and peroxidase (c) of wheat leaves under drought stress
2.2.4 壳寡糖及其衍生物对小麦光合色素含量的影响
光合色素的含量会因外界环境变化而变化, 与植物进行光合作用的强度有关。壳寡糖及其衍生物对小麦叶片中光合色素含量的影响如表 3所示, 干旱胁迫下(drought)小麦叶片中叶绿素a、叶绿素b和类胡萝卜素含量分别较正常对照组(control)高 5.6%、11.1%、6.0%(P<0.05), 而叶绿素a /叶绿素b较正常对照组低5.4%(P<0.05)。
各处理组对小麦叶片中叶绿素 a的影响分析:干旱胁迫增加了叶绿素 a的含量, 而经过不同物质处理后叶片中叶绿素 a的含量较干旱胁迫(drought)组低, 逐渐接近正常组(control), G、COS 1K、1K-G处理组叶绿素a含量分别较干旱组低2.5%、1.5%、4.5%(P<0.05); 各处理组对小麦叶片中叶绿素b的影响分析: 干旱胁迫增加了叶绿素b的含量, 而经过不同物质处理后叶片中叶绿素 b的含量较干旱胁迫(drought)组低, 逐渐接近正常组(control), G、COS 1K、1K-G处理组叶绿素 b含量分别较干旱组低4.4%、1.9%、6.3% (P<0.05); 各处理组对小麦叶片中叶绿素a /叶绿素b的影响分析: 干旱胁迫降低了叶绿素a /叶绿素b的值, 而经过不同物质处理后叶片中叶绿素a /叶绿素b的值较干旱胁迫(drought)组高,逐渐接近正常组(control), G、COS 1K、1K-G处理组叶绿素a /叶绿素b的值分别较干旱组高2.5%、2.5%、1.7%(P<0.05)。
2.2.5 壳寡糖及其衍生物对小麦叶片中脯氨酸和可溶性糖的影响
脯氨酸和可溶性糖可以作为植物中渗透调节物质存在, 调节细胞渗透势进而缓解干旱胁迫。图8显示的是干旱胁迫下壳寡糖及其衍生物处理的小麦叶片脯氨酸和可溶性糖的含量, 子图 a是对脯氨酸的含量的影响, 子图b是对可溶性糖含量的影响。干旱胁迫(drought)下脯氨酸含量较正常对照组(control)高368.4%(P<0.05), 干旱胁迫下(drought)可溶性糖含量较正常对照组(control)低46.8%。从图7中子图a、b可知, 不同物质浸种处理对于小麦叶片中两种渗透调节物质的影响不同, 经过COS 1K处理后脯氨酸含量较干旱组增加 15.3%(P<0.05), 而经过 G和 1K-G处理后脯氨酸含量较干旱组稍低分别低6.3%、10.2%,但是较正常组提高338.8%、320.7%; 经过G、COS 1K处理后可溶性糖的含量较干旱组增加 4.3%、19.8%(P>0.05), 经过 1K-G处理后可溶性糖的含量较干旱组增加 54.3%(P<0.05)。可知, 壳寡糖 γ-氨基丁酸衍生物对可溶性糖含量的影响大于对脯氨酸含量的影响, 其中壳寡糖衍生物提高小麦叶片可溶性糖含量的效果较其他处理组显著。
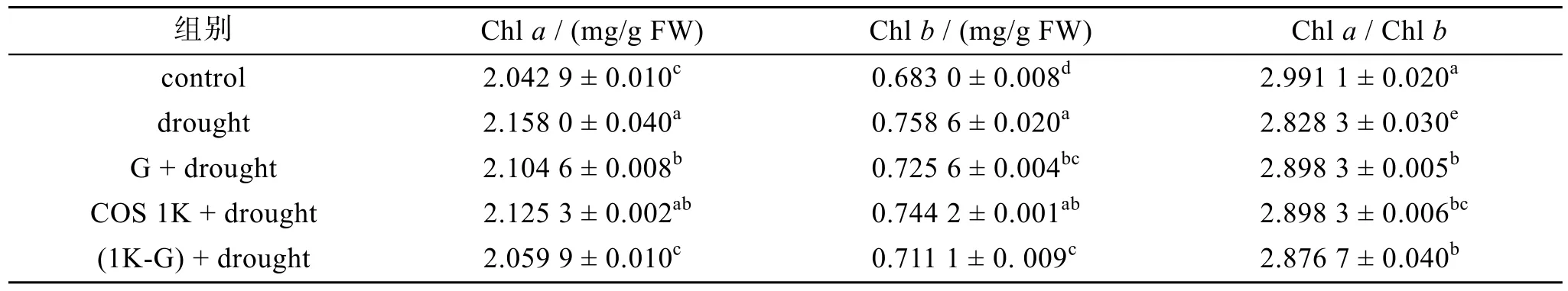
表3 壳寡糖及其衍生物处理对干旱胁迫下的小麦幼苗叶片光合色素含量的影响Tab. 3 Effect of chitooligosaccharide and derivatives on photosynthetic pigment content of wheat leaves under drought stress

图8 壳寡糖及其衍生物处理对干旱胁迫下的小麦幼苗叶片脯氨酸(a)、可溶性糖(b)含量的影响Fig. 8 Effect of chitooligosaccharide and derivatives on proline content (a) and soluble sugar content (b) of wheat leaves under drought stress
3 讨论
本研究合成的新型壳寡糖 γ-氨基丁酸衍生物对小麦浸种可以提高小麦对出苗期干旱的抵抗能力,且作用效果较壳寡糖和γ-氨基丁酸显著。
植物体内存在天然的清除活性氧的系统, 如一些抗氧化酶SOD、CAT等, 使活性氧维持动态平衡,但是当植物遭受逆境时活性氧代谢就会失调, 产生加快而清除降低, 致使大量活性氧的积累[16], 过量的自由基会对植物造成损伤, 损伤细胞结构和功能,抑制植物生长, 诱发膜脂质过氧化, 产生大量的丙二醛, 造成质膜流动性降低、透性增加, 破坏植物内的蛋白质(酶)、核酸等生物大分子[15]。
本研究结果显示干旱增加了丙二醛的含量(图5)和细胞膜透性(图 6), 经过衍生物等物质处理后可以显著降低丙二醛含量和细胞膜透性, 衍生物处理的细胞膜透性显著低于壳寡糖和氨基丁酸处理, 而丙二醛含量显著低于氨基丁酸处理、高于壳寡糖处理,实验证明1 000 Da壳寡糖可以明显提高多种抗氧化酶基因的表达[24], 衍生物处理的丙二醛含量高于壳寡糖处理可能是因为衍生物对不同种抗氧化酶活性的影响不同, 总体上清除活性氧的能力不如壳寡糖,导致丙二醛含量较高, 具体原因需要实验验证。理论上来说, 部分外源物的施用会增加抗氧化酶的活性清除植物体内因外界胁迫而产生的过量的自由基,降低丙二醛含量和质膜透性, 缓解对细胞膜的损伤。例如外源的 γ-氨基丁酸增加了干旱胁迫下甜瓜幼苗的抗氧化酶 SOD、CAT等活性, 降低了丙二醛含量和质膜伤害度[4], 降低了盐胁迫下玉米幼苗的超氧阴离子和丙二醛含量[25]。又如硫酸盐壳寡糖[24]可以通过增加超氧化物歧化酶、过氧化物酶、过氧化氢酶、抗坏血酸过氧化物酶活性, 降低丙二醛含量。这些文献都证实了这一观点。但是本研究测定了三种抗氧化酶活性(图 7), 结果显示除 CAT外, SOD和POD的活性与干旱组相比不同物质处理后并没有显著提高。考虑可能是由于本研究从播种开始就进行了干旱胁迫处理, 在整个生长到两叶一心期的时间都处于胁迫环境, 处理组植株体内的活性氧逐渐趋于平衡, 而未经处理的植株活性氧继续积累[26]从而促进抗氧化酶活性增加。邹平[24]研究发现不同分子量的壳聚糖处理会显著增加盐胁迫下小麦叶片的SOD、CAT、POD的活性, 且1 000 Da的壳寡糖有最显著的影响。李艳[27]发现低聚壳寡糖可以提高干旱胁迫下油菜叶片中的 SOD、POD活性。因此, 丙二醛含量降低以及细胞膜透性的降低是活性氧清除系统累积清除后的结果。这两个实例均是在植株生长到稳定的状态后进行短期的胁迫处理, 目前猜测抗氧化酶活性变化可能和本研究的测定时间有关,具体的原因有待探究。
光合作用中重要的一个阶段——光反应的发生需要叶绿体中的光合色素参加, 将光能转化成化学能。研究发现短期内的盐胁迫[24]和干旱胁迫[26]可以显著降低植物叶片中的叶绿素含量, 而经过壳寡糖[28]、水杨酸[26]、脱落酸[26]和多胺[29]等处理后光合色素含量显著增加。但是本研究出现了不一样的结果, 干旱胁迫一段时间后增加了叶绿素 a和叶绿素b的含量(表3), 降低了叶绿素a /叶绿素b的值, 可能的原因是出苗期的持续干旱使得叶片含水量低从而造成叶绿素含量浓缩而含量升高。
脯氨酸和可溶性糖属于植物内的渗透调节物质,据文献记载渗透调节物质还包括糖醇、甜菜碱、有机酸、钙离子、钾离子、氯离子等[30], 这些溶质的增加可以提高细胞对外界水分吸收的膨压, 增强植物对水分的主动吸收能力, 增加植物水分利用率, 从而最大限度的减少干旱的有害影响[30]。当植物处于干旱环境下, 脯氨酸和可溶性糖的增加[30-31]可以缓解胁迫对植物的影响。本研究测定了脯氨酸(图 8a)和可溶性糖(图 8b)的含量, 结果显示脯氨酸在正常状态下积累特别少, 可溶性糖在正常情况下积累量很大, 经过干旱胁迫处理后脯氨酸含量急剧上升,可溶性糖含量降低。而经过不同物质处理后发现:COS 1K可以显著增加脯氨酸含量, 1K-G可以显著增加可溶性糖的含量。由此可见不同物质对脯氨酸和可溶性糖的作用效果不一致, 与多胺及其合成抑制剂[29]对干旱胁迫下幼苗脯氨酸和可溶性糖的含量影响结果类似, 而本研究中的壳寡糖γ-氨基丁酸衍生物对干旱胁迫下小麦幼苗可溶性糖的含量影响更大。
本研究的重点放在干旱胁迫持续到小麦出苗后一个月左右的时间点的生理生化指标变化, 所以相关数据仅代表出苗期的持续干旱对小麦幼苗期的影响, 只是从几个指标简单的评价了各种物质的抗旱活性与小麦整个生长期还是会有一定的差别, 所以要想确定对小麦整个生育期的影响还需进行大田试验。
4 结论
利用酰胺化反应将具有抗旱活性的壳寡糖、γ-氨基丁酸有机合成为一个分子, 以期制备出具有更高抗旱活性的新型化合物, 并通过FT-IR、1H-NMR、13C-NMR证明, 成功地合成了新型壳寡糖 γ-氨基丁酸衍生物, 并且利用衍生物和壳寡糖、氨基丁酸对小麦种子浸种处理后评价抗旱作用, 结果证明新合成的衍生物可以降低丙二醛的含量, 减少其对细胞膜的伤害, 增加可溶性糖的含量提高植物对土壤中少量水分的吸收缓解出苗期持续干旱胁迫对小麦幼苗生长的抑制作用。本研究成功合成了具有较强抗旱作用的新型壳寡糖 γ-氨基丁酸衍生物, 为新型植物抗逆制剂开发提供了思路。
