西北太平洋低纬度区域海水中溶解氨基酸的分布及组成研究
2020-06-03高先池杨桂朋
张 宁, 陈 岩, 高先池, 杨桂朋,
(1. 中国海洋大学化学化工学院, 山东 青岛 266100; 2. 青岛海洋科学与技术试点国家实验室海洋生态与环境科学功能实验室, 山东 青岛 266237)
氨基酸(AAS)遍布海水、颗粒物和沉积物中, 是生物体有机氮(ON)和有机碳(OC)的主要存在形式之一[1], 其合成、降解过程与海洋生物紧密联系, 是自养生物的重要氮源和异养生物的重要碳、氮源, 也是海水中OC和ON的重要储库。作为海洋中半不稳定有机物(semi-labile dissolved organic matter, SLDOM)的代表之一[2-3], AAS是海水中最先被异养生物矿化为二氧化碳的物质[4], AAS的降解会显著降低溶解有机质(DOM)对异养生物的营养价值[5]。溶解氨基酸(THAA)占溶解有机氮(DON)含量的10%左右[6-7], 它的浓度变化受水体中生物代谢、海水运动、水团混合等多种因素的影响。高循环速度、与生物活动高度关联是 THAA的特点, 也是前人将它作为溶解有机物(DOM)的生物可利用性指示剂的原因[8-9], 之前的研究表明, 异养细菌可选择性降解不同种类的AAS, 故可利用 THAA组成变化指示海水中有机质的生物可利用性和降解程度[8]。因此研究海水中THAA的分布、组成及其与环境因子的相关性, 可以反映有机质的降解情况, 对于揭示相应海区有机碳、氮的生物地球化学行为有着重要的意义。
THAA既易受生物活动影响, 又是溶解有机物的重要组成部分, 因此AAS的碳归一化产率(THAA-C%)被广泛用于海洋有机质早期成岩状况的定量描述[10]。随着有机物降解程度的增加, THAA-C%呈降低趋势。THAA-C%此特点可以指示有机物初期的降解状态[11],它可指示有机物在降解过程中的量变。Davis等通过培养实验证明THAA-C%可在20 ~ 30 d内降至初始值的50%, 并认为此参数可以准确表征DOM在降解初期的特征[11]。在THAA的降解过程中, 14种AAS并未表现出协同性, 而是会被选择性的去除或富集, 并且 AAS的来源不同也会导致其组成差异,Dauwe 和 Middelburg发现此现象后运用主成分分析法(PCA)总结出降解因子(degradation index: DI), 从组成变化角度入手描述这种差异[8]。DI值范围通常为-1~1.5, 越接近范围下限代表DOM被降解的程度越大, 样品中AAS可能来源于陆源或深海DOM; 越接近1则代表样品遭受降解的程度越轻, 组成越接近海源现场生产的 DOM[8,12]。相对于常用于在 DOM 降解初期使用的 THAA-C%,DOM 降解的中期更宜使用 DI值表征[13-14], 是指示THAA降解过程中组成变化的参数。
西北太平洋低纬度海域的物质交换与能量交换强度非常高, 是研究热带海域中物质与环境关系的典型区域[15-17], 此处水团和环流是区域内能量交换的重要载体, 也是水体分配的主要推动者[18-20]。国际上对溶解态氨基酸的研究开展较早[21-23], 而国内对河流及近岸海域海水中 THAA的调查也在不断增加[24-26], 但关于西北太平洋低纬度区域的 THAA的研究截至目前尚未被广泛报道。本文选取西北太平洋低纬度海域为研究对象, 调查了该区域中 THAA的浓度分布及组成, 探讨了 THAA与溶解有机碳(DOC)、叶绿素(Chl a)、海流等环境因子的关系, 并运用基于氨基酸组成的降解因子DI和THAA-C%对该海域有机质的降解情况进行了分析。
1 材料和方法
1.1 采样区域
于2018年10月5号至11月6号搭乘“科学号”对西北太平洋低纬度区域上层海洋(5~200 m)进行取样, 本文取样层为5层, 分别为5 m、50 m、叶绿素最大层(Subsurface chlorophyll maximum, SCM, 深度约为100 m)、150 m、200 m。图1(a)显示出本次航次取样的两个断面24个站位。图1(b)展示出西北太平洋低纬度区域表层的基本环流结构。根据前人文献将 E系列站位中的 2°N—5°N划为 HE区, 5°N—7°N 为 NECC 区, 7°N—9°N 为 ME 区, 9°N—14°N 为MC区, 14°N—21°N为NEC区, 此外, 图中未标注的南赤道流在0°N—5°N处也有影响。
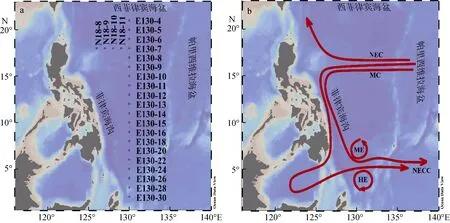
图1 2018年秋季西北太平洋低纬度区域调查站位(a)、海流(b)示意图Fig. 1 Schematic of survey stations (a) and currents (b) in the low-latitude area of the Northwest Pacific in the fall of 2018
1.2 样品采集和保存
海水采集通过10 L Niskin Rosette 采水器进行采集, 水样采集后立刻使用Whatman GF/F滤膜进行低压过滤, 滤液转移至硼硅玻璃瓶(450℃高温灼烧4 h)中, 滤膜放于用铝箔纸包裹的离心管中, 滤液、滤膜置于-20℃环境冷冻保存。温度、盐度数据由CTD现场测得。GF/F滤膜、样品瓶、铝箔等均在450℃条件下高温灼烧5 h以除去有机碳。
1.3 样品分析
1.3.1 THAA的测定
样品采用实验室已建立的邻苯二甲醛-巯基丙酸(OPA-MPA)柱前衍生高效液相色谱法测定[27]。流动相: A是0.05 mol/L的乙酸钠缓冲溶液(pH = 7.2 ± 0.05),且乙酸钠溶液∶四氢呋喃 = 99∶1; B为甲醇∶乙腈∶水(v/v/v)=1∶1∶1。流动相均需通过 0.2 μm (PALL Supor-450)聚醚砜滤膜除去颗粒物。色谱柱为Agilent ZORBAX Eclipse 氨基酸分析柱, 测样时使用梯度分离。氨基酸标准图如图2。
取2 mL海水样品与2 mL优级纯浓盐酸(12 mol/L)混合于5 mL安瓿瓶, 加入40 μL 20% (w/v)抗坏血酸,通入高纯氮气1 min除去空气, 密封后, 在110 ℃环境下高温水解 22 h。水解完毕后取 2 mL水解液在60℃下进行真空旋转蒸发旋蒸, 向蒸干后的样品中加入1 mL Milli-Q水, 超声振荡2 min使样品再溶解。取再溶解的溶液760 μL和衍生化试剂(3-MPA溶液)240 μL混合后避光衍生化19 min后, 进样测定,测得浓度即为样品中THAA浓度。

图2 氨基酸标准的液相色谱图 (0.5 μmol/L)Fig. 2 Chromatogram of the amino acid standards (0.5 μmol/L)
1.3.2 DOC的测定
海水样品使用Whatman GF/F玻璃纤维滤膜(d =47 mm)进行低压过滤, 转移至硼硅玻璃瓶中-20℃冷冻避光保存。带回实验室后使用岛津总有机碳分析仪 TOC-VCPH测定 DOC, 选用的催化剂和分析方法分别为 Pt催化剂、高温催化氧化法。DOC样品在680℃下平行进样3~5次后取其平均浓度, 该方法测定的相对标准偏差 < 2%。仪器空白经迈阿密大学Hansell实验室低碳水校正。
1.3.3 Chla的测定
定量过滤300 mL海水样品, 滤膜快速置入15 mL离心管内-20℃冷冻保存。测定时在存放有膜样的离心管中加入 90% (v/v)的丙酮水溶液, 避光冷藏萃取24 h, 使用SC-3610离心机进行低速离心, 离心后取离心后的上清液使用日立F-4500荧光分光光度计测定, 测定前需使用Jeffrey-Humphrey方程式对二级母液进行校正, 该方法的最低检出限为0.01 μg/L。
1.3.4 DIN的测定
将海水样品通过 Whatman GF/F玻璃纤维滤膜(d = 47 mm)进行低压过滤后转移至聚乙烯瓶中, 在-20℃条件下冷冻保存。带回实验室后, 立即使用Seal Analytical AA3营养盐自动分析仪进行分析, 测得-N、-N、-N, DIN为- N、N、N三种形态N的总和。检出限0.04 μmol/L,检出限 0.003 μmol/L,检出限0.02 μmol/L; 测定精密度小于3%。
2 结果和讨论
2.1 西北太平洋低纬度区域海水中THAA、Chl a、DOC的水平分布特征
各站位海水中THAA、Chla、DOC的浓度范围列于表1。

表 1 西北太平洋低纬度区域表层海水中(5 m)THAA、Chl a、DOC的浓度范围Tab. 1 Concentration range of THAA, Chl a, and DOC of surface seawater (5 m) in the low-latitude area of the Northwest Pacific
在该调查海域, 表层海水(5 m)中THAA、Chla、DOC的浓度范围列于表1, 该海域THAA浓度结果明显低于春季北黄海表层海水[25]、南海北部表层海水[28]、东海表层海水[29-30], 高于同处西北太平洋的日本伊势湾海域的表层浓度[31]。表层THAA浓度从南至北呈现出低-高-低-高的趋势, 整体浓度低于中国近海[19,28-30]。THAA高值区出现在NEC区和ME区,NEC分叉点随深度的降低向南偏移, 分叉点年平均位置在14°N且在10月份会北移[32-33], 此处高值区的出现原因可能是因为自东向西的NEC携带有高浓度的THAA向上扩散导致的; DI值和THAA-C%结果表明, ME高值区处降解程度较大, 且此处未存在Chla高值但存在DOC高值, 推测此处高值并非是浮游植物现场生产, 而是由于陆源输入所致; 2°N—6°N 是THAA低值区, 而Chla在此处出现高值, 后文DI、THAA-C%表明该区域有机物的降解程度很高, 可能是由于此处温度、光照条件促进了THAA的细菌降解和光降解, 另一个原因可能与ME上升流有关, 前人证明此处存在 Ekman抽吸引起的上升流[34], 上升流将下层低浓度、高降解程度的THAA带到表层也是产生此现象的原因之一。此次航次测定Chla的浓度低于中国近海[25,28-30,35]的Chla浓度, 与齐雨藻报道的西太平洋浓度近似[36]。Chla的浓度从南到北呈下降趋势, 出现此现象可能是因为中部和北部的寡营养盐状态是此处浮游植物生长的主要限制因素,而 NECC携带的大量营养盐支持了南部浮游植物的生长; DOC的水平分布不均匀, 在9°N出现浓度最大值, 11°N 出现浓度最小值。在 1°N—9°N 和 11°N—21°N 均呈现为升高趋势, 且 9°N 以南的平均浓度(1.24 ± 0.44 μmol/L)大于 11°N 以北的平均浓度(1.02± 0.18 μmol/L)。在 ME 高值区存在 THAA 高值, 而在此区域并未出现Chl a、DIN、T、S等参数的高值, 猜测此处DOC、THAA的高值可能是亚洲风尘带入所致[37-38]。
将THAA、DIN、Chl a、DOC等参数进行相关性分析, 结果显示均不存在显著相关性。这可能是因为 THAA作为 SLDOM的重要组分, 其产生、循环与降解会受到浮游生物、光照、温度、DO、水团运动等诸多因素的影响。此海域氨基酸碳/溶解有机碳(即 THAA-C%)较低, THAA的浓度降低并不能引起DOC浓度的显著变化, 这可能是 THAA与 DOC未呈现显著相关性的原因之一。结合该海区内海流复杂、初级生产力低、光照强烈的具体情形, 各环境因子对 THAA施加的影响可能是多因素协同作用, 因而THAA的浓度与单一参数不呈显著相关。
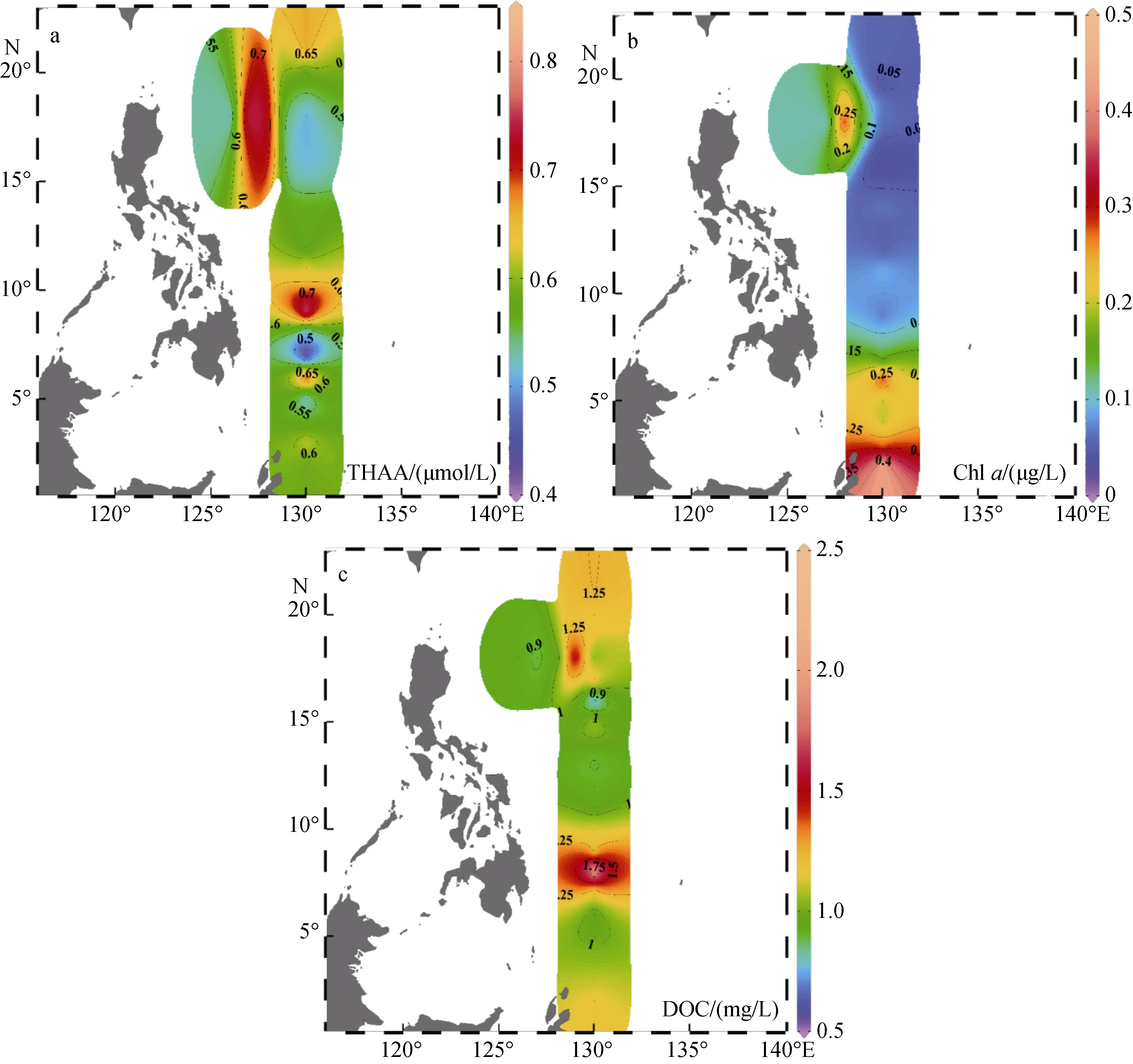
图3 西北太平洋低纬度区域表层海水中THAA(a)、chl a(b)、DOC(c)的水平分布Fig. 3 Horizontal distributions of THAA (a), Chl a (b), and DOC (c) in surface seawater of the low-latitude Northwest Pacific
2.2 西北太平洋低纬度区域 130°E断面上层海洋中THAA、Chl a、DOC的垂直分布特征
为了探究各个环流对西北太平洋低纬度区域上层海水中 THAA 分布的影响, 我们设置了在 130°E上2°—21°N区域内的10个站位进行垂直(5 ~ 200 m)方向的采样调查。此处区域是海流密集区, THAA、DOC、Chl a的分布受到了海流的强烈影响。E断面THAA、Chl a、DOC的垂直浓度分布列于表2。

表 2 西北太平洋低纬度区域垂直断面(E)中 THAA、Chl a、DOC的浓度范围Tab. 2 THAA, Chl a, and DOC concentration ranges at vertical section (E) of the low-latitude Northwest Pacific
图4(a)为该断面温度的垂直分布图, 由图可知在ME区存在上升流, 且该水域的水体温度分层明显,图 4(b)中可看出该海域为高盐度海域, 盐度分布平均,表层的盐度略低于下方水体。由表 2和图 4(c)可知,该海域 THAA浓度较低, 但高于同为低生产力的楚科奇海[39], 介于西北太平洋与伊势湾浓度之间[31], 此处低 Chla浓度反映出低初级生产力, 这与 THAA、DOC整体浓度较低相吻合。在图4(a, c)中可以看到THAA 的低值区和 ME 上升流区重合(0°N—9°N,50 ~ 200 m深处), 该处THAA-C%低于临近区域, 表明此处有机质已遭受了较长时间的初期降解, 由于较低的水温更适宜异养生物生长[40-42], 强烈的细菌降解作用可能是此处THAA主要的去除途径。THAA的浓度在 9°N—21°N真光层内随深度增加而逐渐增加, 表层的高温和寡营养盐状态共同限制了浮游植物的生长[36-37], 浮游植物生长受限、光降解[43-44]与细菌降解三者共同作用使表层THAA呈现低浓度。而在表层水以下, THAA浓度转高, 这可能是由于上层浮游植物死亡后的沉降过程会发生自溶和异养细菌分解作用转化为 THAA[29], 且溶解氧浓度随深度增加而降低, 这也会限制THAA的细菌降解[45]。Chla浓度在5 ~ 200 m变化很小, 只在100 m深度附近出现SCM, 该现象出现原因是因为在此深度DIN高于表层, 且大洋区水体透光度高, 能支持热带西太平洋海区适应高盐环境的浮游植物生长[36]。表层浓度低主要是因为开阔大样区域表层寡营养盐且水温高,浮游植物生长受限[37], 而下层 DIN浓度虽较高但缺乏光照, 光限制了浮游植物的生长, 导致Chla浓度较低; Chla的高值区出现在5°N的50 m深, 可能是由于此处的ME伴随的上升流将底部DIN带到该深度, 强烈的光照使得浮游植物旺盛生长所致。DOC浓度整体呈现出随深度增加而降低的趋势, 其高值区出现在10°N附近的0 ~ 50 m, 可能是受到陆风输送的影响[37-38]。
将上层海洋中的THAA、DOC、Chla浓度进行相关性分析, 发现三个参数间并未表现出显著相关性, 这可能是因为三种参数既与生物活动息息相关,又易受到水团输送、光照和陆源输送的影响, 加之此海域海流、水团纷繁复杂互相影响, 导致参数之间互不表现出相关性。
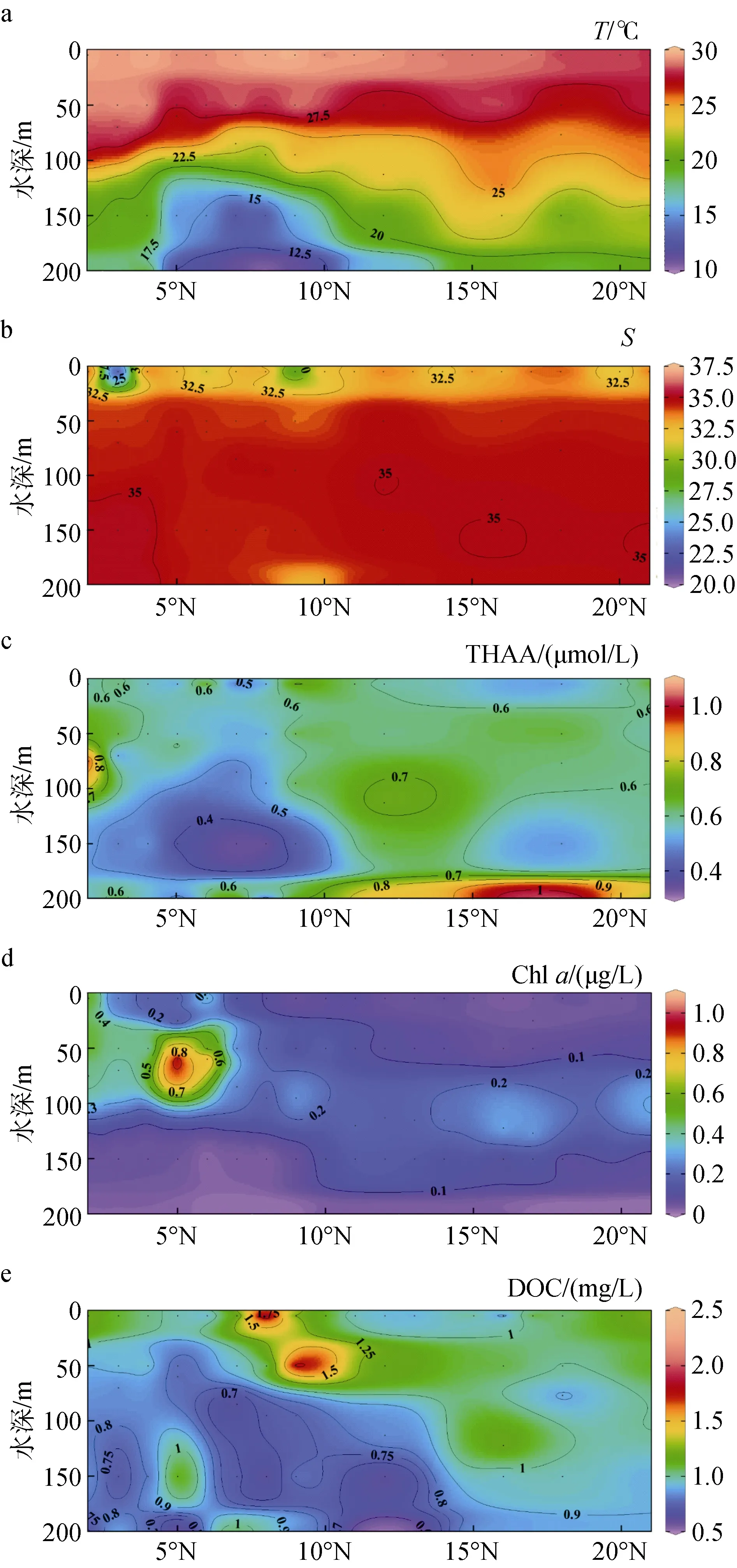
图4 西北太平洋低纬度区域130°E断面上层海洋中水温(a)、盐度 (b)、THAA (c)、Chl a (d)、DOC (e)的垂直分布Fig. 4 Vertical distribution of temperature (a), salinity (b),THAA (c), Chl a (d), and DOC (e) concentrations in the upper ocean on the 130°E Section of the lowlatitude Northwest Pacific
2.3 西北太平洋低纬度区域海水中 THAA的组成
THAA根据侧链基团的不同可分为酸性、碱性、中性、芳香类、含羟基类、含硫氨基酸六类。西北太平洋低纬度区域海水中溶解氨基酸中各单体 AAS的相对组成如图5所示。

图5 单体氨基酸占THAA的摩尔百分比Fig. 5 Monomeric amino acids as a percentage of THAA
测定的14种AAS占比差异较大, 6种优势AAS(Asp、Glu、Ser、Gly、Thr、Ala)的总和可占到 THAA的87.74%, 其中Asp相对占比最高, 可达THAA的22.95%, 这与之前所报道的亚得里亚海[46]的结果相似, 说明在海水体系中 THAA的组成近似。根据董良[47]对西太平洋的研究, 西太平洋海域优势藻类是硅藻, 硅藻细胞的主要构成成分是 Asp、Ser和 Glu等[48], 浮游藻类死亡后的细胞破裂和被浮游动物摄食会将体内的溶解氨基酸释放到周围海水中, 成为THAA的重要来源之一。
各类AAS的平均摩尔百分比如图6所示。它们所占比例大小依次为中性氨基酸 > 酸性氨基酸 >含羟基类氨基酸 > 碱性氨基酸 > 芳香类氨基酸 >含硫氨基酸, 在此处海域中, 中性氨基酸的平均摩尔百分比略高于酸性氨基酸, 这两种氨基酸共占所测14种溶解氨基酸的75.34%, 在此海域中是优势氨基酸。
基于THAA的标准化数据(各单体AAS占THAA的摩尔百分比)做相关性矩阵, 如表 3所示。源自此次的数据显示THAA中有12对氨基酸呈显著负相关(Asp-Ser, Asp-His, Asp-Gly, Asp-Thr, Asp-Tyr, Asp-Ile,Asp-Leu, Glu-Ala, Glu-Leu, His-Gly, His-Ala, Gly-Tyr), 说明这12对个体AAS在海水中的动态行为有所差异; 同时有 15对 AAS呈显著正相关(Ser-Gly,Ser-Thr, Ser-Leu, His-Tyr, His-Thr, Gly-Thr, Gly-Leu,Thr-Tyr, Tyr-Met, Val-Met, Phe-Ile, Phe-Leu, Met-Ile,Met-Leu, Ile-Leu), 这说明15对单体AAS在海水中具有相似的生物地球化学行为。

图6 THAA中酸性、碱性、中性、芳香和含硫氨基酸的平均摩尔百分比Fig. 6 Average mole percent of acidic, basic, neutral, aromatic,and sulfur-containing amino acids in THAA
2.4 利用THAA-C%和DI值指示该海域有机物降解状态
图7 显示了DI值和THAA-C%在西北太平洋低纬度区域表层海水的水平分布, 计算得出 THAAC%值的范围是 0.89% ~ 3.75%, 平均值为 2.25% ±0.61%。相对于浮游植物体中24% ~ 49%的THAA-C%范围[49], 该海域的2.25% ± 0.61%的均值证明此处了初级生产力极低。浮游植物释放出的THAA进入表层海水后, 经历高强度、长时间的光降解与细菌降解[11,49],而低生产力制约了新鲜 THAA的补充, 使表层海水中产生了DOM高降解程度的现象。在此区域内DI值的范围为-2.27 ~ -1.15, 均值为-1.83 ± 0.29, 显著低于中国近海和日本伊势湾, DI与THAA-C%共同证明此区域内的氨基酸已经历了较长时间的降解, 年龄较老。
DI、THAA-C%在该海域的垂直分布如图8所示,其中THAA-C%的范围是0.89% ~ 7.04%, 平均值为2.80% ± 1.05%, 该范围高于楚科奇海[39]、西北太平洋和日本伊势湾[31], 和表层 THAA-C%进行对比发现,50 ~ 200 m深度的THAA相对更“新鲜”, 降解程度低于表层THAA, 由于Chla出现了典型热带性次表层叶绿素最大值, 猜测是次表层生产力更高和光降解程度低于表层所致。在此研究中, THAA-C%的高值区出现在 10°N—21°N(3.32% ± 1.32%, n=15), 低值区出现在 2°N—9°N(2.56% ± 0.78%, n=33), 这个值与日本伊势湾[31]、其他海洋环境[50]中报道的值十分相似。图8(a)显示了该区域内DI值的垂直分布, DI值范围为-2.27 ~ 2.82, 平均值为-1.56 ± 0.74, 低于DI值-1 ~ 1.5的常见范围, 推测该区域的THAA主要来自降解程度较高的物质。DI在5 ~ 200 m深度内随深度增加呈上升趋势, 与 THAA-C%体现出的趋势相同, 这个趋势与以往研究相反, 这可能是由于200 m对大洋而言仅为真光层, 在透光度高的赤道太平洋中, 上层数十米由于光照强烈加速了 THAA的光降解[43-44]、细菌降解[37], 随着深度增加光照强度随之减弱, THAA的光降解受到限制, 导致基于THAA的降解因子反映出上层降解程度高于下层的趋势。据前人的研究, 海洋浮游植物的直接释放并非THAA来源的主要因素[51], 上层浮游植物死亡后的
沉降过程会发生自溶和异养细菌对浮游植物残骸的分解[29], 这两种作用会将颗粒态AAS转化为THAA而增加下方水体中 THAA的浓度, 而下方水体中光降解与细菌降解强度由于光照和 DO等条件的限制要低于上方水体[37,43-44], 导致SCM未与THAA-C%、DI的高值区共同出现。

表3 西北太平洋低纬度区域海水中THAA单体氨基酸相对含量的相关性矩阵Tab. 3 Correlation matrix of monomer amino acid relative abundance in THAA (mol%) in seawater of the low-latitude Northwest Pacific
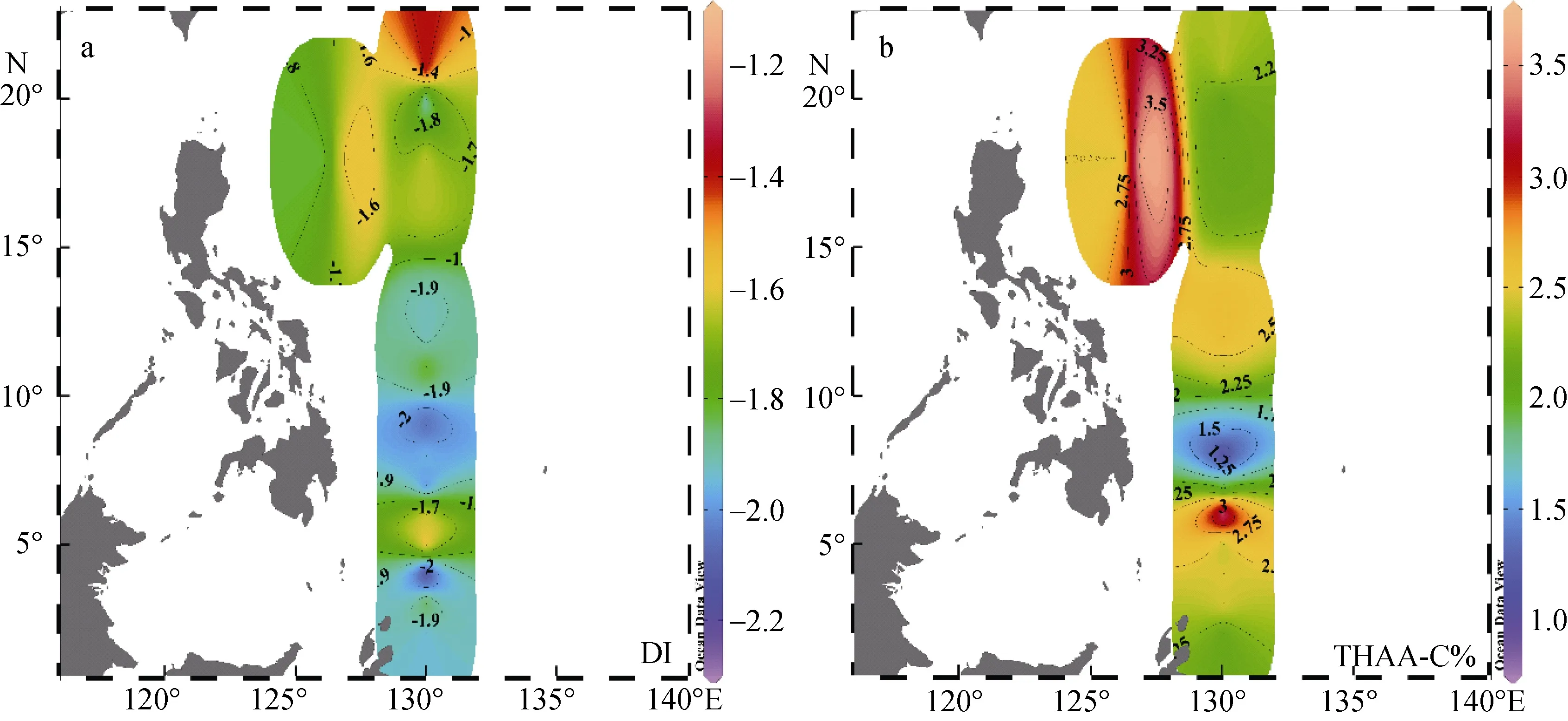
图7 西北太平洋低纬度海域中DI值 (a)和THAA-C% (b)的水平分布Fig. 7 Horizontal distributions of DI (a) and THAA-C% (b) of the low-latitude Northwest Pacific
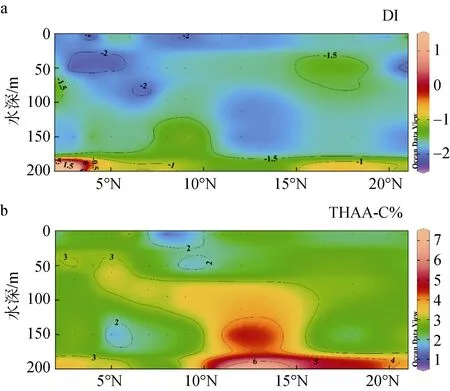
图8 西北太平洋低纬度海域130°E断面上层海洋中THAAC%(a)、DI(b)值的垂直分布Fig. 8 Vertical distribution of THAA-C% (a) and DI (b) in the upper ocean (5~200 m) on the 130°E Section of the low-latitude Northwest Pacific
3 结论
西北太平洋低纬度区域表层海水中THAA的浓度范围为 0.40~0.97 μmol/L, 平均值为 0.58 ± 0.14 μmol/L。THAA整体分布较均匀, 浓度显著低于中国近海。在近陆NEC区存在高值区, 陆源输入、以海流为代表的水团运动、浮游植物现场生产等是此海域 THAA的来源, 光降解、细菌降解是此海域 THAA的去除途径。西北太平洋低纬度区域 5 ~ 200 m 海水中THAA的浓度范围是0.30 ~ 1.05 μmol/L, 平均值是0.59 ± 0.16 μmol/L。细菌降解作用随深度增加而减弱和颗粒物沉降过程中的再溶解是使得该海域上层海洋(5 ~ 200 m)中THAA浓度随深度增加而增加的原因, 而降解因子DI值的变化规律也证明了这一点。对该海域的 THAA组成进行分析后得出, 优势氨基酸为 Asp、Glu、Ser、Gly、Thr和 Ala, 共占 THAA的 87.74%, 优势氨基酸种类与该海域的优势藻类—硅藻有关。THAA与DOC、Chl a等环境参数之间均不存在显著相关性, 这可能是因为 THAA受到了生物和环流的多重影响, 各环境因子对 THAA施加的影响可能是多因素协同作用, 而具体的影响机制尚需进一步研究。计算得出的两种降解因子THAA-C%和DI表明, 该海域的DOM生物可利用性远低于近岸海域, 略高于伊势湾外的西北太平洋、楚科奇海等海域, 证明 DOM 已遭受较大强度的降解, 且在 5 ~200 m 的深度范围内, 随深度的增加, 有机质相对更“新鲜”。
