姜黄素药物代谢动力学评价与抗卵巢癌药效作用模拟分析
2020-06-03谢海源唐亚平陆青玉何美英
谢海源,黄 巍,唐亚平,李 清,陆青玉,何美英,范 蓉
广西中医药大学基础医学院,南宁 530200
中药姜黄形似姜、色黄,性温,味辛苦,归肝、脾经,具有行气散滞、活血化瘀之功效,主要含有姜黄素类成分、挥发油类成分等,现代研究表明姜黄具有抗肿瘤、抗炎、抗氧化、降血糖、抗病毒等多种药理活性[1]。姜黄素是中药姜黄中最重要的抗癌物质之一,是从姜黄根茎中提取得到的黄色色素,其母核结构为二苯基庚烃,能靶向多个肿瘤基因蛋白、多条肿瘤相关信号通路,有望治疗癌症等恶性疾病[2]。姜黄素抗卵巢癌效果显著,已引起国内外专家学者的广泛关注,Pang等[3]利用流式细胞术检测发现姜黄素能明显抑制卵巢癌的细胞增殖,促进肿瘤细胞凋亡。目前多项针对姜黄素类化合物的抗肿瘤研究已进入临床试验阶段,因此靶向姜黄素的制药研究,具有良好的应用前景和可行性。
现代医学研究表明卵巢癌等恶性肿瘤疾病,是由多种遗传、非遗传因素,多个靶点、通路引起的复杂性疾病,而中药活性成分往往具有多靶点、多功效的药理作用特点,传统的“一个靶点,一种疾病,一个药物”的研究模式,已很难系统、整体地阐明中药活性成分对复杂疾病的药理作用机制[4]。随着计算机辅助药物设计和分析等新理念的相继提出,为中药及其活性成分研究带来了新的技术与方法,其系统性、整体性的研究理念与中药活性成分多靶点、多途径、协同作用等特点不谋而合。本研究基于计算机模拟分析的研究思路与方法,从系统网络层面研究姜黄素对卵巢癌细胞增殖能力的影响,规避传统实验研究的盲目、不系统、耗费高、耗时长等弊端,有助于揭示姜黄素分子生物学药理机制。
1 材料与方法
1.1 活性成分选取
在Chemicalbook数据库(https://www.chemicalbook.com)获取姜黄素三维结构等信息,并利用ChemBio3D Ultra 14.0软件的MM2下的Minimize Energy模块将姜黄素结构能量最小化。
1.2 药物代谢动力学评价
用SwissADME服务器分析姜黄素原型的药代动力学参数,探讨姜黄素的成药性、血脑屏障透过率、胃肠吸收、以及肝药酶抑制等药物代谢动力学参数。
1.3 姜黄素靶点预测
本研究通过数据库检索和分子构效关系找靶两种策略,挖掘姜黄素潜在的作用靶点。首先,将姜黄素导入STITCH化合物-靶蛋白关联网络数据库(http://stitch.embl.de/),设置参数为“highest confidence = 0.9”高置信度,利用数据库挖掘的方法寻找姜黄素潜在靶点。其次,利用SwissTarget Prediction靶点搜寻服务器(http://www.swisstargetprediction.ch/),基于姜黄素分子结构,反向寻找其潜在药效靶点。最后,将两种方法挖掘的得到的靶点整合,建立姜黄素潜在靶点集合。
1.4 卵巢癌相关基因集合的构建
运用GeneCards、DisGeNET、OpenTargets数据库检索获取卵巢癌相关基因。将以上数据库获取的卵巢癌基因按照相关程度打分score值从高到低排列,依次取评分高的前100个基因,筛除重复后合并,构建卵巢癌基因集合。
1.5 姜黄素靶点-卵巢癌基因关联网络构建
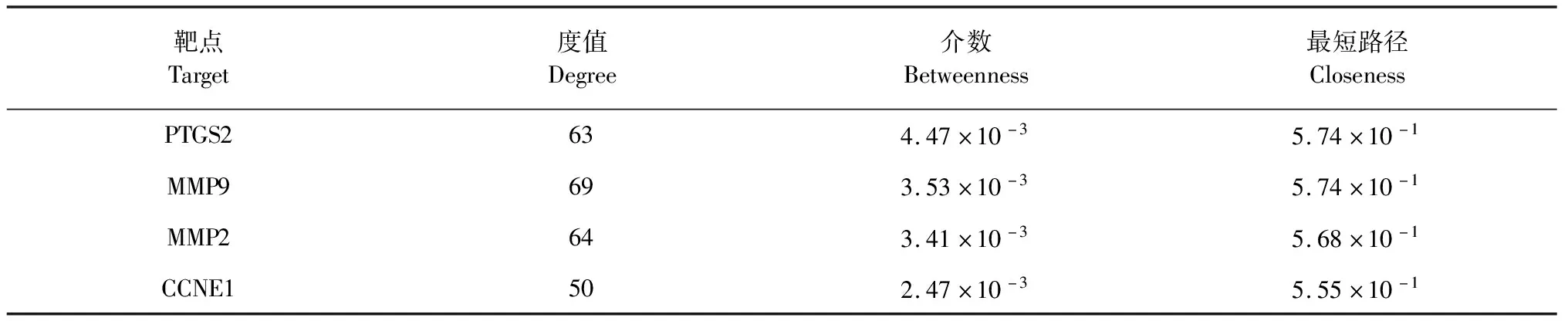
利用STRING数据库构建“姜黄素靶点-卵巢癌基因”相互作用网络,定义来源为“Homo sapiens”(智人)进行分析,最低相互作用阀值设为“medium confidence = 0.4”中等。网络拓扑参数度值(degree)、介数(betweenness)、最短路径(closeness)中心性是判断一个网络节点重要性的三个主要拓扑参数,度值、介数、最短路径越大,节点在该网络就越重要。本研究以度值、介数、最短路径的“中位数”为临界值,筛选出临界值以上的抗卵巢癌靶点,确定为姜黄素抗卵巢关键靶点,进行下一步研究。
1.6 KEGG通路研究
利用DAVID v 6.8服务器对姜黄素关键抗卵巢癌靶点进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析,筛选出P-value<0.05的癌症通路,研究其抗卵巢癌通路与作用途径。
1.7 靶点分子对接验证
用分子对接服务器SystemsDock和分子对接软件Autodock vina验证姜黄素与主要抗卵巢癌靶点的亲和力大小。SystemsDock是基于Autodock vina分子对接算法的一款高精度对接服务器,运算速度快、准确率高。对接打分(docking score)值代表了配体与受体的亲和力情况,其中docking score<4.25说明分子和靶标亲和力不强,docking score>4.25说明分子和靶标有中等亲和力,docking score>5说明分子和靶标有较强的亲和力,docking score>7说明分子和靶标有强烈的亲和力。
2 结果
2.1 姜黄素药物代谢动力学评价
将姜黄素SMILES代码导入SwissADME服务器,分析了姜黄素原型的药代动力学参数。如表1、图2所示,姜黄素基本符合Lipinski类药五原则,具有较好的成药性和一定的胃肠吸收性,但不能通过血脑屏障,且非P-糖蛋白底物。姜黄素对肝药酶CYP2C9、CYP3A4具有一定抑制性,对CYP1A2、CYP2C19、CYP2D6未表现抑制活性。
续表1(Continued Tab.1)

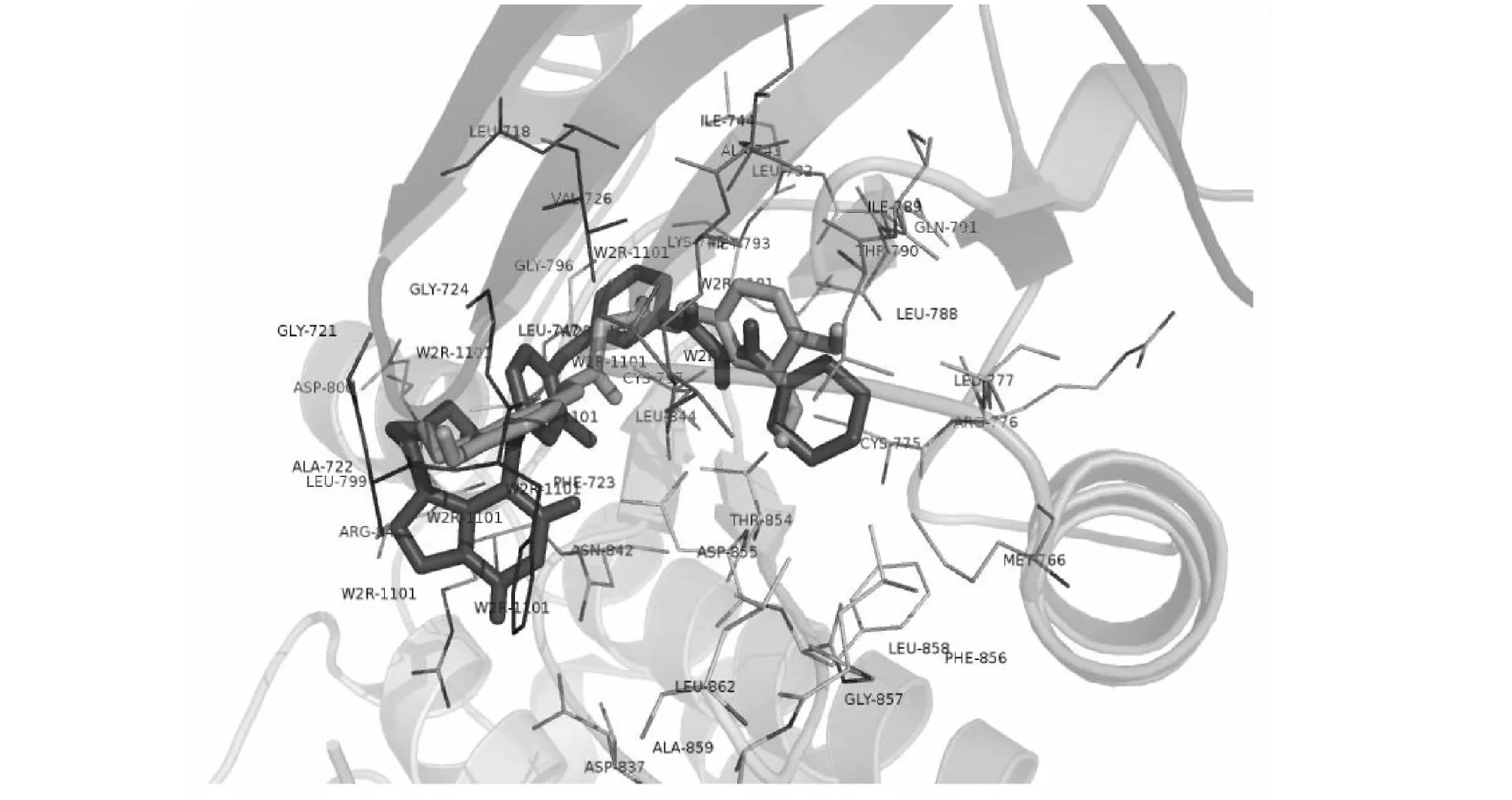
类别Category姜黄素参数Curcuminparameter标准值Standardparameter血脑屏障Blood-brainbarrierpermeant否无胃肠吸收Gastrointestinalabsorption高无P-糖蛋白底物P-glycoproteinsubstrate否无极性TopologicalpolarsurfaceareaTPSA=93.06Å220Å2 图1 姜黄素的药代参数 图2 姜黄素的潜在靶点 如图2所示,利用SWISS服务器和STITCH服务器分别预测得到14个和31个姜黄素潜在靶点,其中重复靶点有2个。姜黄素潜在靶点种类广泛,包括TP53原癌基因、CASP3凋亡基因、HIF1A、AR等细胞因子和激素等,表现出明显的多靶点效应。 以“ovarian carcinoma”为关键词,分别在GeneCards、DisGeNET和OpenTargets数据库搜索与卵巢癌相关的靶基因,提取三个数据库相关分数前100的靶基因并筛除重复,得到174个相关的卵巢癌基因。利用STRING数据库,将43个姜黄素靶点与174个卵巢癌基因构建关联网络。如图3所示,姜黄素靶点与卵巢癌基因能构成了复杂关联网络、含3 753条关联连线,涉及到基因融合、基因共表达等多种关联关系。 图3 姜黄素靶点-卵巢癌基因关联网络 表2给出了姜黄素的主要抗卵巢癌癌靶点及网络数据。可以看到,网络的度值中数为42、介数中数为2.47×10-3、最短路径中数为5.29×10-1。如表2所示,共得到17个姜黄素靶点,度值、介数、最短路径均大于中数“临界值”,以其为姜黄素抗卵巢癌的关键靶点,进行下一步研究。 表2 姜黄素的主要抗卵巢癌癌靶点及网络数据 续表2(Continued Tab.2) 靶点Target度值Degree介数Betweenness最短路径ClosenessPTGS2634.47×10-35.74×10-1MMP9693.53×10-35.74×10-1MMP2643.41×10-35.68×10-1CCNE1502.47×10-35.55×10-1 表3和图4给出了姜黄素17个抗卵巢癌关键靶点的KEGG通路富集结果,可以看到6大类16条与癌症密切相关的KEGG通路(P-value<0.01)被筛选出。具体包括:①肿瘤血管生成相关的缺氧诱导因子-1(HIF-1)信号通路;②肿瘤浸润转移相关的黏着斑(focal adhesion)、黏着斑连接(adherens junction)通路;③肿瘤细胞凋亡相关的p53信号通路、凋亡通路;④肿瘤免疫相关的肿瘤坏死因子(TNF)通路;⑤雌激素通路;⑥肿瘤细胞增殖相关的Cell cycle、PI3K/Akt、Ras、MAPK、ErbB、Jak-STAT、Wnt、FoxO、Rap1等通路。富集结果显示,姜黄素可能通过调节以上KEGG通路,发挥抗卵巢癌的作用。 表3 KEGG通路 图4 KEGG信号通路富集 利用SystemsDock服务器对姜黄素和17个关键抗卵巢癌靶标进行分子对接。从表4可知,姜黄素与17个抗卵巢癌靶标分子的对接分数均大于4.25,姜黄素与EGFR、TP53、AKT1、ERBB2、CASP3、MTOR、STAT3、HIF1A、MMP2、PTGS2等17个靶标均属于有效结核,良好的亲和活性也体现了本研究的可靠性。就其中第一个靶点EGFR为例,图5给出了EGFR抑制剂W2R和姜黄素分子对接对比,从图可以看出姜黄素与EGFR抑制剂W2R作用情况基本类似,能有效结合与EGFR的活性中心,与Leu718、Phe723、Val726、Ala743、Lys745、Met766、Thr790、Met793、Leu844、Thr854、Asp855、Phe856、Gly857等关键的氨基酸残基相互作用,从而抑制EGFR活性达到抗肿瘤的药理效果。 表4 姜黄素分子对接结果 续表4(Continued Tab.4) 核心靶标KeytargetPDB编号PDBID对接打分DockingscoreCASP33GJQ5.126∗∗STAT34ZIA8.212∗∗∗MTOR4JSV4.716∗IGF1R2OJ94.479∗HIF1A1H2M4.788∗AR2PIX7.876∗∗∗PTGS25F196.269∗∗MMP95TH66.538∗∗MMP21RTG6.112∗∗CCNE15L2W6.378∗∗ 注:***非常强相互作用;**强相互作用;*中等相互作用。 Note:***Very strong interaction;**Strong interaction;*Medium interaction. 图5 EGFR抑制剂W2R和姜黄素分子对接对比 卵巢癌的病死率位于妇科肿瘤疾病首位,其发病率位于女性生殖系统肿瘤第三位[5],目前国际公认的卵巢癌一线化疗方案是TC(紫杉醇+卡铂)和TP(紫杉醇+顺铂)方案。由于现有方案疗效有限,化疗药物存在恶心呕吐、骨髓抑制、肝肾损害等毒副作用,严重影响了患者的预后和生存质量[6],因此开发研究新一代高效低毒抗肿瘤药物势在必行。 中药小分子活性物质——姜黄素,能从多个靶点、多个途径实现抗肿瘤作用,已经得到许多实验的证实,研究中药小分子的药代动力学参数、P-糖蛋白转运和肝药酶影响,有助于明确中药小分子与其他临床药物的相互作用和耐药性等,对提高临床用药有效性和安全性大有裨益。研究[7]表明姜黄素口服不易吸收,生物利用度低,但对其是否可能通过P-糖蛋白转运、是否影响肝药酶的活性不甚了解,而且对其生物利用度等缺乏具体的数据可考。 本研究发现,姜黄素基本符合Lipinski的类药五原则,具有较好的成药性和一定的胃肠吸收性,但不能通过血脑屏障,且非P-糖蛋白底物。另外,姜黄素对肝药酶CYP2C9、CYP3A4具有一定抑制性,对CYP1A2、CYP2C19、CYP2D6不具有抑制性。Zhang等[8]建立血脑脊液屏障模型,发现姜黄素为血脑脊液屏障低渗透性药物,通过性较差;Hou等[9]发现姜黄素能抑制CYP3A4的表达;Volak等[10]发现姜黄素对CYP1A2、CYP2D6等肝药酶的影响较小,这些均与本研究结果一致。可见,用计算机模拟来分析中药小分子药代动力学参数,真实性良好、为后续合理开发姜黄素生物药剂提供了参考。 模拟分析表明,姜黄素能直接、间接的调控TP53、CASP3、EGFR、ERBB2、AKT1、MTOR、STAT3、MMP2、MMP9、HIF1A、PTGS2、CCND1等17个卵巢癌相关基因,实现多靶点抗肿瘤效果。Yuan等[11]通过Western blot法检测肿瘤细胞p53(TP53)和caspase-3(CASP3)的表达,发现姜黄素作用48 h后能明显提高肿瘤细胞p53和活化caspase-3含量,诱导肿瘤细胞的凋亡。EGFR与ERBB2均为表皮生长因子受体家族成员,其异常激活能促进SKOV3卵巢癌细胞的恶性增殖[12],Yang等[13]发现姜黄素能促进卵巢癌细胞凋亡,其机制与下调EGFR表达相关。Zhang等[14]发现姜黄素能降低Akt、mTOR(MTOR)蛋白表达水平,抑制T2卵巢癌细胞株增殖,其8 h的IC50为21.2μmol/L。Duan等[15]通过Western blot方法发现姜黄素衍生物能抑制STAT3及基质蛋白酶MMP2、MMP9的表达,剂量依赖性的抑制卵巢癌SKOV3细胞的侵袭和转移。HIF-1α是治疗恶性肿瘤的一个新的靶点,Wan等[16]利用ELISA检测发现姜黄素能抑制人胰腺癌HIF-1α发挥抗肿瘤作用,提示姜黄素可能通过调控HIF1A发挥相似的抗卵巢癌作用。Pan等[17]报道了姜黄素能调控环氧酶2(PTGS2)、G1/S-特异性周期蛋白Cyclin D1(CCND1)、EGFR等抑制卵巢癌的增殖发展。总之,本研究通过关联网络筛选出的姜黄素关键抗卵巢癌靶点与当前许多研究相互佐证,说明姜黄素能通过调控以上“多靶点”来实现抗卵巢癌的作用。 对姜黄素17个核心抗卵巢癌靶标进行KEGG通路富集研究,发现姜黄素能调控肿瘤血管生成、肿瘤浸润转移、肿瘤细胞凋亡、肿瘤免疫、雌激素通路、肿瘤细胞增殖发展等6大类16条信号通路,发挥多途径抗卵巢癌的药理作用。Li等[18]研究发现姜黄素具有抗肿瘤血管的作用,主要是通过HIF-1α、VEGF等途径实现的。Liu等[19]研究表明姜黄素能通过调节黏着斑蛋白含量,抑制肿瘤细胞的迁移、转移,实现抗肿瘤浸润转移的作用。说明姜黄素具有抗肿瘤血管生成、抗浸润转移的作用,且与本研究富集的HIF-1α、黏着斑(focal adhesion)、黏着斑连接(adherens junction)通路相符。Fu等[20]发现姜黄素能通过p53通路调控肿瘤细胞的自噬、凋亡、扩散;Lin等[21]通过实验表明姜黄素能降低TNF-α等免疫因子含量,促进肿瘤细胞凋亡;与本研究的富集结果相似,表明姜黄素能通过调控p53通路、调控免疫因子TNF-α,诱导肿瘤细胞的凋亡。本研究还发现姜黄素能调控Cell cycle、PI3K/Akt、Ras、Rap1、MAPK、ErbB、Jak-STAT、Wnt、FoxO等与肿瘤细胞增殖密切相关的信号通路。Wang等[3]综述报道了姜黄素能靶向p53、Ras、PI3K、AKT等信号通路,具有良好的抗癌效果、且几乎无不良反应。Wang等[22]通过生物信息学技术发现姜黄素主要是通过调控MAPK通路,抑制卵巢癌的发生和发展。Liu等[23]利用荧光素酶检测和免疫印迹技术,发现姜黄素有很强的STAT3信号通路抑制作用,能抑制肿瘤细胞的生长增殖。Zhu等[24]发现Wnt信号通路能介导姜黄素抑制显著肿瘤细胞的增殖分化,临床治疗肿瘤效果确切。Zhang等[25]在研究中发现姜黄素不仅能抑制Akt信号通路活化,还对Akt下游的FoxO信号通路有明显的抑制作用,从而抑制肿瘤细胞活性。综上,姜黄素能通过多条信号通路抑制卵巢癌细胞的增殖发展。为明确本研究靶点的准确性,在SystemsDock服务器对17个关键抗卵巢癌靶标进行分子对接,发现姜黄素与17个靶标均有较好的亲和力,说明本研究靶标预测准确可靠,也进一步反应了本研究关联网络、KEGG通路富集以及最后结果结论的可靠性。 综上,本研究通过计算机模拟分析技术,研究了姜黄素的基本药动学参数,发现其成药性良好;姜黄素能作用于17个核心抗卵巢癌靶标、调控6大类16条抗卵巢癌信号通路,发挥多途径抗卵巢癌药理作用,具有“多靶点-多通路-多途径”抑制卵巢癌的的良好药理作用。本研究为后续姜黄素药理作用机制的探讨以及新型药剂的开发提供了参考。

2.2 姜黄素靶点预测
2.3 姜黄素靶点-卵巢癌基因网络


2.4 KEGG通路富集


2.5 靶点验证


3 讨论
