花生芽中酚类物质的大孔树脂纯化工艺研究
2020-06-02任汐月陈可妍戴京郑义黄镭付晓燕
任汐月,陈可妍,戴京,郑义,黄镭,付晓燕
(武汉设计工程学院食品与生物科技学院,湖北武汉430205)
花生种子发芽后可以作为芽菜食用,称为花生芽,其口感清脆、风味独特,颇受消费者欢迎[1]。花生发芽后,其蛋白质已分解为氨基酸,脂肪含量低,维生素含量全面提高,各种营养成分更易被人体吸收[2]。近年来国内外研究者们在花生中发现了一种生物活性很强的天然多酚类物质——白藜芦醇,它是一种具有广泛保健功能的成分,具有抗菌、抗癌、抗过敏、抗氧化等方面的药理活性[3],花生发芽后其含量大幅上升[2]。
随着对天然产物开发利用越来越多关注,多酚已成为当今科学研究热点[4]。然而其研究与应用需要以多酚的提取分离技术为基础[5],特别是多酚的纯化是研究中不可缺少的环节。天然活性多酚的纯化方法主要有:溶剂萃取法、树脂吸附法、柱层析法、膜技术、高速逆流色谱法等[6]。大孔吸附树脂具有吸附快、解吸快、吸附容量大、易于再生、使用寿命长等优点[7],目前广泛应用于酚类物质的分离和富集,但对花生芽中酚类物质的分离纯化效果尚未见报道。
本研究从7种大孔树脂中筛选出适用于花生芽中酚类物质吸附分离的树脂型号,对其静态吸附-解吸条件和动态吸附-解吸条件进行优化,旨在为花生芽中天然活性物质的深入研究提供技术支撑。
1 材料与方法
1.1 材料与试剂
新鲜花生芽:网购;无水乙醇:北联精细化学品开发有限公司;没食子酸、无水碳酸钠:天津市凯通化学试剂有限公司;氢氧化钠、盐酸:国药集团化学试剂有限公司;福林酚试剂:上海金穗生物科技有限公司;AB-8大孔树脂:郑州勤实科技有限公司;NKA-9、ADS-7大孔树脂:天津市光复精细化工研究所;DM301、X-5、HP-20、S-8大孔树脂:东鸿化工有限公司;以上试剂均为分析纯。
1.2 仪器与设备
电子天平(YP-5002):上海佑科仪器有限公司;恒温水浴锅(B220)、旋转蒸发器(RE-2000A):上海亚荣生化仪器厂;紫外可见分光光度计(UV-2000):尤尼柯(上海)仪器有限公司;pH计(FE20):Metteler toledo公司;循环水式真空泵(SHZ-D):巩义市予华仪器有限责任公司。
1.3 方法
1.3.1 花生芽中酚类物质的提取
称取一定质量的花生芽样品,采用70%乙醇溶液按1∶20(g/mL)料液比于60℃水浴锅中浸提2 h,提取结束后抽滤,滤渣在相同条件下提取2次,合并滤液,使用旋转蒸发仪减压浓缩除去乙醇,得花生芽酚类物质粗提液,按需配制成不同质量浓度的水溶液。
1.3.2 总酚浓度的测定
采用福林酚法。准确吸取0.5 mL样液于25 mL比色管中,加入5 mL蒸馏水,0.5 mL福林酚试剂,混匀后加入20%的Na2CO3溶液1.5 mL,定容至10 mL,在25℃下静置1 h后于765 nm下测定其吸光度,通过标曲计算提取液中总酚浓度(mg/mL)。没食子酸标准曲线方程为 y=0.010 8x+0.003 4,R2=0.999 3。
1.3.3 大孔树脂的预处理
将不同型号大孔树脂分别置于无水乙醇中活化,不断搅拌除去气泡,静置24 h,充分溶胀后,用蒸馏水洗至无醇味。先后使用2%NaOH溶液及5%HCl溶液洗涤,再用蒸馏水洗至中性,备用[8]。
1.3.4 大孔树脂的筛选
准确称取预处理好的 AB-8、NKA-9、DM301、HP-20、S-8、X-5、ADS-7 等 7 种大孔树脂 1.0 g置于三角瓶中,分别加入已知质量浓度的花生芽多酚粗提液30 mL,在25℃水浴摇床中以100 r/min的频率振荡吸附24 h,取上清液测定剩余的总酚浓度,计算各树脂的吸附量(mg/g)。
将上述吸附饱和的树脂取出,过滤后用蒸馏水冲洗至解吸液无色,去除树脂表面残留溶液,向已达吸附平衡的树脂中加入70%乙醇溶液30 mL,在25℃水浴摇床中以100 r/min的频率振荡解吸24 h,取上清液测定总酚浓度,计算各树脂的解吸率(%)。
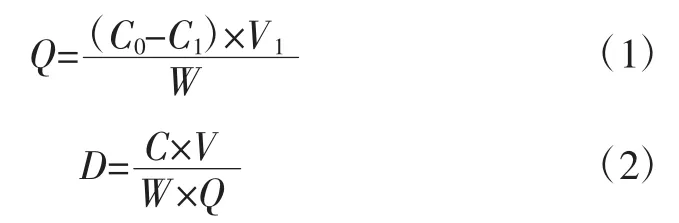
式中:Q 为吸附量,mg/g;C0为起始质量浓度,mg/mL;C1为平衡质量浓度,mg/mL;V1为吸附溶液体积,mL;W为树脂质量,g;D为解吸率,%;C为解吸后溶液中多酚质量浓度,mg/mL;V为解吸液体积,mL。
1.3.5 AB-8大孔树脂的静态吸附-解吸动力学曲线
分别取1.0 g已活化的AB-8大孔树脂置于三角瓶中,加入已知质量shi浓度的花生芽多酚粗提液30 mL,在25℃水浴摇床中以100 r/min的频率振荡吸附24 h,期间每隔一定时间取上清液0.1 mL,测定总酚浓度,绘制吸附动力曲线。取出吸附饱和的树脂,用蒸馏水冲洗至无提取液残留,加入70%乙醇溶液30 mL,在25℃水浴摇床中以100 r/min的频率振荡解吸24 h,期间每隔一定时间取上清液0.1 mL,测定总酚浓度,绘制解吸动力曲线。
1.3.6 大孔树脂静态吸附-解吸条件的优化
静态吸附试验分别取已活化的AB-8大孔树脂1.0 g置于三角瓶中,加入多酚提取液30 mL,于水浴摇床中静态吸附,吸附完全后取上清液测定总酚浓度,并计算吸附量(mg/g)。分别考察不同上样液质量浓度(0.2、0.4、0.6、0.8、1.0、1.6、2.0、2.4 mg/mL) 和不同上样液 pH 值(3、4、5、6、7、8)对 AB-8 大孔树脂静态吸附效果的影响。
静态解吸试验使用蒸馏水将充分吸附饱和的AB-8大孔树脂清洗至表面无残留,加入乙醇溶液30 mL,在水浴摇床中静态解吸完全后,取上清液测定总酚浓度,并计算解吸率(%)。分别考察不同浓度(30%、40%、50%、60%、70%、80%)乙醇溶液和不同乙醇溶液pH值(3、4、5、6、7、8)对 AB-8 大孔树脂静态解吸效果的影响。
1.3.7 大孔树脂动态吸附-解吸条件的优化
动态吸附试验于Φ10 mm×200 mm的层析柱中湿法装入5 g AB-8大孔树脂,平衡后,将多酚提取液进行上样吸附,收集流出液并测定不同体积流出液的总酚浓度,绘制多酚泄露曲线(当流出液中多酚质量浓度达到原液中多酚质量浓度的10%时,即为泄漏点[9])。分别考察不同样液浓度(0.8、1.0、1.2 mg/mL)和不同上样流速(1.0、1.5、2.0 mL/min)对动态吸附效果的影响。
动态解吸试验于Φ10 mm×200 mm的层析柱中湿法装入5 g AB-8大孔树脂,平衡后,将1.0 mg/mL的多酚提取液以1.5 mL/min的流速进行上样吸附,吸附饱和后,用蒸馏水洗至流出液无明显颜色,然后用乙醇溶液进行洗脱,收集洗脱液并测定不同体积洗脱液的总酚浓度,绘制多酚洗脱曲线。分别考察不同乙醇浓度(50%、60%、70%)和不同洗脱流速(1.0、1.5、2.0 mL/min)对动态解吸效果的影响。
2 结果与分析
2.1 大孔树脂的筛选
不同型号大孔树脂的吸附量见图1。不同型号大孔树脂的解吸率见图2。
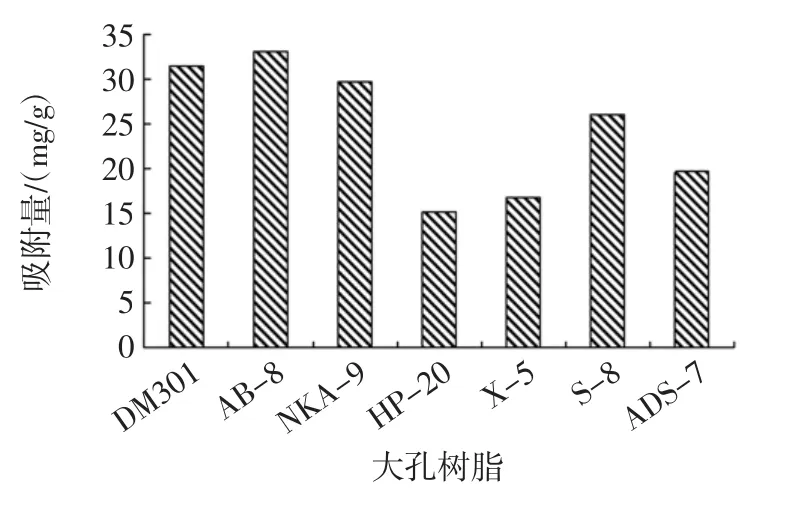
图1 不同型号大孔树脂的吸附量Fig.1 Adsorption capacity of different types of macroporous resins

图2 不同型号大孔树脂的解吸率Fig.2 Desorption rate of different types of macroporous resins
由图1可知,弱极性和极性树脂对花生芽中酚类物质的吸附能力较强,如AB-8、DM301和NKA-9,而非极性树脂HP-20和X-5对酚类物质的吸附能力较差,这与酚类物质的结构有关,具有一定的极性和亲水性,生成氢键的能力较强,有利于弱极性和极性树脂对其吸附[10]。由图2可知,DM301和NKA-9虽然对花生芽中酚类物质的吸附量较高但解吸率较低,表明树脂与多酚的结合能力较强,不利于其解吸,而HP-20虽然解吸率最强但对多酚的吸附量太低,综合比较AB-8大孔树脂的吸附量和解吸率均较为理想,是适用于花生芽中酚类物质吸附分离的大孔树脂类型。
2.2 AB-8大孔树脂的静态吸附-解吸动力学曲线
AB-8大孔树脂的静态吸附动力学曲线见图3,静态解吸动力学曲线见图4。
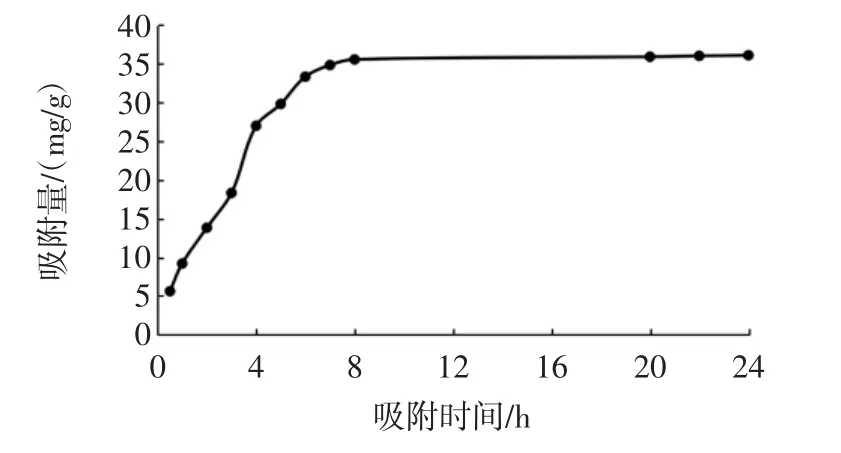
图3 AB-8大孔树脂的静态吸附动力学曲线Fig.3 Static adsorption kinetics curve of AB-8 macroporous resin

图4 AB-8大孔树脂的静态解吸动力学曲线Fig.4 Static desorption kinetics curve of AB-8 macroporous resin
由图3可知,在吸附前6 h内,树脂对酚类物质的吸附量随吸附时间的延长呈线性增加趋势,到达6 h后,吸附速率逐渐变缓,表明此时树脂已接近吸附平衡,继续延长吸附时间,吸附量增加有限。由图4可知,在解吸前4 h内,随着解吸时间的延长解吸率呈线性增加趋势,超过4 h后解吸率上升趋势变缓,到达6 h后解吸率趋于平衡。由此确定AB-8大孔树脂对花生芽中酚类物质的吸附-解吸平衡时间均为6 h。
2.3 AB-8大孔树脂静态吸附-解吸条件优化
2.3.1 上样pH值对静态吸附效果的影响
上样pH值对静态吸附效果的影响见图5。
不同pH值可以改变目标成分在溶液中的存在形式,影响其溶解度,并改变溶液极性,影响目标成分与大孔树脂的分子间的作用力[11]。由图5可以看出,当花生芽提取液pH值为3时吸附量最高,主要是由于提取液中含有大量酚羟基,在酸性条件下酚类物质以分子状态存在,更有利于被大孔树脂吸附,而随着pH值的增加,酚类物质溶解性增大,不易与树脂发生物理吸附作用。
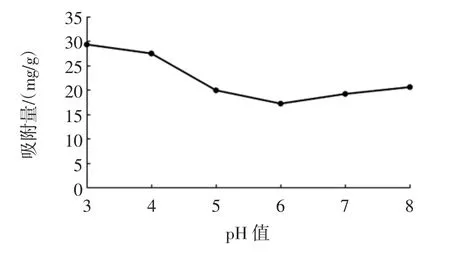
图5 上样pH值对静态吸附效果的影响Fig.5 Effect of pH value on static adsorption
2.3.2 样液质量浓度对静态吸附效果的影响
样液质量浓度对静态吸附效果的影响见图6。

图6 样液质量浓度对静态吸附效果的影响Fig.6 Effect of sample concentration on static adsorption
由图6可知,随着样液中总酚质量浓度的提高,树脂的吸附量呈上升趋势,当样液中总酚浓度为2.0 mg/mL时吸附量达到最大值,继续增大样液浓度,吸附量呈下降趋势。造成这种现象的原因可能是当样液浓度较低时由于酚类物质被稀释造成吸附动力较小,从而降低吸附量,而样液浓度过高时其中杂质含量随之增高,会与多酚争夺大孔树脂的活性位点,造成多酚吸附量的下降[12],且样液浓度过高可能造成树脂使用周期缩短,再生次数增多[13]。因此确定静态吸附最佳样液浓度为2.0 mg/mL。
2.3.3 乙醇浓度对静态解吸效果的影响
乙醇浓度对静态解吸效果的影响见图7。
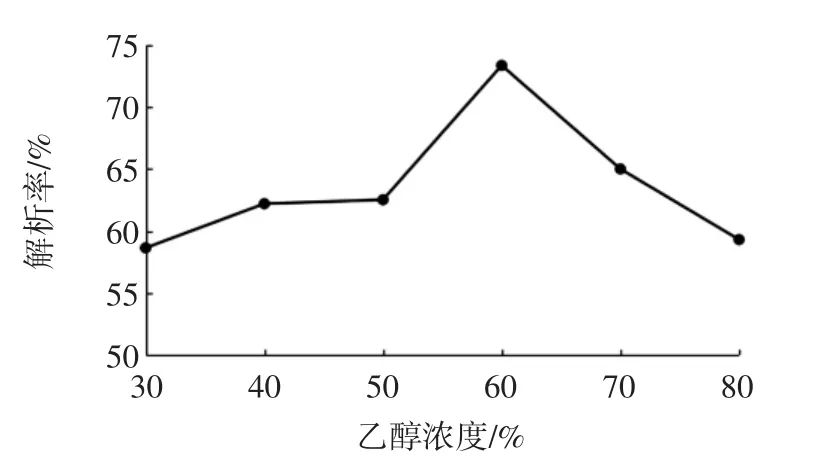
图7 乙醇浓度对静态解吸效果的影响Fig.7 Effect of ethanol concentration on static desorption
由图7可知,随着乙醇浓度的增加,多酚解吸率呈先上升后下降的趋势,当浓度为60%时,解吸率最高,约为73.4%。在吸附阶段,酚类物质溶于水中,大孔树脂对其吸附作用大于多酚与水之间的作用,多酚被吸附在树脂上;当用乙醇溶液洗脱时,多酚与乙醇溶液间作用大于其与大孔树脂的吸附作用,多酚被洗脱下来[14]。60%乙醇溶液对花生芽中酚类物质有较好的洗脱效果,可能是由于60%乙醇与花生芽中多酚的极性最为接近,因而其相互作用最强。故选择60%乙醇溶液作为洗脱溶剂较为适宜。
2.3.4 乙醇pH值对静态解吸效果的影响
乙醇pH值对静态解吸效果的影响见图8。
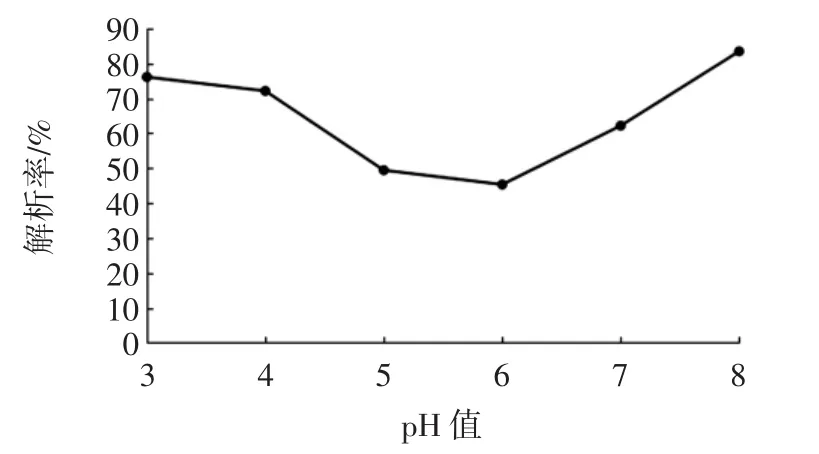
图8 乙醇pH值对静态解吸效果的影响Fig.8 Effect of pH value of ethanol on static desorption
由图8可知,随着解吸液pH值的增加,多酚解吸率呈先下降后上升的趋势,弱酸性环境下解吸率较低,酸性和弱碱性环境下有利于花生芽中酚类物质的解吸,但长时间的碱性环境会使酚类物质解离,引起分子结构和性质的不可逆变化[13],因此选择解吸液pH值为3。
2.4 AB-8大孔树脂动态吸附-解吸条件优化
大孔树脂对多酚的纯化实际是一个动态的吸附-解吸过程,因此不能单纯地通过静态试验来确定其对花生芽中酚类物质的吸附、解吸能力[12],有必要在此基础上进一步开展动态试验,并对影响动态吸附-解吸效果的因素进行优化。
2.4.1 上样浓度对动态吸附效果的影响
上样浓度对动态吸附效果的影响见图9。
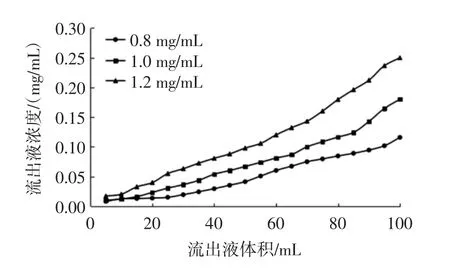
图9 上样浓度对动态吸附效果的影响Fig.9 Effect of sample concentration on dynamic adsorption
由于动态试验上样体积较大,样液浓度过高时容易对树脂造成污染和阻塞,降低树脂的吸附能力,故参考静态试验并适当降低上样浓度。由图9可知,随着上样量的增大,流出液中总酚浓度呈上升趋势,当上样浓度分别为0.8、1.0、1.2 mg/mL时,泄漏点分别出现在80、70、60 mL附近,主要是由于随着样液浓度提高传质速度变慢,且树脂周围的多酚分子过多,使得部分多酚没来得及被吸附就流出来[10],因而泄漏点提前。综合考虑确定最佳动态吸附上样浓度为1.0 mg/mL。
2.4.2 上样流速对动态吸附效果的影响
上样流速对动态吸附效果的影响见图10。
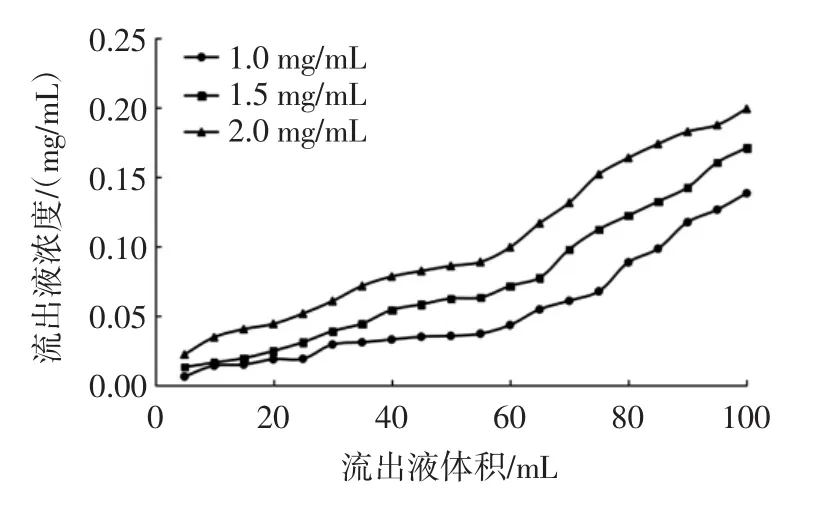
图10 上样流速对动态吸附效果的影响Fig.10 Effect of sample flow rate on dynamic adsorption
由图10可知,当上样流速分别为1.0、1.5、2.0mL/min时,泄漏点分别出现在90、75、65 mL附近,随着上样流速的增加,泄漏点到达越提前,主要是由于样液中的多酚分子没有足够的时间被大孔树脂内表面吸附就随渗透液流出。上样流速慢虽然有利于发挥树脂的最大吸附效果,但会导致生产周期长,不利于工业化生产[15]。综合考虑确定最佳上样流速为1.5 mL/min。
2.4.3 乙醇浓度对动态解吸效果的影响
乙醇浓度对动态解吸效果的影响见图11。
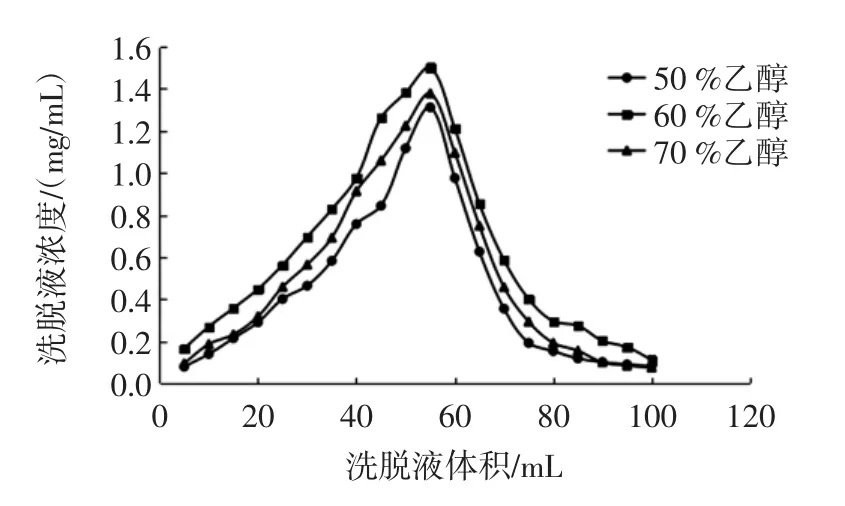
图11 乙醇浓度对动态解吸效果的影响Fig.11 Effect of ethanol concentration on dynamic desorption
由图11可知,随着洗脱液流出体积的增大,不同浓度乙醇洗脱液中总酚浓度均呈现先增大后减小的趋势。30 mL~70 mL作为收集纯化多酚浓度较高的区间,55mL左右达到峰值。当洗脱液体积超过80 mL时,花生芽多酚基本被洗脱完全。对比不同浓度乙醇的动态洗脱曲线可以看出,洗脱液中总酚浓度的大小顺序为60%乙醇>70%乙醇>50%乙醇,200 mL洗脱液中其多酚总解吸率分别为82.1%、67.4%和58.1%,故最佳洗脱溶剂为60%乙醇溶液,与静态解吸试验结果一致。
2.4.4 洗脱流速对动态解吸效果的影响
洗脱流速对动态解吸效果的影响见图12。
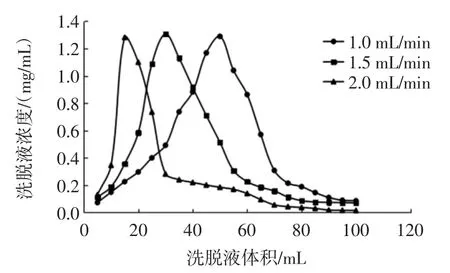
图12 洗脱液流速对动态解吸效果的影响Fig.12 Effect of elution flow rate on dynamic desorption
由图12可知,洗脱流速越快,动态洗脱曲线出峰时间越提前,且拖尾现象越明显。对比不同流速下高浓度收集区间内多酚洗脱总质量可以看出,1.0、1.5、2.0 mL/min 多酚洗脱量分别为 39.8、35.5、19.4 mg,洗脱速率过大会导致洗脱溶剂未充分溶解树脂中的多酚而过柱[16],造成洗脱量降低。综合考虑洗脱流速1.5 mL/min较为适宜,在此条件下多酚洗脱量较1.0 mL/min下降不大,但可缩短洗脱时间,减少洗脱剂用量,且洗脱曲线峰形相对集中、对称,拖尾现象不明显。
3 结论
通过对比7种型号大孔树脂对花生芽多酚的吸附和解吸效果,从中筛选出AB-8为最佳树脂类型。其最佳静态吸附条件为:吸附平衡时间6 h、样液pH3、样液质量浓度2.0 mg/mL,最佳静态解吸条件为:解吸时间6 h、解吸液乙醇浓度60%、解吸液pH3。在此基础上开展AB-8大孔树脂对花生芽中酚类物质的动态吸附-解吸试验,其最佳动态吸附条件为上样浓度1.0 mg/mL、上样流速1.5 mL/min,最佳动态解吸条件为洗脱液乙醇浓度60%、洗脱流速1.5 mL/min。在此条件下对花生芽中酚类物质进行纯化,有助于进一步开展花生芽中酚类物质的组成分析、生物活性等深入研究。
