肌原纤维蛋白结合态羧甲基赖氨酸的体外消化特性
2020-06-02齐小敏任晓敏李梅徐怀德
齐小敏,任晓敏,李梅,徐怀德
(西北农林科技大学食品科学与工程学院,陕西杨凌712100)
晚期糖基化终末产物(advanced glycation endproducts,AGEs)是还原糖(如葡萄糖)的活性羰基与蛋白质、脂肪以及核酸的自由氨基经非酶促反应形成的一系列结构稳定的化合物总称[1-2]。体内过量AGEs的累积与一些慢性疾病的发病机理密切相关,如心血管疾管[3]、肾病[4]、动脉粥样硬化[5]、阿尔茨海默病[6]、肿瘤[7]、糖尿病及其并发症等[8]。AGEs不仅在生物体内生成,在食品热加工(蒸、煮、炸、烤等)过程中也大量生成[9]。研究表明食源性AGEs是人体内AGEs累积的重要外部来源[10-11]。
AGEs种类繁多、结构复杂。羧甲基赖氨酸 [Nε-(carboxymethyl)lysine,CML]是研究最早且结构稳定的一类AGE,其生成量与AGEs的生成量呈正相关,常作为评价AGEs含量的代表性标志物[12]。Jaime等建立了549种不同类型食品中CML含量的数据库[13]。Hull等测定了西方饮食中食用频率最高的257种食物中CML含量,发现肉制品中CML含量最高,其中每100 g烤羊肉中CML含量高达42.39 mg[12]。食品中的CML主要有两种存在形式:游离态CML和结合态CML。游离态CML易于被机体吸收,但其在食品中含量甚微。食品中的结合态CML以蛋白结合态CML为主[14-15]。由于蛋白结合态CML分子量大,需经胃肠消化水解为低分子量CML,进而有可能被机体吸收。
肉制品是食品中蛋白结合态CML含量较高的一类食品(红色肉>白色肉),肌肉蛋白是肌肉中的主要成分,其中肌原纤维蛋白(myofibrillar protein,MP)占总蛋白的55%~60%,本研究以猪里脊肉为原料提取MP,以化学合成法制备肌原纤维蛋白结合态CML(myofibrillar protein-bound CML,MP-bound CML),探究MP-bound CML在体外模拟胃肠系统消化过程中分子形态的变化及消化结束后不同分子量范围水解液中CML的水平,为科学评价食品中蛋白结合态CML的肠道吸收性提供前期理论依据。
1 材料与方法
1.1 材料与试剂
猪里脊肉(宰后24 h):杨凌好又多超市;CML标品(纯度>98%)、内标CML-d4(纯度>98%):美国Santa Cruz Biotechnology公司;一水合乙醛酸、氰基硼氢化钠、胃蛋白酶(3 200 units/mg protein~4 500 units/mg protein)、胆盐、胰液素、胰蛋白酶(13000BAEE units/mg protein~20000 BAEE units/mg protein):美国 Sigma 公司;九氟戊酸(纯度>97%)、色谱级甲醇、乙腈:上海百灵威试剂公司;四甲基乙二胺、三羟甲基氨基甘氨酸、十二烷基硫酸钠、三羟甲基氨基甲烷:北京索莱宝科技有限公司;预染低分子量蛋白标准品:美国Thermo scientific公司;试验用水为超纯水;其他试剂购于国药集团化学试剂有限公司(上海),均为分析纯。
1.2 仪器与设备
DS-1组织捣碎机、T18高速组织分散器、RH digital white恒速搅拌器:德国IKA公司;HC-3018R高速冷冻离心机:安徽中科中佳科学仪器有限公司;CVCFD5冷冻干燥机:金西盟(北京)仪器有限公司;UFSC05001超滤装置:Millipore公司;精密pH计:上海精密仪器仪表公司;Waters Micromass Quattro Micro API LC/MS/MS液质联用仪:美国Waters公司;12T氮吹仪:上海泉岛公司;UV-6100型紫外可见分光光度计:岛津企业管理(中国)有限公司;SHZ-88恒温水浴振荡器:国旺仪器制造公司;凝胶成像系统BIORAD Molecular Imager ChemiDoc XRS:美国BIO-RAD公司;I×71荧光倒置显微镜:日本olympus公司;Zetasizer Nano S90马尔文纳米粒度:英国Malvern公司。
1.3 方法
1.3.1 MP的提取
参考Cao等[16]的方法对猪里脊中的MP进行提取。将冷冻的猪里脊肉置于4℃条件下解冻,剔除可见脂肪及结缔组织后,于4℃环境中将猪里脊肉切成小条并绞碎称重后置于组织捣碎机中,加入4倍体积的僵直液(10 mmol/L 磷酸钠,0.1 mol/L NaCl,2 mmol/L MgCl2,1 mmol/L乙二醇四乙酸(ethylene glycol tetraacetic acid,EGTA,pH 7.0),充分斩拌形成均匀混合液。于4℃条件下2 000 g离心15 min,弃去上清液,重复2次;此后所得沉淀加入3倍体积0.1 mol/L NaCl溶液,按上述条件重复2次,再经4层纱布(100目)过滤以去除残留结缔组织等,滤液在相同条件下离心,弃去上清液所得膏状沉淀与3倍体积蒸馏水混合匀浆,用分子量截留范围为8 kDa~14 kDa的透析袋纯水透析3 d,冷冻干燥,制得MP。
1.3.2 赖氨酸含量的测定
参考李凤丽[17]的方法对MP中赖氨酸的含量进行测定。采用异硫氰酸苯脂(phenyl-isothiocyanate,PITC)进行衍生,HPLC进行检测。准确称取100.0 mg MP样品于水解管中,加入5 mL 6 mol/L盐酸,在真空条件下封管,置于110℃烘箱中水解24 h。将水解液过滤并定容至25 mL,取200 μL水解液氮气吹到样品处于近干状态,用200 μL 0.1 mol/L盐酸复溶。分别加入20 μL正亮氨酸内标,100 μL三乙胺乙睛溶液和100 μL异硫氰酸苯脂乙睛溶液,充分混合后室温(25℃)放置1 h,加入400 μL正己烷充分振荡混合,静置10 min后,取下层溶液过0.45 μm滤膜,待测。
HPLC分析条件:Venusil AA氨基酸分析专用柱(5 μm,4.6 mm×250 mm);柱温 40℃,流动相组成:A相为0.1 mol/L醋酸钠乙腈水溶液(醋酸钠水溶液∶乙腈=93∶7,体积比)、B相为80%乙腈,线性梯度——0~17 min 100%~90%A;17 min~41 min 90%~55%A;42 min~47 min 0%A;47 min~57 min 100%A;流速1 mL/min,检测波长 278 nm,进样量 10 μL。
1.3.3 MP-bound CML的合成
合成条件参考Hellwig等[18]的方法。将一定浓度的乙醛酸加入MP磷酸缓冲液中(乙醛酸与MP中赖氨酸(按照1.3.2的方法测定得10.15 g赖氨酸/100 g MP蛋白)的摩尔比为4∶1,磷酸盐缓冲液浓度为0.067 mol/L,pH 7.4),加入8.8 mmol NaBCNH3于40℃水浴恒温搅拌反应24 h,用分子量截留范围为8 kDa~14 kDa的透析袋纯水透析3 d后冷冻干燥,制得MP-bound CML。
1.3.4 CML含量测定
根据李梅[19]的方法对制备得到的MP-bound CML进行样品前处理及含量测定。具体操作及其消化完全后各分子量组分样品进行前处理及CML含量测定如下。
1.3.4.1 样品前处理
准确秤取MP-bound CML样品10.0 mg,滴加2~3滴1-辛醇消泡后加入1 mL 0.1 mol/L NaBH4溶液和1.5 mL 0.2 mol/L硼酸盐缓冲液(pH值为9.2),室温静置4 h。将还原后的的样品溶液转移至酸水解管,加入2.5 mL 12 mol/L浓HCl至盐酸终浓度为6 mol/L。通氮气2 min~3 min后封口,置于110℃烘箱水解24 h。过滤酸水解结束后将样品酸水解液进行过滤,并转移至10 mL容量瓶定容。精确移取1 mL样品酸水解液置于氮吹仪上于45℃下吹干。加入150 μL超纯水,150 μL 475 ng/mL内标CML-d4溶液于吹干样品中进行复溶,旋涡混匀,用0.22 μm水系微滤膜过滤,准备上机检测。
1.3.4.2 高效液相色谱-三重四极杆串联质谱(high performance liquid chromatographytriple quadrupoletendem mass spectrum,HP LC-QQQ-MS/MS)测定。
Alliance 2695高效液相色谱仪和Quattro Micro三重四级杆质谱联用仪用于测定样品中的CML含量。LC分析条件:色谱柱为X-Bridge C18柱(100×2.1 mm i.d.,3.5 μm),柱温为 35 ℃;流动相由纯乙腈(A)和5 mM九氟戊酸水溶液(B)组成,线性梯度为——0~5 min 5%~60%A;5 min~7 min 60%~100%A;7 min~9 min 100%A;9 min~10 min 100%~5%A;流速为0.3 mL/min;柱平衡 10 min;进样体积为 5 μL[19]。MS/MS分析条件:离子源为电喷雾正离子源(ESI+),检测模式为MRM模式。毛细管电压为3.55 kV,离子源温度为110℃,脱溶剂温度为400℃,脱溶剂气流速为600 L/h,锥孔气流速为50 L/h,碰撞气(氩气,纯度99.99%)流速为0.13 mL/min。采用软件MassLynx 4.1对试验数据进行分析。按照1.3.3方法合成的MP-bound CML经测定得到其中CML含量为127mg/g样品。
1.3.5 MP-bound CML体外模拟胃肠消化试验
参考Hellwig等[18]的方法,并稍加修改。
胃消化阶段:将4.0 g MP-bound CML加入390 mL人工胃液(2.90 g/L NaCl,0.70 g/L KCl,0.27 g/L KH2PO4),用高速组织分散器匀浆,滴加3 mol/L HCl调pH值至2.0±0.1,加入10 mL样品重量4%的胃蛋白酶,37℃水浴振荡器中恒速搅拌消化120 min。期间用3 mol/L HCl调节pH值至2.0±0.1。于120 min取4 mL悬浮液,沸水煮5 min灭酶,终止MP-bound CML胃消化,取部分样品于-80℃保存备用,记为S。
CML肠消化,各样品于-80℃保存备用,分别记为S+I30、S+I60、S+I90、S+I120、S+I180 和 S+I360。
1.3.6 微观形态
根据Zhang等[20]的方法,采用倒置荧光显微镜对MP-bound CML及其经胃肠消化不同时间后水解液的微观形态进行观察。将20 μL荧光染料(0.01%Nile Blue,纯水配制)加入到5 mL新鲜制备的样品S、S+I30、S+I60、S+I90、S+I120、S+I180 和 S+I360 中,取 10 μL 样品溶液滴到载玻片上,盖上盖玻片,确保盖玻片和载玻片之间没有气泡,指甲油封片,吹干,避光保存。用倒置荧光显微镜(激发波长为488 nm)于10倍物镜下观察体外模拟胃肠消化不同时间样品溶液的微观形态。
1.3.7 粒径分析
根据李伟伟[21]的方法,采用马尔文粒径仪测定新鲜制备的 1 mL 样品 S、S+I30、S+I60、S+I90、S+I120、S+I180和S+I360粒径的大小变化。
1.3.8 分子量分布
采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)和三甲基甘氨酸-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(tricine-Sodium dodecyl sulfatepolyacrylamide gel electrophoresis,Tricine-SDS-PAGE)分析新鲜制备的样品 S、S+I30、S+I60、S+I90、S+I120、S+I180和S+I360分子量的变化情况。
根据Cao等[16]的方法制备4%浓缩胶和12%分离胶,进行SDS-PAGE电泳。用磷酸盐缓冲液将所有样品稀释至蛋白质浓度为4 mg/mL。取80 μL样品与20 μL上样缓冲液混合,煮沸5min,MP-boundCML上样20μL,样品 S、S+I30、S+I60、S+I90、S+I120、S+I180 和 S+I360各上样 40 μL,Marker上样 5 μL。采用恒压模式,初始电压为90 V,样品进入分离胶调电压至110 V。电泳结束后,用含1 mg/mL考马斯亮蓝、50%甲醇和6.8%冰乙酸的溶液染色1 h,随后用含5%甲醇和7.5%冰乙酸的溶液进行脱色,用凝胶成像系统BIO-RAD Molecular Imager ChemiDoc XRS拍照。
根据张微[22]的方法制备4%浓缩胶、10%夹层胶和16%分离胶,进行Tricine-SDS-PAGE电泳。所有样品均按上述方法处理后,在浓缩胶和夹层胶中采用恒压模式50 V压线,进入分离胶后电压转换至80 V,在距离胶底部1 cm处停止,在低温环境下进行,注意温度不能超过35℃。电泳结束后,浸泡于含50%甲醇、10%冰醋酸、0.05 mol/L醋酸铵的固定液中固定1 h,用含0.025%考马斯亮蓝R-250、45%甲醇、10%冰醋酸的溶液染色1.5 h,随后用含5%甲醇和7.5%冰醋酸的溶液进行脱色,用凝胶成像系统BIO-RAD Molecular Imager ChemiDoc XRS拍照。
1.3.9 不同分子量范围水解液中CML的含量测定
根据宗玉霞[23]的方法,分别采用截留分子量5、3、1 kDa的超滤膜对经胃肠系统消化完全的MP-bound CM水解液样品S+I360进行超滤处理,得到>5 kDa、3 kDa~5 kDa、1 kDa~3 kDa、<1 kDa 4 个分子量范围的水解液组分,冻干各组分样品并测定其所含的CML含量,测定方法同1.3.4。如图1所示。
图1 超滤装置[23]Fig.1 Ultrafiltration device
1.4 数据分析
所有试验均进行3次重复,数据以平均值±标准偏差的形式表示,用SPSS 20.0统计软件,以单因素变量分析法(analysis of variance,ANOVA)及LSD检验进行组间差异比较和差异显著性分析。P<0.05为显著性差异。
2 结果与分析
2.1 MP-bound CML在模拟胃肠消化过程中微观形态的变化
MP-bound CML经体外模拟胃肠消化不同时间的微观形态见图2。

图2 MP-bound CML经体外模拟胃肠消化不同时间的微观形态(10×)Fig.2 Micromorphology of MP-bound CML after different time of simulated gastrointestinal digestion in vitro
由图2可知,MP-bound CML经胃蛋白酶消化120 min后,颗粒变大,之后在肠消化阶段,随着胰蛋白酶消化时间的增长,MP-bound CML颗粒逐渐减小,表明MP-bound CML消化程度逐渐增加。当肠消化120 min后颗粒形态变化不明显,这可能是由于随着肠消化时间的延长,MP-bound CML消化速率减慢,标志着MP-bound CML经体外模拟胃肠消化基本结束,MP-bound CML消化完全。这一结果与Hellwig等的研究结果相一致。Hellwig等研究发现酪蛋白结合态CML在体外模拟胃肠消化过程中,结合态CML的长度随消化时间的增加而逐渐缩短[18]。
2.2 MP-bound CML在模拟胃肠消化过程中粒径的变化
为了明确MP-bound CML在胃肠消化过程中颗粒大小的变化,本研究收集了MP-bound CML经体外模拟胃肠消化不同时间的水解液并检测其粒径分布情况,见图3。

图3 MP-bound CML经体外模拟胃肠消化不同时间的粒径分布Fig.3 Particle size distribution of MP-bound CML after different time of simulated gastrointestinal digestion in vitro
由图3可知,MP-bound CML在胃肠消化过程中水解物的粒径均为双峰分布,且都在100 nm以上。这可能是由于在整个消化过程中MP-bound CML在胃蛋白酶和胰蛋白酶的作用下水解为不同分子量大小的肽结合态CML和小分子结合态CML。当MP-bound CML经胃蛋白酶消化120 min后,水解物的粒径小于肠道消化30 min后,这可能是由于蛋白溶解度随着pH值的增大而增大,酸性条件下聚集的蛋白在碱性条件下溶解。胃肠消化30 min的平均粒径为503.37±2.194 nm。随着肠道消化时间的增加,MP-bound CML水解物的粒径逐渐减小,其胃肠消化360 min的平均粒径为(476.28±5.79)nm。同时由双峰趋向为单峰,后峰强度较小,说明MP-bound CML随着消化时间的延长,MP-bound CML可能水解为分子量较小的肽结合态CML,这与荧光显微镜结果相一致。
2.3 MP-bound CML在模拟胃肠消化过程中分子量的变化
为进一步阐明MP-bound CML在胃肠消化过程中的水解情况,本文采用SDS-PAGE和Tricine-SDSPAGE电泳技术得到MP-bound CML经体外模拟胃肠消化不同时间的分子量分布,见图4。
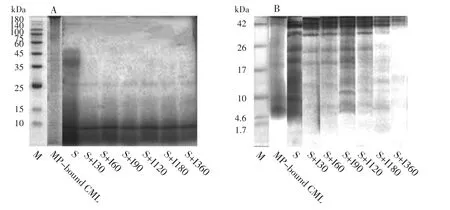
图4 MP-bound CML经体外模拟胃肠消化不同时间的分子量分布Fig.4 Molecular weight distribution of MP-bound CML after different time of simulated gastrointestinal digestion in vitro
由图4A可以得出,MP-bound CML经胃消化120 min后,与MP-bound CML相比水解物的多条分子量条带均在60 kDa以下;进入肠消化阶段后随着消化时间的增加,MP-bound CML水解物的分子量进一步减小,25 kDa左右、15 kDa~25 kDa和 10 kDa左右的条带较为清晰,表明MP-bound CML经胃肠消化后分子量逐渐减小。
由于SDS-PAGE无法分离分子量较低的水解物,本文进一步采用Tricine-SDS-PAGE电泳对分子量较低的水解物进行分子量分布分析。由图4B可知,MP-bound CML随着胃肠消化时间的增加,小于17 kDa的条带先清晰后变浅,10 kDa以下条带逐渐清晰,当肠消化达到360 min时,与肠消化180min相比,仅能在4.6 kDa~17 kDa中观察到条带,17 kDa~26 kDa的条带消失,表明MP-bound CML经胃肠消化后水解为分子量较低的结合态CML。Hellwig等报道酪蛋白结合态CML经胃肠消化后,小于1 kDa的水解物组分有可能被肠道吸收[18]。因此,本研究中MP-bound CML经体外模拟胃肠消化后存在被机体吸收的可能性。
2.4 MP-bound CML经胃肠消化后不同分子量组分中CML的含量
为了揭示MP-bound CML经胃肠消化完全后不同分子量范围水解液中结合态CML的含量,本研究对MP-bound CML样品经胃消化120 min+肠消化360 min后的水解液进行了超滤处理,并收集了>5 kDa、3 kDa~5 kDa、1 kDa~3 kDa以及<1 kDa的水解液,MP-bound CML经体外模拟胃肠消化360 min后水解液不同组分中CML含量及占总CML的百分比见图5。
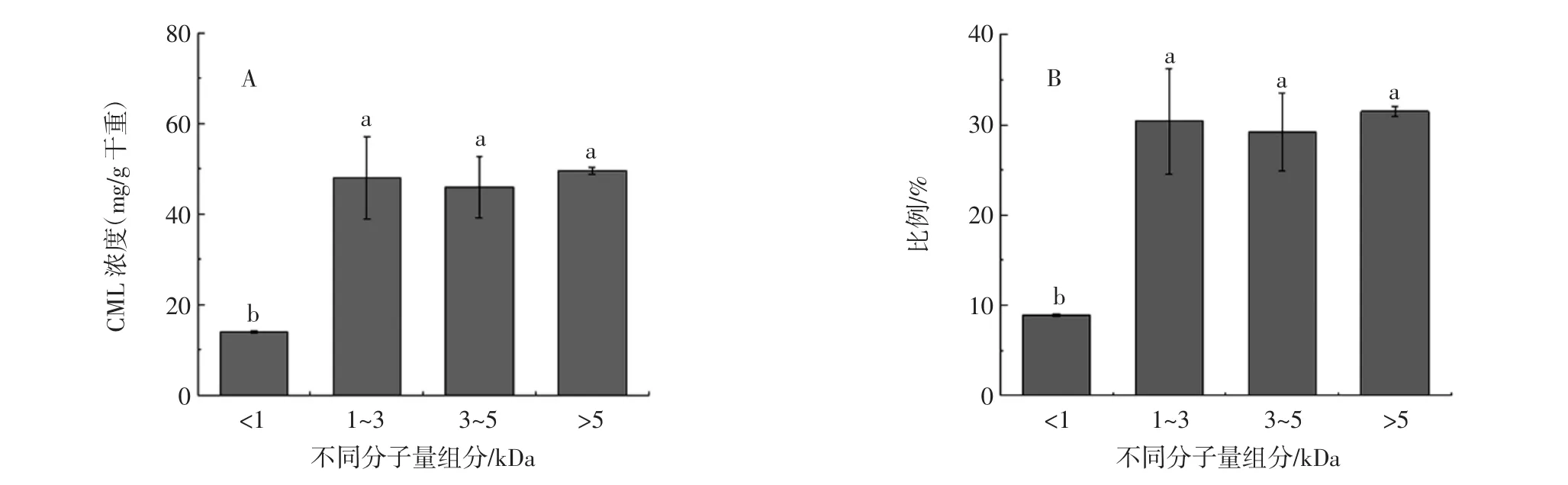
图5 MP-bound CML经体外模拟胃肠消化360 min后水解液不同组分中CML含量及占总CML的百分比Fig.5 Concentration and percent of CML in different components of MP-bound CML hydrolysates after simulated gastrointestinal digestion in vitro for 360 min
由图5可以看出,>5 kDa的水解液中结合态CML含量为(49.6±0.83)mg/g样品干重,占 MP-bound CML总含量的比例为31.5%,3 kDa~5 kDa的水解液中结合态CML含量为(46.0±6.77)mg/g样品干重,占MP-bound CML总含量的比例为29.2%,1 kDa~3 kDa的水解液中结合态CML含量为(48.0±9.19)mg/g样品干重,占MP-bound CML总含量的比例为30.4%,<1 kDa的水解液中结合态CML含量为(14.0±0.14)mg/g样品干重,占MP-bound CML总含量的比例为8.9%。结果表明MP-bound CML经胃肠系统消化后能够水解为分子量较小的肽结合态CML。通常胃和肠道消化后分子量小于1 kDa的物质所占整体的百分比称为可消化率[18]。Hellwig等报道小于1 kDa的结合态CML能够被机体吸收[18],同时也有研究发现CML结合在二肽上的吸收率高于游离态CML[24]。因此MP-bound CML存在被机体消化吸收的风险。
3 结论
本研究以猪里脊中的MP为原料,以合成法制备得到的MP-bound CML为研究对象探究MP-bound CML的胃肠消化特性。结果表明随着胃肠系统消化时间的增长,MP-bound CML逐渐水解为分子量较小的结合态CML,其中小于1 kDa的水解物中结合态CML含量达到(14.0±0.14)mg/g样品干重,占MP-bound CML总含量的8.9%,表明MP-bound CML有可能经胃肠消化被机体吸收,这一研究为科学评价食品中蛋白结合态AGEs的潜在生物安全性提供了一定的理论参考。
