婴幼儿配方乳粉和谷类辅助食品中生物素含量的测定
2020-06-02卢兰香薛霞公丕学魏莉莉武传香丁一王骏祝建华刘艳明
卢兰香,薛霞,公丕学,魏莉莉,武传香,丁一,王骏,祝建华,刘艳明
(山东省食品药品检验研究院,济南250101)
0 引言
生物素 (biotin) 又称维生素B7,维生素H,化学结构中包括一个羧基侧链 (含5个碳原子) 和两个五元杂环[1],是一种双环化合物。在体内由侧链上的羧基与酶蛋白的赖氨酸残基ε-NH 2结合,发挥辅酶作用。生物素参与蛋白质、脂肪和糖类的代谢是维持人体正常机能与代谢活动不可或缺的B族水溶性维生素之一[2]。生物素可能有8种不同的异构体,但只有D-生物素具有生物活性,而且GB14880-2012《食品安全国家标准食品营养强化剂使用标准》[3]中也规定了生物素的添加形式为D-生物素。
文献报道[4-5]人体肠道微生物可以合成一些生物素,所以成年人体内极少缺乏生物素;但由于婴幼儿肠道功能较弱无法合成,且婴幼儿饮食种类单一,所以易导致生物素缺乏。婴儿若缺乏生物素会造成严重的神经症状[6],出现躁狂、嗜睡、发育迟缓,以及舌炎和皮炎[7]等症状,因此需在婴幼儿食品中强化生物素。婴幼儿配方乳粉和婴幼儿谷类辅助食品是婴幼儿食品中两大类重要食品,食品安全国家标准GB 10765-2010[8]、GB 10767-2010[9]和GB 10769-2010[10]中对生物素的添加量作了明确的规定,因此生物素也成为婴幼儿配方乳粉和婴幼儿谷类辅助食品中的必检项目。所以准确测定婴幼儿食品中生物素含量对于生产企业控制生物素强化剂量和政府监管提供有力的技术支撑。
生物素的测定方法很多,主要包括微生物法[7,11-12]、酶联免疫法[13]、分光光度法、荧光分光光度法[14]、荧光免疫层析法[15]、生物传感器法[16]、毛细管电泳法[17]、液相色谱法[18-21]、液相色谱质谱联用法[22-26]等。其中,酶联免疫法专一性强,但试剂价格昂贵;生物传感器法重现性差;分光光度法灵敏度低;荧光法可靠性存在缺陷;毛细管电泳法样品的微量制备和电渗的控制存在困难;高效液相色谱法是通用方法,但由于生物素无典型的紫外和荧光发色团,不适合含量比较低的样品。微生物法是应用比较普遍的生物素测定方法,它是美国官方分析化学家协会 (Association of Official Analytical Chemists,AOAC) 的推荐方法和我国国标GB 5009.259-2016[12]的分析方法,方法灵敏度较高,成本较低,但是此法具有检测周期长、样本间平行性不好、菌种保存困难、操作复杂等缺点。婴幼儿食品成分复杂,所添加的生物素含量极低,一般在几微克/100克到几十微克/100克之间。液相色谱质谱联用法灵敏度高、选择性强等特点,尤其结合固相萃取对样品进行净化,对于基质复杂且生物素含量低的样品具有独特的优势。
本研究针对婴幼儿配方乳粉和婴幼儿谷类辅助食品基质复杂和生物素含量低的特点,拟采用液相色谱串联质谱法,结合固相萃取净化,并采用内标法定量以消除基质效应及前处理过程带来的偏差,以期建立婴幼儿配方乳粉和谷类辅助食品中生物素含量的分析方法。
1 实验
1.1 试剂与材料
D-生物素标准物质,生物素-d2标准物质。甲醇、乙腈(色谱纯),美国Fisher公司;甲酸(色谱纯),美国Sigma-Aldrich公司;氮气(>99.999% ),硫酸、乙酸(优级纯),国药集团化学试剂有限公司;氢氧化钠(分析纯),国药集团化学试剂有限公司。婴幼儿配方乳粉和婴幼儿谷类辅助食品均购自于当地超市。
ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7μm) ,美国Waters公司;QASIS PRiME HLB固相萃取柱(60 mg,3 mL),美国Waters公司;有机微孔滤膜(0.22μm),上海安谱科学仪器有限公司。
1.2 仪器与设备
ACQUITYTM超高效液相色谱仪和Xevo TQ-S质谱仪配有电喷雾(ESI)电离源和MasslynxTM色谱工作站,美国Waters公司;超声波清洗器,宁波新芝生物科技有限公司;MS3涡旋混合器,IKA公司;N-EVAP-45位氮吹仪,美国Organomation公司;SQP-电子天平,塞多利斯科学仪器有限公司;Milli-Q超纯水系统,美国Millipore公司。
1.3 标准溶液的配制
D-生物素标准储备液(100μg/mL):准确称取5 mg(精确至0.1 mg)生物素标准品于50 mL容量瓶中,用甲醇溶液(50% )定容刻度。储存于棕色玻璃瓶中,-20℃密封保存1年。
D-生物素标准中间液(100 ng/mL):取适量1.00 mL生物素标准储备液于10 mL容量瓶中,用甲醇溶液(50% )稀释并定容至刻度;然后甲醇溶液(50% )逐级稀释到100 ng/mL,储存于棕色玻璃瓶中,2℃~4℃保存1个月。
生物素-d2标准储备液(100μg/mL):准确称取5 mg(精确至0.1 mg)生物素-D2于50 mL容量瓶中,用甲醇溶液(50% )定容刻度。储存于棕色玻璃瓶中,-20℃密封保存1年。
生物素-d2标准中间液(2μg/mL):吸取2.00 mL生物素-d2标准储备液于100 mL容量瓶中,用甲醇溶液(50% )稀释并定容至刻度,储存于棕色玻璃瓶中,2℃~4℃保存1个月。
标准系列工作液配制:准确吸取生物素-d2标准中间液75μL、D-生物素标准中间液适量于10 mL容量瓶中,以初始流动相配制成质量浓度为0.5 ng/mL、1.0 ng/mL、2.0 ng/mL、5.0 ng/mL、10.0ng/mL、15 ng/mL、20 ng/mL、25 ng/mL的标准系列工作液,现用现配。
1.4 样品制备
粉末状样品经混匀后,直接取样;片状、颗粒状样品,经样本粉碎机磨成粉,储存于样品瓶中避光保存。立即测定或4℃冰箱保存,1周内测定。
1.5 样品前处理
1.5.1 提取
1.5.1.1 婴幼儿配方乳粉
称取1 g (精确到0.001 g) 婴幼儿配方乳粉试样于50 mL离心管中,,加入375μL生物素-d2标准中间液,加入约25 mL 45℃~50℃的水,置于超声波中超声提取约25 min以上,并冷却至室温。待试样溶液降至室温后,用盐酸溶液调节试样溶液的p H至1.7±0.1,放置约2 min后,再用氢氧化钠溶液调节试样溶液的pH至4.5±0.1,然后超声约10 min。将试样溶液转移至50 mL容量瓶中,用水冲洗比色管,洗液合并于50 mL容量瓶中,用水定容至50 mL,经滤纸过滤,待净化。
1.5.1.2 婴幼儿谷类辅助食品
称取1 g (精确到0.001 g) 粉碎均匀的婴幼儿谷类辅助食品试样于50 mL比色管中,加入375μL生物素-d2标准中间液,加入25 mL的0.1 mol/L硫酸溶液充分摇匀,在121℃下水解30 min,冷却至室温后,用1 mol/L氢氧化钠溶液调pH至4.5±0.2后,再超声约10 min。将试样溶液转移至50 mL容量瓶中,用水冲洗比色管,洗液合并于50 mL容量瓶中,用水定容至50 mL,经滤纸过滤。滤液再经0.22μm水相微孔滤膜过滤后上机测定。
1.5.2 净化
将QASISPRiME HLB固相萃取柱连接到固相萃取装置上,取1.5.1.1的样品提取溶液1 mL于15 mL离心管中,加入1 mL 3% 乙酸溶液,涡旋混匀后上样,然后分别用3 mL水和3 mL 5% 甲醇溶液淋洗,最后用1 mL乙腈-甲醇 (9:1,V/V) 洗脱,45℃氮吹至近干,用1 mL初始流动相复溶,经0.22μm有机相微孔滤膜过滤后上机测定。
1.6 分析条件
1.6.1 色谱条件
色谱柱:ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7μm) 美国Waters公司;流速:0.3 mL/min;流动相:0.1% 甲酸溶液(A)和乙腈(B);柱温:40℃;进样量:5μL。梯度洗脱程序见表1。
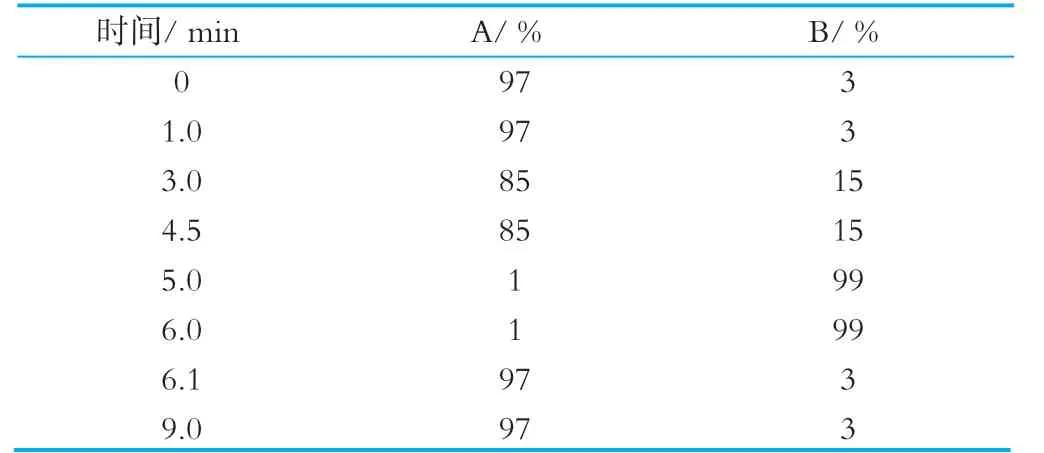
表1 HPLC梯度洗脱程序
1.6.2 质谱条件
离子源:电喷雾离子源 (ESI) ;离子化模式:正离子模式(ESI+);毛细管电压:3.0 kV;锥孔电压:30 V;脱溶剂气温度450℃;离子源温度:150℃;脱溶剂气流速:850 L/h:锥孔反吹气流速:150 L/h;碰撞气流速:0.12 mL/min;采集模式:多反应监测 (MRM) ;生物素的定性离子定量离子对及质谱参数见表2。

表2 生物素的质谱参数
1.7 基质效应评价
实验通过分别测定纯溶剂与样品提取液中添加同水平同位素内标的峰面积响应值,计算二者的相对比值来评价基质效应 (Matrix effect)。Matrix effect factor (MEF,% )[27]=(A-B)/A×100,其中MEF为基质效应因子,A为纯溶剂中内标物质的峰面积响应值,B为样品提取液中内标物质的峰面积响应值。MEF为0表示无基质效应,绝对值越大基质效应越强,在-15% ~15% 之间,表示基质效应影响不明显。
2 结果与讨论
2.1 前处理条件的优化
2.1.1 样品提取方式的优化
生物素是一种水溶性维生素,婴幼儿配方乳粉和谷类辅助食品均含有蛋白质,所以在提取目标物的同时需去除蛋白质。参考文献[23-24]和标准[12],对于婴幼儿配方乳粉中水溶性维生素主要有等电点沉淀和酸水解两种方式去除蛋白质。婴幼儿谷类辅助食品由于配方中主要原料是一种或多种谷物(如:大米、小米、小麦、大麦、燕麦、黑麦、玉米等),对于这类产品,样品中不但含有蛋白质还有淀粉,文献报道[28]和标准[12]中,主要有先酶解再用等电点沉淀、酸水解、酸水解后再酶解三种方式来沉淀蛋白质和提取目标物。本研究分别考察了不同提取方式对于蛋白质沉淀效果和生物素提取的影响。
2.1.1.1 婴幼儿配方乳粉
考察了等电点沉淀和0.1 mol/L硫酸溶解后在121℃下水解30 min的提取效果(见表3)。
研究发现,两种提取方式,蛋白质沉淀效果都比较好,滤液均一透明,均可顺利通过滤膜。由表3可见,对回收率和精密度的影响没有明显差异;基质效应都在15% 以下,影响较小。由于等电点沉淀操作相对简单,而婴幼儿配方乳粉中蛋白质以乳清蛋白 (等电点为pH 1.7) 和酪蛋白 (等电点pH 4.5) 为主,所以实验选择调p H 1.7和pH 4.5沉淀蛋白。
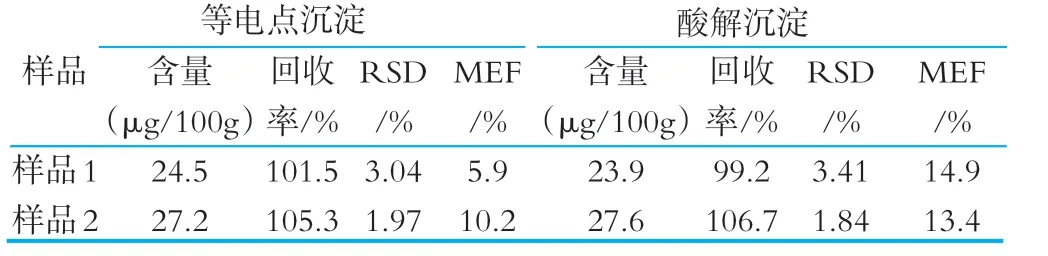
表3 不同提取方式对婴幼儿配方乳粉中回收率、精密度和基质效应的影响 (n=6)
2.1.1.2 婴幼儿谷类辅助食品
考察了不同的酶解、酸水解及其组合模式对婴幼儿谷类辅助食品中生物素的提取效果(图1)。具体考察条件如下:
(a)样品中加入45℃~50℃的水溶解混匀后,加入0.1 g淀粉酶和0.1 g木瓜蛋白酶,在55℃下酶解30 min后冷却至室温,调节试样溶液的p H至1.7±0.1,放置约1 min后,调节pH至4.5±0.1;
(b)样品用0.1 mol/L硫酸溶解后在121℃下水解30 min,调节试样溶液的p H至4.5±0.1;
(c)样品经与b相同的方式水解后,加入1 mL蛋白酶-淀粉酶液(分别称取0.2 g淀粉酶和0.2 g木瓜蛋白酶,加入20 mL水混匀),在36℃±1℃下酶解16 h。

图1 不同提取方式对婴幼儿谷类辅助食品中生物素提取的影响
由图1可见,对于婴幼儿谷类辅助食品,酶解方式生物素的含量 (图1,A) 和回收率 (图1,B) 偏低,而硫酸水解和硫酸水解之后酶解结果无明显差异。
原因可能是婴幼儿谷类辅助食品主要原料是谷物,生物素主要以与蛋白质相结合的形式存在,酶解不能完全释放生物素,只能通过高温下酸水解释放;所以a酶解方式提取婴幼儿谷类辅助食品中的生物素含量和回收率偏低。而b和c两种提取方式都经过了高温水解,因此结果差异很小。
图1,C表明,b酸水解的提取方式比有酶参与的a和c基质效应小。原因可能是酶解时,样品中蛋白质和酶自身产生了大量的肽段,干扰了质谱分析,造成离子的抑制或增强,导致基质效应大。
综合考虑样品中生物素的提取效率、基质效应和检验周期,实验选择硫酸水解的提取方式。
2.1.2 净化条件的选择
婴幼儿配方乳粉和谷类辅助食品成分复杂,通常含有大量的蛋白质、脂肪和磷脂。在样品前处理过程中,蛋白质通过水解沉淀被去除,但脂肪和磷脂会随着目标物成分一起被提取出来。这些共提取物会干扰生物素的测定,影响生物素的离子化过程,降低其离子化效率,从而影响分析的准确性;同时还会污染仪器和色谱柱。因此实验考虑采用固相萃取柱对样品进行净化。
2.1.2.1 固相萃取柱的选择
由于生物素的结构包括两个五元杂环和一个含5个碳原子的羧基侧链,所以适合反相吸附剂的固相萃取柱进行净化。而QASISPRiME HLB固相萃取柱是美国Waters公司在Oasis HLB技术基础上开发出的新型固相萃取反相吸附剂[29],无需活化和平衡,操作步骤简单。因此实验选用QASISPRiME HLB固相萃取柱净化样品。
2.1.2.2 样品提取液酸度的影响
由于生物素化学结构中含有一个戊酸侧链,其水溶液呈弱酸性pH值约为4.5,所以使用QASIS PRiME HLB固相萃取柱净化时,样品提取液的酸度可能会影响生物素在固相萃取柱上的保留。实验以生物素-d2峰面积响应值为参考,考察了上样前在样品提取液中加入1 mL 3% 乙酸溶液调节酸度和不加1 mL 3% 乙酸溶液固相萃取柱对生物素保留的影响(图2)。
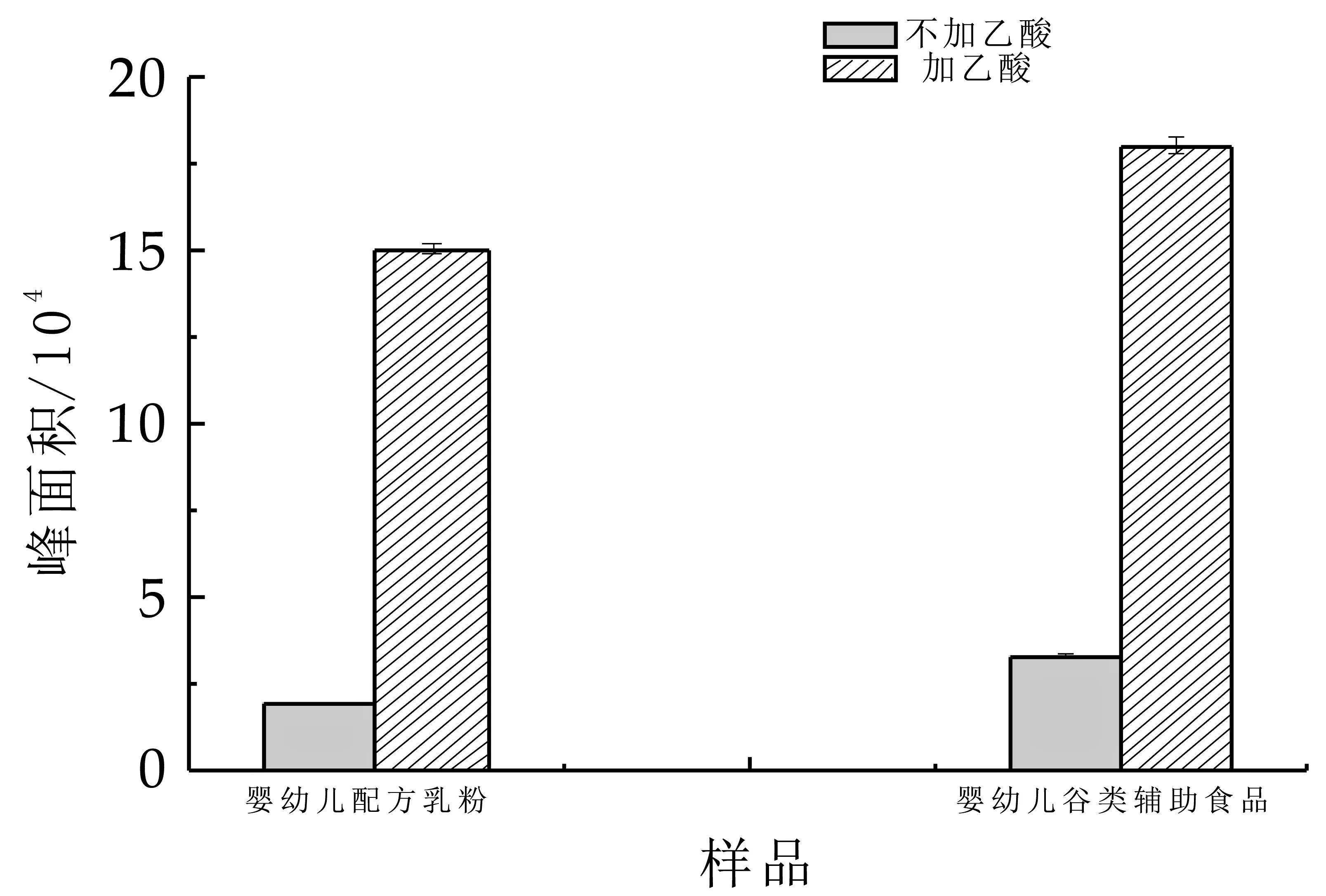
图2 样品提取液酸度的影响
实验表明,加入1 mL 3% 乙酸溶液后生物素-d2峰面积响应值是没加1 mL 3% 乙酸溶液的4至8倍,样品提取液的酸度对于固相萃取柱对生物素的保留影响比较大。原因是加入1 mL 3% 乙酸溶液后,生物素主要以分子状态存在,极性较弱,上样时能很好地保留在固相萃取柱上;没加1 mL 3% 乙酸溶液时生物素主要以离子状态存在,有较强极性,在固相萃取柱上保留较弱,上样和淋洗过程流失了大部分目标物。所以实验选择上样前加入1 mL 3% 乙酸溶液增加固相萃取柱对生物素的吸附。
2.1.2.3 净化方式的选择
由于婴幼儿配方乳粉主要以乳类及乳蛋白制品为主要原料,而婴幼儿谷类辅助食品主要原料是一种或多种谷物,二者基质差异较大;所以实验以基质效应为参考,考察了使用QASISPRiME HLB固相萃取柱净化和不使用QASISPRiME HLB净化对婴幼儿配方乳粉和婴幼儿谷类辅助食品净化效果的影响。
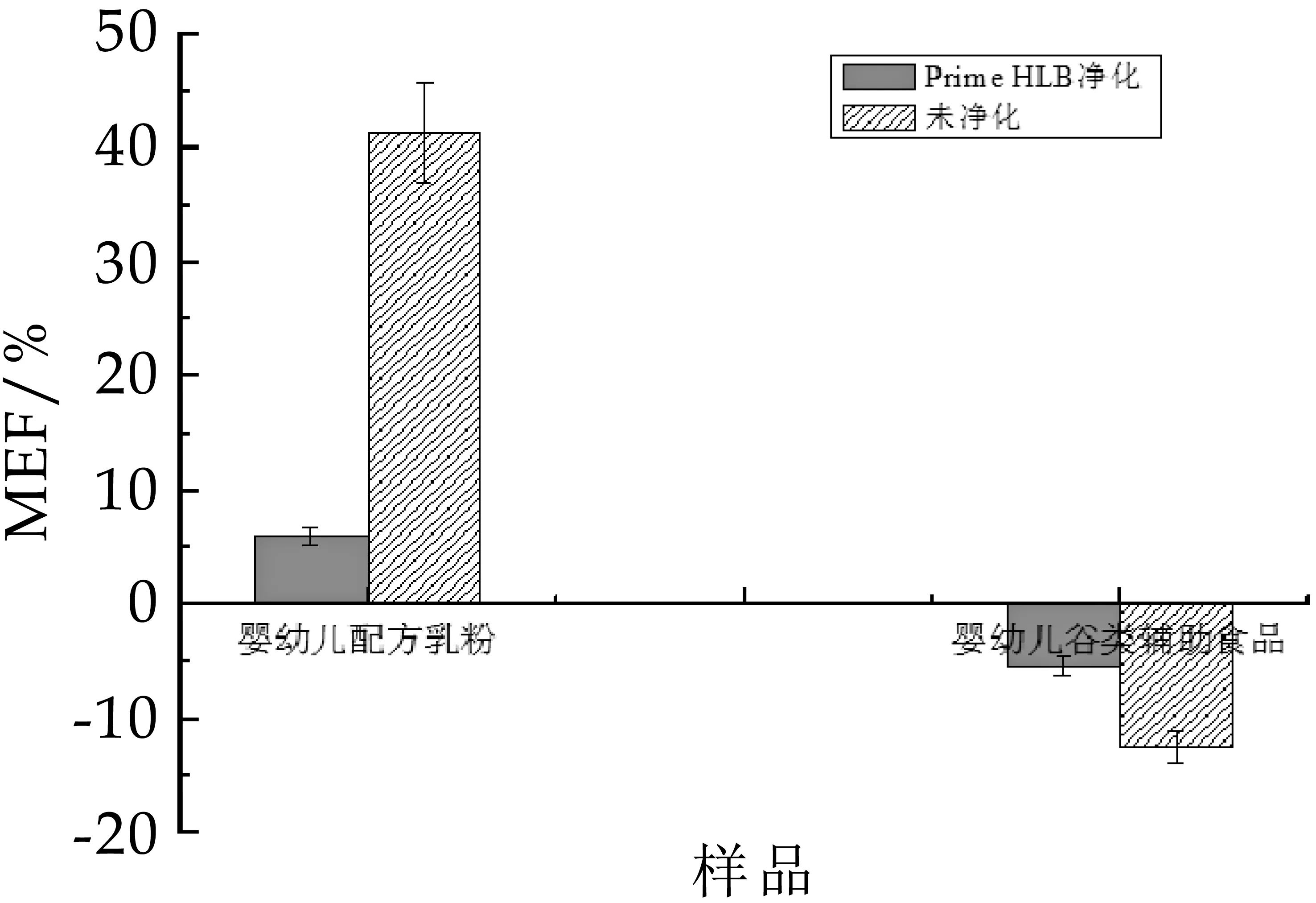
图3 样品经固相萃取柱净化和不净化对基质效应的影响
由图3可见,对于不同样品,使用QASISPRiME HLB固相萃取柱净化和不净化对基质效应的影响差异比较大。婴幼儿配方乳粉净化和不净化基质效应影响较大,净化前基质影响较大,净化后基质效应影响不明显;婴幼儿谷类辅助食品净化和不净化都在-15% ~15% 之间,无明显基质效应。
原因可能是,婴幼儿配方乳粉基质比较复杂,含有大量的蛋白质、脂肪和磷脂,不净化时,共提取物较多,基质效应明显;而QASISPRiME HLB是一种新型固相萃取反相吸附剂,比较适合去除样品中的蛋白、盐、磷脂等基质干扰物[29],净化后有效去除了此类干扰物对生物素测定的影响,降低了基质效应。对于婴幼儿谷类辅助食品主要成分是谷物,基质相对简单,净化和不净化基质效应影响都不明显。
所以实验选择使用QASISPRiME HLB固相萃取柱净化婴幼儿配方乳粉,而婴幼儿谷类辅助食品提取后直接上机测定。
2.2 分析条件的优化
2.2.1 色谱条件的优化
实验比较了Waters ACQUITY UPLC HSS T3 (2.1×100 mm,1.7μm) 和Waters ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7μm) 两种色谱柱分离效果和基质效应的差异。结果发现,两种色谱柱分离效果都比较好,但是BEH C18生物素峰面积响应值更好且基质效应比T3小。所以实验选择BEH C18色谱柱。
流动相组成能够影响目标化合物的分离、峰形和离子化效率,在相同的梯度洗脱条件下,分别比较了乙腈-0.1% 甲酸、乙腈-10 mmol/L甲酸铵(含0.1% 甲酸)、乙腈-0.1% 乙酸、乙腈-10 mmol/L乙酸铵(含0.1% 乙酸)、甲醇-0.1% 甲酸五种流动相在BEH C18色谱柱上对目标化合物分离情况、灵敏度、峰形的影响。结果表明,有机相为甲醇时生物素峰面积响应值低、杂峰较多且分离不好;当有机相为乙腈时,0.1% 甲酸和10 mmol/L甲酸铵(含0.1% 甲酸)生物素峰面积响应值与0.1% 乙酸和10 mmol/L乙酸铵(含0.1% 乙酸)相比较高,但流动相中添加乙酸铵对色谱峰峰形及灵敏度没有明显促进作用,所以选择乙腈-0.1% 甲酸为流动相。
2.2.2 质谱条件的优化
质谱条件下,生物素在电喷雾正离子化方式下,主要生成[M+H]+准分子离子峰,将100 ng/mL的D-生物素和生物素-d2混合标准溶液直接注入质谱仪,调节毛细管电压和锥孔电压得到响应较强的质量数245.3作为母离子。然后对母离子进行子离子扫描,调节碰撞能量,选择响应较高的2个子离子作为定性定量离子。其中响应高质量数227.0的作为定量离子,另质量数97.0作为定性离子,优化确定质谱条件(见表2)。
2.3 基质效应考察
在液相色谱串联质谱的应用中基质干扰效应最为常见,液相色谱-串联质谱中的基质效应产生的原因一般认为是由于基质中的非挥发性组分与待测物质,在雾滴表面离子化的过程中产生竞争,影响电喷雾接口处的离子化效率。同位素内标与目标物具有相同的化学性质和保留时间,是液相色谱串联质谱技术中消除基质干扰、提高定量准确度最有效的方法,因此实验采用同位素内标来消除基质干扰实现准确定量。实验发现,婴幼儿配方乳粉和谷类辅助食品生物素的MEF值都在-15% ~15% 之间,基质效应影响不明显。
2.4 方法学考察
2.4.1 线性范围
将1.3步骤配制的标准系列工作液按浓度由低到高依次测定,以D-生物素质量浓度(X,ng/mL)为横坐标,D-生物素与生物素-d2峰面积之比(AD-生物素/A生物素-d2)和生物素-d2质量浓度的乘积(Y)为纵坐标,绘制标准曲线(图4)。结果显示,在0.5~25 ng/mL范围内,线性回归方程为Y=1.04308x+0.0133202,R2=0.9975以上,线性关系良好。
2.4.2 检出限和定量限
按1.5前处理方法处理后,测试其信噪比,分别确定定量限和检出限。以信噪比S/N≥10得到目标物的定量限 (LOQ) ,以信噪比S/N≥3得到目标物的检出限 (LOD) 。生物素的LOD为0.75μg/100g,LOQ为2.5μg/100g。方法检出限、定量限均低于食品安全国家标准GB 5009.259-2016。可用于含量较低的样品中生物素定性定量分析。
2.4.3 回收率和精密度
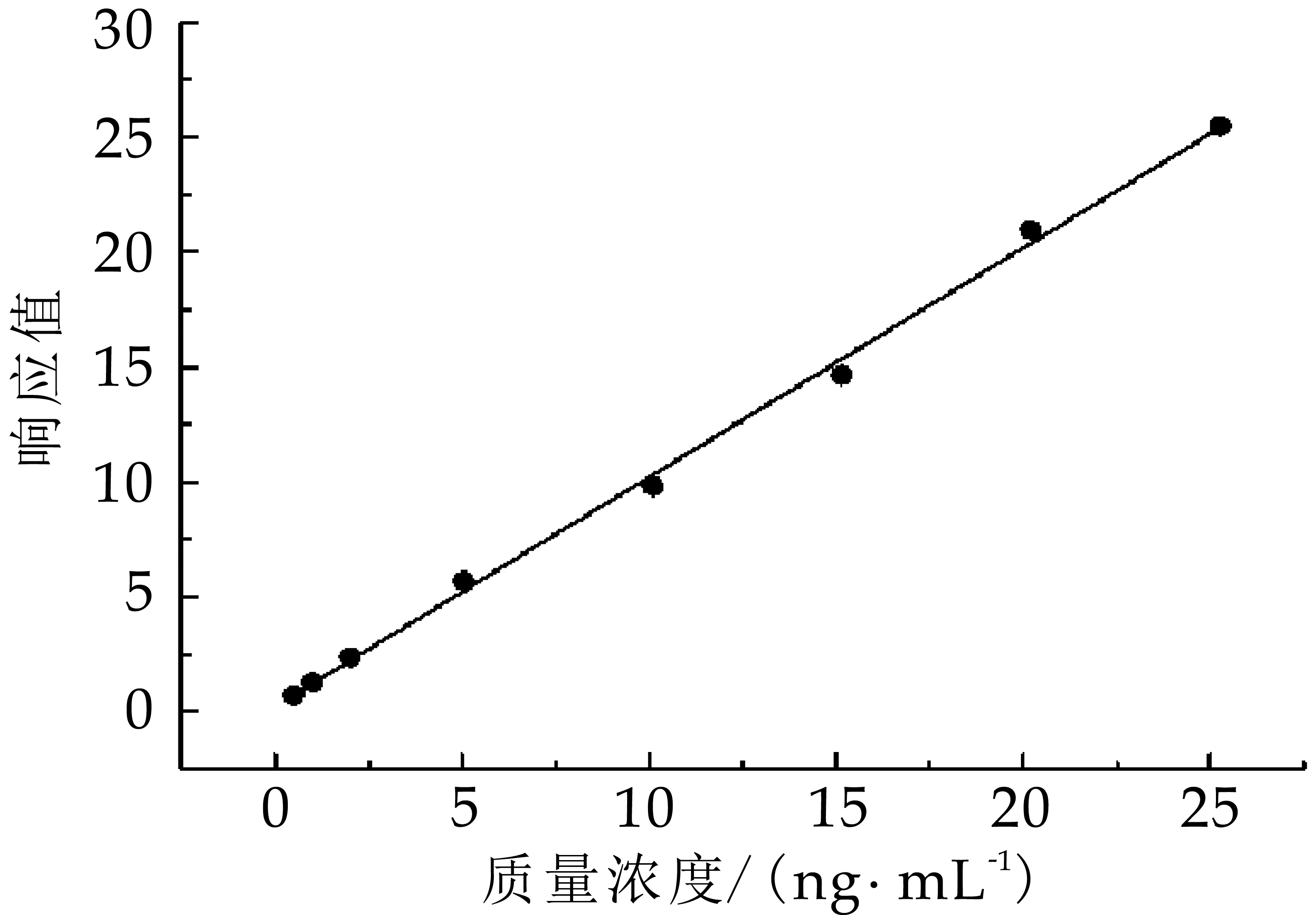
图4 生物素标准曲线
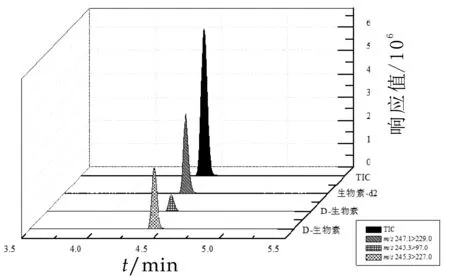
图5 标准溶液(10 ng/mL)的MRM和TIC色谱图
向婴幼儿配方配方食品和婴幼儿谷类食品中分别添加3个不同质量浓度的标准溶液进行回收率实验,各个水平平行测定6次,计算加标回收率和相对标准偏差,结果见表4。该方法的回收率为96.7% ~101.4% ,相对标准偏差为2.29% ~5.40% ,可见方法的回收率高,重现性好。对乳粉质控样品NIST SRM 1849a样品进行检测,测定结果为1.90 mg/kg,在标定值 (1.99±0.13 mg/kg) 的偏差范围内。

表4 方法的回收率和精密度 (n=6)
2.5 实际样品检测
应用本方法对市售的标示含有生物素的婴幼儿配方乳粉(10份)和婴幼儿谷类辅助食品(10份)进行分析。结果表明,生物素含量分别为婴幼儿配方乳粉13.2~38.3μg/100g、婴幼儿谷类辅助食品2.5~31.9 μg/100g。此方法可用于婴幼儿配方乳粉和谷类辅助食品中生物素含量的检测。
3 结论
本研究针对婴幼儿配方乳粉和婴幼儿谷类辅助食品两种不同基质的样品,比较了不同提取方式和净化方式对生物素的提取和净化效果的影响;建立了液相色谱-串联质谱法测定婴幼儿配方乳粉和谷类辅助食品中生物素含量的分析方法。
实验选择婴幼儿配方乳粉采用等电点沉淀方式提取生物素,而婴幼儿谷类辅助食品使用硫酸水解提取生物素;婴幼儿配方食品采用QASISPRiME HLB固相萃取柱净化,而婴幼儿谷类辅助食品基质相对简单无需净化。实验采用同位素内标法定量,降低基质效应的影响和校正前处理过程生物素损失带来的偏差;并利用质谱的高选择性,获得了稳定良好的测定结果。
本方法前处理过程简单,分析周期短、灵敏度高、精密度高、定性定量准确,适合于婴幼儿配方乳粉和谷类辅助食品中生物素含量的测定。本研究对于生产企业监控生物素强化剂量、正确标示含量水平具有重要意义,也可为政府监管提供有力的技术支持。
