芩百清肺浓缩丸对肺炎支原体感染的影响
2020-06-02杨志敏蒙艳丽王慧慧王晓溪王伟明
杨志敏,蒙艳丽,王慧慧,王晓溪,王伟明
(黑龙江省中医药科学院,黑龙江 哈尔滨150036)
肺炎支原体 (Mycoplasma pneumoniae,MP)是一种原核微生物,其细胞体积介于细菌与病毒之间,侵入机体后可粘附在宿主细胞表面,破坏细胞膜,引起肺泡损伤,从而损害肺功能。肺炎支原体肺炎 (Mycoplasma pneumoniaepneumonia,MPP)是由肺炎支原体引起的急性呼吸道感染性疾病,近年来难治性肺炎支原体肺炎病例数量明显呈现上升趋势[1-2]。
目前临床治疗肺炎支原体感染以大环内酯类抗生素为主,但大环内酯类药物常引起较重的胃肠道反应,其耐药菌株近年来也有上升趋势[3-4]。中药治疗支原体肺炎具有独特的优势,由于其作用靶点众多,表现出既能抑制肺炎支原体又可以保护肺上皮细胞,从而促进肺部损伤的修复,在临床上取得了良好的治疗效果。
芩百清肺浓缩丸(芩百) 是用于临床治疗小儿支原体肺炎的中药制剂,由黄芩、百部、地龙等6 味中药组成,具有清热解毒、润肺止咳的功效。前期实验[5-6]表明其对肺炎支原体、肺炎双球菌等具有良好的抑制作用,能促进气道组织修复和提高免疫功能。
RAS/RAF/MEK/ERK 信号级联通路又称ERK通路,是将细胞表面受体信息传递到细胞内的主要信号转导途径之一,其中MEK 是级联通路特异性决定因子的中心信号蛋白[7-9]。ERK 通路通过激酶级联反应后,磷酸化激活的ERK1/2 由胞质转位到核内,进而介导c-jun 等的转录活化,参与细胞增殖与分化、细胞骨架的构建等多种生物学反应[10]。
本研究利用支原体感染A549 细胞和BALB/c小鼠探究给药前后对细胞增殖与凋亡的影响,以及对小鼠各组实验样本MEK、c-jun 表达的影响,初步探讨芩百清肺浓缩丸促进肺上皮细胞增殖而产生修复作用的机制。
1 材料
1.1 药物与试剂 芩百清肺浓缩丸,棕色薄膜包衣浓缩水丸,由黑龙江省中医药科学院制剂室生产,符合2015 年版《中国药典》 丸剂下的各项规定;阿奇霉素分散片(批号274150404) 购自石药集团欧意药业有限公司。PPLO (批号7110677)购自美 国 BD 公 司;RPMI-1640 (货 号SH30809.01)、胎牛血清(货号SH30070.03) 购自美国Hyclone 公司;RNA 提取试剂盒 (货号DP419) 购自中国天根生化科技(北京) 有限公司;细胞凋亡检测试剂盒(货号G004-1) 购自南京建成生物工程研究所;Real-Time PCR 试剂盒(货号A6020) 购自美国Promega 公司;Mouse anti-MEK antibody (货号ab131517)、Mouse anti-c-jun antibody (货号ab32137) 均购自美国Abcam 公司;Goat anti-mouse antibody (货号ZB-2305) 购自北京中杉金桥生物技术有限公司;MTT (货号M2128)、DMSO (货号D2650) 购自美国Sigma 公司;引物均合成自上海生物工程技术有限公司。
1.2 仪器 M200 多功能酶标仪(奥地利Tecan 公司);FACSCalibur 流式细胞仪(美国BD 公司);Line Gene 9600 Real-Time PCR 仪(杭州博日科技有限公司);荧光显微镜DP72 (日本Olympus公司)。
1.3 肺炎支原体 肺炎支原体 (批号ATCC15531) 购自美国Type Culture Collection 公司,培养于含20% 胎牛血清,10% 酵母的2.1%PPLO 培养基中,每隔7 d 传代1 次。
1.4 细胞株 A549 细胞购自上海中科院细胞中心,细胞培养于含10%胎牛血清和1%青霉素-链霉素溶液的RPMI 1640 完全培养基中,置于含5%CO2、37 ℃的恒温培养箱,隔天换液。
1.5 动物 SPF 级6 周龄BALB/c 小鼠共60 只,体质量20~22 g,雌雄各半,购于辽宁长生生物技术股份 有限公 司,动物合 格证号211002300025153。小鼠饲养于室温25 ℃和湿度60% GLP 实验室。
2 方法
2.1 芩百清肺浓缩丸对A549 细胞的影响
2.1.1 含药血清制备 18 只大鼠随机分为空白组、模型组、芩百清肺浓缩丸组,每组6 只,用药剂量按成人临床剂量18 g/d 换算为大鼠等剂量后的5 倍灌胃给药,即8.1 g/kg。空白组、模型组大鼠灌胃给予等量蒸馏水,1 次/d,连续7 d。最后1次给药3 h 后,大鼠腹主动脉穿刺取血,离心,取上清,除菌,灭活,-20 ℃下保存备用。
2.1.2 MTT 法检测细胞活性 取对数生长期的A549 细胞,以细胞浓度1×104/mL (每孔100 μL)接种于96 孔板中,分为空白组、模型组、10%芩百含药血清组、20%芩百含药血清组。除空白组外,其余组使用1×105CCU 肺炎支原体感染A549 细胞4 h,使用培养液洗去不黏附的肺炎支原体。芩百含药血清组给予相应的含药血清培养基200 μL,空白组与模型组给予等量空白组血清培养基,每组设3个复 孔。3 d 后,每孔加 入50 μL MTT 溶 液(5 mg/mL),培养4 h 后吸去孔内培养液,每孔再加入200 μL DMSO,置摇床上低速振荡10 min,酶标仪测量490 nm 处各孔的吸光值(OD)。增殖率=[(OD实验组-OD模型组) /OD模型组] ×100%。
2.1.3 流式细胞术检测细胞凋亡 使用Annexin V/PI 双染检测细胞凋亡,收集生长状态良好的A549 细胞,接种于6 孔板,每孔接种1.0×106个,置于5% CO2、37 ℃的恒温箱中孵育24 h。按照“2.1.2” 项下进行分组、感染,给药48 h 后,用不含EDTA 的胰酶消化收集细胞,用PBS 洗涤细胞2 次,2 000 r/min 常温下离心5 min,弃上清,加入500 μL 结合液悬浮细胞,加入5 μL Annexin V 混匀后,再加入5 μL PI 混匀,室温避光孵育15 min,上机检测。
2.2 芩百清肺浓缩丸对MP 感染小鼠的影响
2.2.1 分组、造模及给药 小鼠随机分为空白组、模型组、芩百清肺浓缩丸(低、中、高剂量) 组、阿奇霉素组,每组10 只。模型组和各给药组小鼠滴鼻法感染20 μL 1×106CCU 肺炎支原体3 d,给药组分别灌胃予药芩百浓缩丸低剂量1.15 g/kg、中剂量2.3 g/kg、高剂量4.6 g/kg 及阿奇霉素32 mg/kg,1 次/d,给药6 d。空白组和模型组给生理盐水,给药结束后处死小鼠取出肺组织,部分HE 染色和免疫组化,部分提取RNA。
2.2.2 HE 染色肺组织形态学观察 小鼠肺组织取出后放在10%福尔马林24 h,石蜡包埋,切片在二甲苯和不同浓度酒精中浸泡,苏木素和伊红染色,显微镜拍照观察病变区及附近肺组织肺充血及肺出血、肺泡内渗出、肺泡及血管壁的中性粒细胞浸润、肺泡壁增厚程度、肺透明膜的形成等病理变化。
2.2.3 免疫组织化学法观察MEK、c-jun 蛋白表达 肺组织石蜡切片65 ℃恒温箱烘1 h,过二甲苯脱蜡、脱苯,PBS 洗涤3 次,3% H2O2去离子水孵育2 min。枸橼酸缓冲液中煮沸进行抗原修复,滴加一抗(MEK 1 ∶100,c-jun 1 ∶250),4 ℃过夜,PBS 洗 涤3 次。滴加反 应增强 液,室温孵 育20 min,PBS 洗涤3 次。滴加增强酶标山羊抗兔IgG 聚合物,室温孵育30 min,PBS 洗涤3 次。滴加DAB 溶液显色,自来水冲洗,苏木素复染,分化、冲洗反蓝,脱水、透明、封片、阅片。
2.2.4 RT-PCR 实验检 测MEK、c-junmRNA 表达 各组小鼠肺组织收集后加入TRIzol 试剂提取RNA,经酶标仪检测浓度后,RNA 稀释至100 ng/μL。实验反应体系为1 μL 组织RNA,上下游引物各1 μL,17 μL 反应液(反应液根据PCR 试剂盒说明书配制)。扩增条件为95 ℃、10 min,95 ℃、10 s,60 ℃、30 s,72 ℃、30 s,40 个循环;溶解曲线分析95 ℃、10 s,台阶采样,台阶温度0.5 ℃。引物序列为MEK正向5'-CCTGCAACTGGAAGA AGGAA-3',反向5'-AGACAGGAGGGTTGTGGATG-3'。c-jun正向5'-TCCACGGAGAAGAAGCTCAC-3',反 向 5'-CCTCTGGGTCAGGAAAGTTG-3'。β-actin正 向5'-GACGGCCAGGTCATCACTATTG-3',反向5'-AGGAAGGCTGGAAAA GAGCC-3'。
2.3 统计学分析 采用SPSS 19.0 统计软件进行分析,数据以() 表示,多组间比较采用单因素方差分析,以P≤0.05 表示差异具有统计学意义。
3 结果
3.1 芩百清肺浓缩丸对A549 细胞增殖的影响 如图1、表1 所示,随着芩百含药血清药物浓度的升高,A549 细胞OD增大(P<0.05),给药组细胞增殖率分别为36.23%、58.37%。

图1 各组OD (n=3)Fig.1 OD in each group (n=3)

表1 芩百清肺浓缩丸对A549 细胞增殖率的影响(n=3)Tab.1 Effects of QQPs on the proliferation rate of A549 cells (n=3)
3.2 芩百清肺浓缩丸对A549 细胞凋亡的影响如图2~3 所示,与空白组相比,模型组细胞凋亡率升高(P<0.05),芩百含药血清组细胞凋亡率减少(P<0.05)。
3.3 肺组织的病理改变 如图4 所示,模型组出现肺泡塌陷,肺泡壁充血,支气管上皮脱落,大量炎性细胞浸润;芩百组症状均有所改善,其中高、中剂量组与空白组的肺组织相似,低剂量组与阿奇霉素组相似,高剂量组仅有少量充血和炎性细胞浸润。
3.4 免疫组织化学法观察MEK、c-jun 蛋白表达 模型组细胞颜色着色浅且面积较小,蛋白表达较低,IHC<3 为阴性。空白组与芩百高、中、低剂量组均着色深,阿奇霉素组着色浅。与模型组比较,芩百高、中剂量 组 MEK 蛋白表 达升高(P<0.05),高剂量 组表达 高于低 剂量组(P<0.05);芩百高、中、低剂量组c-jun 蛋白表达升高(P<0.05),高剂量组表达高于低剂量组(P<0.05)。见图5~8。

图2 流式细胞术检测A549 细胞凋亡Fig.2 Resultant apoptosis rate of A549 cells by flow cytometry

图3 芩百清肺浓缩丸对A549 细胞凋亡的影响(n=3)Fig.3 Effects of QQPs on apoptosis of A549 cells (n=3)
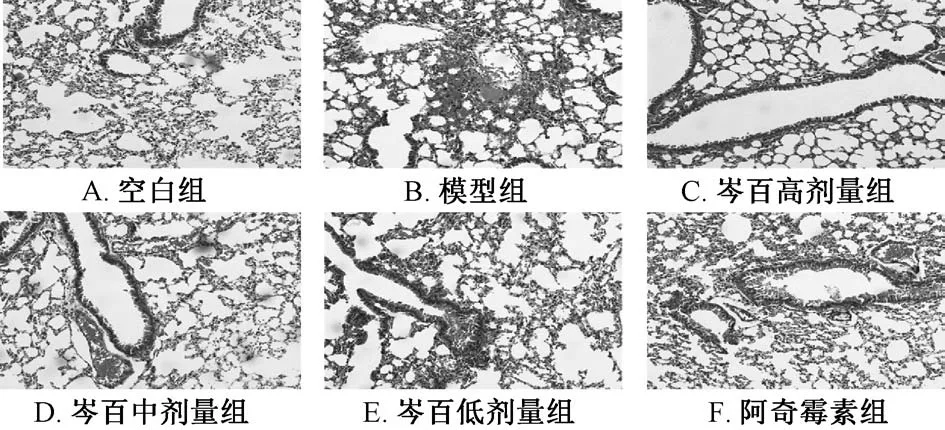
图4 肺组织病理检测(HE,×20)Fig.4 Pathological examination of lung tissue (HE×20)

图5 芩百对肺组织MEK 蛋白表达影响(×200)Fig.5 Effects of QQPs on expression of MEK protein in lung tissue (×200)
3.5 芩百清肺浓缩丸对小鼠MEK、c-junmRNA 表达影响 与模型组比较,芩百高、中、低剂量组及阿奇霉组MEKmRNA 表达升高(P<0.05),其中芩百高剂量组较中、低剂量组表达升高(P<0.05);芩百高、低剂量 组c-junmRNA 表达升 高(P<0.05);芩百高剂量组与低剂量组c-jun表达较中剂量组升高(P<0.05)。见图9~10。
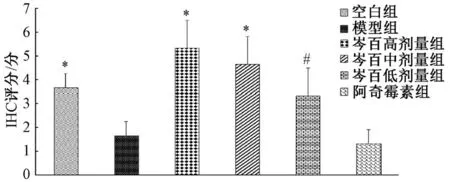
图6 MEK 免疫组化评分(n=10)Fig.6 Immunohistochemical scores of MEK (n=10)
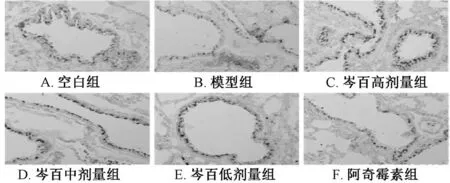
图7 芩百对肺组织c-jun 蛋白表达影响(×200)Fig.7 Effects of QQPs on expression of c-jun protein in lung tissue (×200)
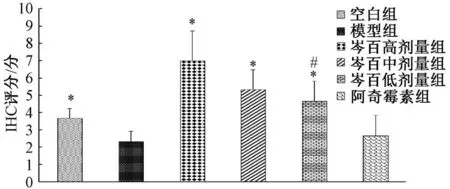
图8 c-jun 免疫组化评分(n=10)Fig.8 Immunohistochemical scores of c-jun (n=10)
4 讨论

图9 芩百对肺组织MEK mRNA 表达影响(n=10)Fig.9 Effects of QQPs on expression of MEK mRNA in lung tissue (n=10)

图10 芩百对肺组织c-jun mRNA 表达影响(n=10)Fig.10 Effect of QQPs on expression of c-jun mRNA in lung tissue (n=10)
肺炎支原体所引起的肺炎支原体肺炎占社区获得性肺炎的40%,容易在儿童中引起暴发流行,给患者肺部造成严重损伤,可累及多个系统病变,甚至直接威胁患者的生命健康[11-13]。芩百清肺浓缩丸是治疗支原体肺炎的优势中药制剂,具有多年临床研究基础,然而在确切疗效基础上,其作用机制尚不明确。课题组前期实验研究[6]提示,芩百清肺浓缩丸给药组能明显改善肺炎支原体对大鼠肺组织结构造成的异常损害,促进上皮修复和纤毛再生。本研究揭示芩百清肺浓缩丸通过提高MEK 与c-jun 的表达,进而促进肺上皮细胞增殖而起到修复作用。
本实验首先通过MTT 法对体外培养的A549 细胞增殖进行测定,显示芩百清肺浓缩丸可在体外促进肺炎支原体感染A549 细胞的增殖。进一步通过流式细胞术检测了芩百清肺浓缩丸对A549 细胞凋亡的影响,也表明芩百能够有效降低肺炎支原体感染A549 细胞的凋亡。体外实验揭示了芩百可能存在的促增殖效果,进一步的动物实验更好的说明芩百在治疗肺炎支原体肺炎,修复肺损伤方面的作用。本研究目的是探讨芩百对MEK 与c-jun 表达影响中潜在的促增殖修复机制,有研究显示,通过激活Ras-Raf-MEK-ERK 信号通路,能够使全脑I/R后小鼠的认知功能障碍得到改善[14];通过激活该通路,能够诱导大鼠血管再生、加速创伤的愈合[15]。RAS/RAF/MEK/ERK 信号通路可以将细胞外信号,如生长因子等传递入细胞核内而磷酸化核内转录因子c-jun,从而促进细胞周期G1到S 期的进展[16]。本研究运用RT-PCR 和免疫组织化学法,阐明芩百清肺浓缩丸对MEK、c-junmRNA 与蛋白表达的影响,结果显示芩百清肺浓缩丸高中低剂量组均能上调MEK 与c-jun 表达。
综合所述,芩百清肺浓缩丸可能通过激活RAS/RAF/MEK/ERK 信号通路,促进小鼠受损肺上皮细胞的增殖与修复,从而改善肺炎支原体感染后的肺部损伤,发挥治疗肺炎支原体肺炎的作用。
