血白蛋白水平对缺血性肠病预后的预测价值
2020-06-02徐乐王进
徐乐,王进
(郑州大学第一附属医院 消化内科,河南 郑州 450052)
缺血性肠病(ischemic bowel disease,ICBD)也可称为肠系膜血管病,是一组由于多种原因引起的肠道血管急性或慢性血流灌注不良而导致肠道发生器质性损伤及功能障碍的疾病,一般累积小肠和(或)大肠,包括急性肠系膜缺血(acute mesenteric ischemia,AMI)、慢性肠系膜缺血(chronic mesenteric ischemia,CMI)及缺血性结肠炎(ischemic colitis,IC)[1]。随着人口日益老龄化,血管性疾病发病率增加,该病的发病率也有增高趋势[2],但其临床表现特异性低,误诊率高,疾病进展快,预后极差,特别是AMI患者容易发展至肠坏死、多器官功能衰竭、休克等,死亡率可达50%~70%[3]。因此,寻找预测ICBD预后的生物标志物对改善该病预后具有非常重要的意义。白蛋白(albumin,ALB)是肝脏合成的一种血浆蛋白,具有多种重要的生理功能。研究表明,ALB水平与住院患者病情严重程度相关[4]。也有研究曾提到ALB是ICBD预后的保护因素[5]。但此类临床研究极少,尚无深入性研究。本研究通过收集郑州大学第一附属医院ICBD患者的资料,分析ALB对其临床预后的影响,有望为预测和改善ICBD预后提供新的方法和潜在治疗靶点。
1 对象与方法
1.1 研究对象连续性纳入于2013年4月至2019年8月在郑州大学第一附属医院住院诊疗的268例ICBD患者。纳入标准:依据《老年人缺血性肠病诊治中国专家建议(2011)》[1]。排除合并其他严重疾病及病历资料不全者。268例患者中男136例(50.6%);平均年龄(60.56±15.13)岁,老年人(≥60岁)158例(59.0%);AMI 176例(65.7%)、CMI 50例(18.7%)、IC 42例(15.7%)。根据是否发生院内死亡分为死亡组和生存组,死亡组共33例(12.3%)。
1.2 研究方法收集患者的基线资料、临床表现、检验检查资料,对生存组和死亡组的相关资料进行比较,并对相关指标进行logistic回归分析得到影响其预后的独立因素。运用受试者工作特征曲线(ROC曲线)比较ALB与其他指标预测患者预后的价值。
1.3 统计学处理采用SPSS 23.0软件分析所有数据,符合正态分布的计量资料以均数±标准差表示,非正态分布的以M(P25,P75)表示,计数资料以率(%)表示,计量资料组间比较采用独立样本t检验或非参数检验 Mann-WhitneyU检验,计数资料组间比较采用χ2检验。多因素分析采用logistic回归。运用ROC曲线下面积(area under the curve,AUC)分析各指标对预后的预测价值。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料268例患者中218例(81.3%)合并其他基础疾病,包括高血压病91例(34.0%)、冠心病59例(22%)、房颤52例(19.4%)、脑梗死41例(15.3%)、糖尿病41例(15.3%)。既往腹部手术87例(32.5%),吸烟63例(23.5%),饮酒41例(15.3%)。
253例(94.4%)患者表现为不同程度的腹痛,伴随恶心103例(38.4%)、呕吐79例(29.5%)、便血66例(24.6%)、腹泻41例(15.3%)、腹胀77例(28.7%)。36例(13.4%)有近期的体质量下降。199例(74.3%)入院在腹部体检中有阳性表现。
检验指标中白细胞计数(white blood cell count,WBC)升高者136例(50.8%),中性粒细胞百分比升高者152例(56.7%),凝血酶原时间(prothrombin time,PT)升高者48例(17.9%),活化部分凝血酶原时间(activated partial thromboplastin time,APTT)升高者23例(8.56%),D-二聚体升高者191例(71.3%),ALB降低者119例(44.4%)。
完善血管超声检查的有50例(18.7%),阳性率34.0%;CTA 199例(74.3%),阳性率93.5%;血管造影110例(41.0%),阳性率100%;腹部CT 145例(54.1%),阳性率56.6%;肠镜54例,阳性率77.8%。误诊病例54例,误诊率20.14%,误诊为肠梗阻20例,急性胃肠炎12例,急性胰腺炎8例,急性胆囊炎5例,急性阑尾炎4例,炎症性肠病5例。
2.2 治疗及预后268例患者中内科治疗137例,介入治疗103例,外科手术39例。死亡33例(12.3%),常见死亡原因有多器官功能衰竭12例,感染性休克11例,肠管大量坏死4例,消化道出血2例,急性心肌梗死2例,坏死性胰腺炎1例。
2.3 不同ICBD亚型间ALB水平比较AMI、CMI和IC 3组血ALB水平分别为 33(29,38)、38(35,41)、40(37,43)g·L-1,差异有统计学意义(P<0.05)。
2.4 生存组与死亡组临床资料比较死亡组年龄[(67.03±15.51)岁]高于生存组[(59.65±14.88)岁](P<0.05)。死亡组房颤、吸烟史、合并休克、合并腹膜炎所占比例均高于生存组,差异有统计学意义(均P<0.05);死亡组WBC、中性粒细胞百分比、PT、APTT、D-二聚体、谷丙转氨酶(alanine aminotransferase,ALT)水平均高于生存组,差异有统计学意义(均P<0.05);死亡组ALB水平低于生存组,差异有统计学意义(均P<0.05)。见表1。
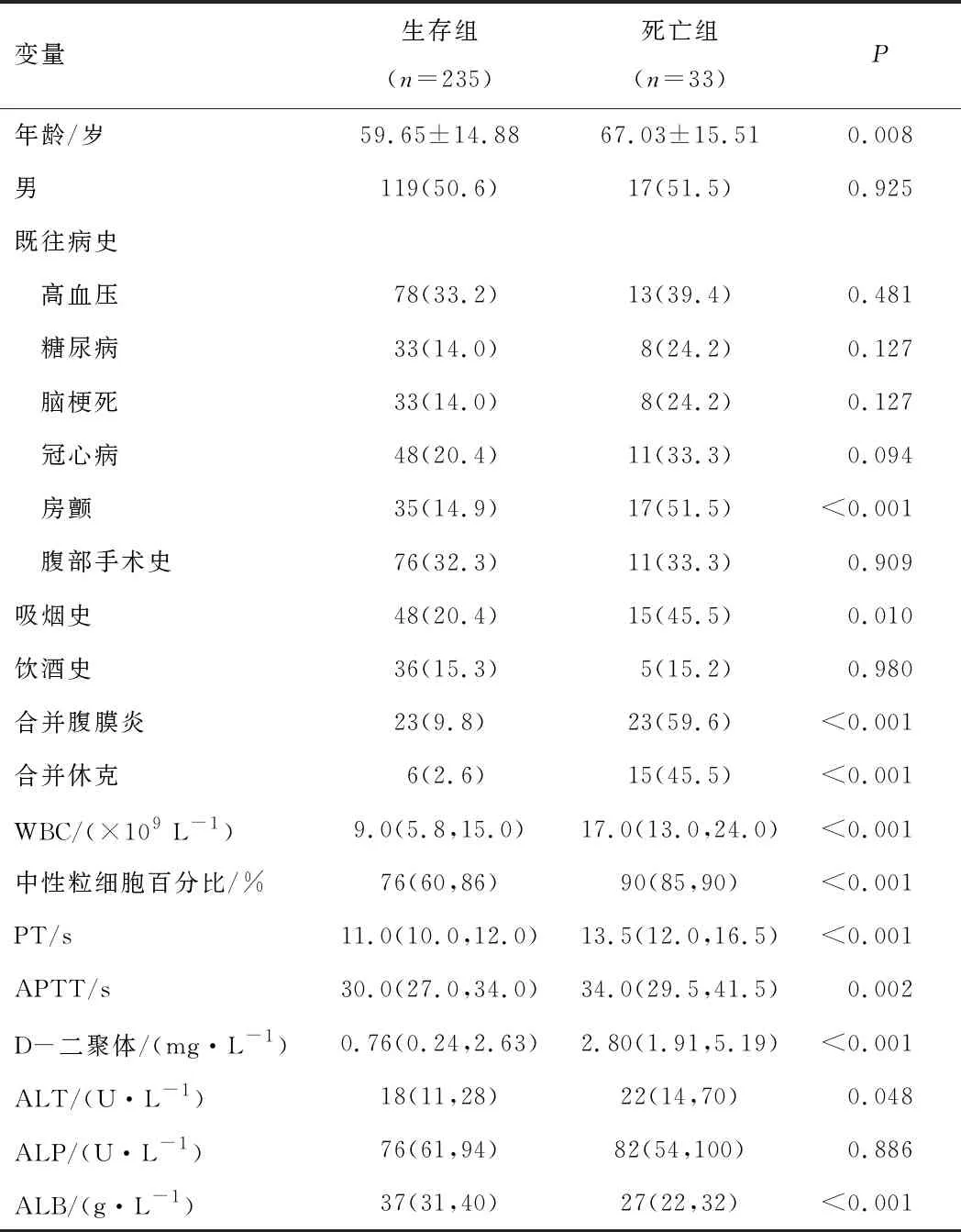
表1 生存组与死亡组一般资料与检验指标比较
注:WBC—白细胞计数;PT—凝血酶原时间;APTT—活化部分凝血酶原时间;ALT—谷丙转氨酶;ALP—碱性磷酸酶;ALB—白蛋白。
2.5 ICBD预后的影响因素分析单因素logistic回归分析发现性别、房颤、吸烟史、合并腹膜炎、合并休克、WBC、PT、APTT、ALT、ALB与ICBD预后相关;将单因素分析有统计学意义的变量纳入多因素logistic回归分析,结果显示,吸烟史、合并腹膜炎、WBC、ALB与ICBD预后相关,其中血清ALB是ICBD预后的独立保护因素(P<0.05)。见表2。

表2 影响ICBD预后的单因素与多因素logistic回归分析
注:WBC—白细胞计数;PT—凝血酶原时间;APTT—活化部分凝血酶原时间;ALT—谷丙转氨酶;ALP—碱性磷酸酶;ALB—白蛋白。
2.6 血ALB水平对ICBD预后的预测价值通过ROC曲线分析发现,WBC、中性粒细胞百分比、PT、APTT、D-二聚体、ALT、ALB均对ICBD的预后有预测价值。其中血ALB的ROC曲线下面积最大,其值为0.833(95% CI:0.768~0.898,P<0.05),对预后的预测价值最高。ALB的最佳截断值为34 g·L-1,敏感度为87.88%,特异度为61.70%,阳性似然比为2.29,阴性似然比为0.20。见表3、图1。
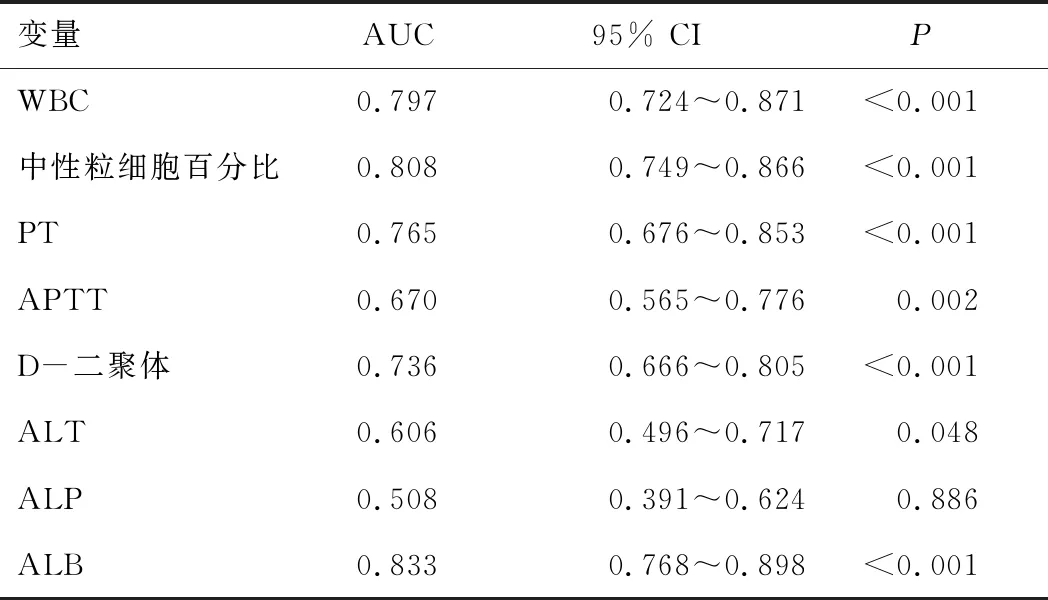
表3 各检验指标预测ICBD预后的ROC曲线下面积
注:WBC—白细胞计数;PT—凝血酶原时间;APTT—活化部分凝血酶原时间;ALT—谷丙转氨酶;ALP—碱性磷酸酶;ALB—白蛋白。
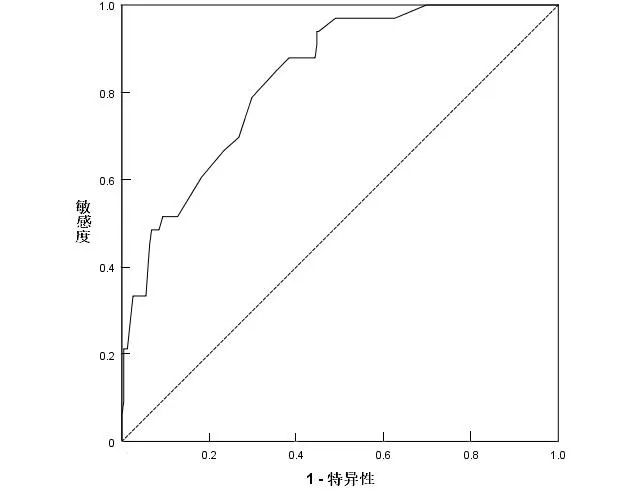
图1 血ALB水平预测ICBD预后的ROC曲线
3 讨论
ICBD以老年人为主要发病人群,有研究指出其发病率随年龄呈指数增长[6]。本研究中AMI的发病率及死亡率最高,其次是CMI,IC最低,81.3%的患者存在1种及以上基础疾病,常见的有高血压、冠心病、房颤、脑梗死等。大部分ICBD患者起病急,病情重,在临床上应该引起较大的重视。由于其症状不典型,误诊率高,本研究中患者因不同的腹部症状就诊,其中腹痛占第1位(94.4%),伴随有腹胀、恶心呕吐、便血等。但这些常见的临床症状对ICBD的诊断缺乏特异性,导致早期诊断困难,本研究误诊率达到20.14%,治疗延误可使该病病死率增高。ICBD患者可有血WBC、中性粒细胞百分比、D-二聚体等水平的增高,但是特异性较低。有研究表明α-谷胱甘肽S转移酶和肠脂肪酸结合蛋白似乎能为 ICBD的诊断及预后提供一定参考[7-8],但临床应用较少,尚需进一步研究。血管造影是ICBD诊断的金标准,本研究其阳性率达100%,但是该侵入性检查费用高、患者依从性差。其他检查如CTA及血管超声诊断率均低于血管造影。
由于ICBD的发病率、死亡率、误诊率均较高,因此,寻找一种经济方便又快捷的指标对临床上指导ICBD治疗、判断预后、改善预后具有重要意义。ALB是血浆中一种含量丰富的蛋白质,在肝脏内合成,其重要的生理作用对正常生理状态的维持至关重要[9]。ALB可以和体内的物质结合,运输内源性与外源性物质,具有维持血浆胶体渗透压及体内酸碱平衡、参与物质交换、清除自由基抗氧化、抑制血小板聚集和抗凝等功能[10]。流行病学证据表明,血清白蛋白水平低与缺血性心脏病、心力衰竭、房颤、中风和静脉血栓栓塞有关,低白蛋白血症也已成为许多心血管疾病(例如冠状动脉疾病、心力衰竭、先天性心脏病、感染性心内膜炎和脑梗死)的独立预后因子[11-12]。ICBD的发生受到各个系统疾病的影响,其中心力衰竭、心房颤动、冠心病、既往血栓病史等均为ICBD的危险因素[6,13-14]。国外有研究表明,在重症患者中,ALB每减少10 g·L-1,死亡率会上升37%[15]。本研究显示,ICBD患者死亡组的血清白蛋白水平低于生存组,差异有统计学意义(P<0.05)。经过多因素分析矫正其他影响预后的因素,得到ALB是ICBD预后的独立保护因素。比较WBC、D-二聚体等其他血液指标判断ICBD预后的AUC大小,发现ALB的AUC最大,得出血ALB水平对预后的预测价值最高。ALB为34 g·L-1时是ICBD患者预后判断的最佳临界值,对ICBD预后判断的特异度和敏感度均较高。这提示ALB>34 g·L-1时,ICBD患者预后好,死亡率低,相反ICBD患者预后差,死亡率高。
推测ALB影响ICBD预后的机制可能如下。(1)在疾病急性期机体处于高代谢状态,蛋白消耗增加,肝脏合成ALB的比例下降且合成速率降低。在严重应激和炎症时,为维持血管内外的平衡,ALB会通过毛细血管壁移到组织间隙从而重新分布,同时毛细血管内皮细胞的损伤也会加剧白蛋白的漏出[16]。低ALB水平会降低血浆胶体渗透压,大量液体潴留于组织间隙,机体有效循环血容量进一步减少,进而加剧ICBD患者肠道的缺血缺氧,引起全身多器官功能不全导致预后不良。(2)ICBD的病理生理变化如肠道黏膜屏障破坏及免疫应答损伤释放大量的炎症介质和促炎细胞因子,而ALB具有抗炎并且有清除过量自由基抗氧化的功能,在感染早期对机体具有保护性作用,因此,推测较高ALB水平可以通过减轻ICBD的炎症反应改善预后。(3)在ICBD病程中,凝血功能的改变明显对疾病的转归具有重要意义。ALB具有大量负电基团,能与抗凝血酶原Ⅲ的正电基团结合,发挥抗凝的作用[17]。Simon等[18]认为,ALB可以通过结合NO延缓其失活从而抑制血小板聚集以发挥抗凝作用,此外ALB还可以加强前列腺素的作用,通过降低血液黏度实现对血栓形成的阻碍。有研究表明,ALB发挥着显著的抗凝作用,重症患者中存在的低ALB水平会增加静脉血栓栓塞事件的发生率[19],反之高ALB水平是血栓栓塞性疾病的保护因素。
综上所述,ALB水平与 ICBD患者的预后密切相关,建议及早行临床监测,以期尽早采取相应干预措施改善预后。人血ALB在临床上被广泛用于治疗多种疾病,包括血容量不足、休克、烧伤、创伤、出血、急性呼吸窘迫综合征、血液透析、急性肝衰竭、慢性肝病、营养支持、复苏和低ALB血症等[20]。研究表明,在某些疾病早期静脉补充人血ALB会降低并发症发生率,有望改善疾病预后[15,21]。但目前尚无研究评估在疾病早期给予外源性ALB纠正低ALB血症是否对ICBD患者的预后有改善,这有望通过进一步研究为改善ICBD预后提供新的治疗思路。
