阿托伐他汀对心室重塑和心肌AVP、TGF-β1的影响
2020-06-02翟原生卢贵华李庆朗谢冬梅张菊红梅卫义高修仁
翟原生 ,李 杰,卢贵华,李庆朗,谢冬梅,张菊红,梅卫义,高修仁
(中山大学1.附属第一医院东院心血管内科/国家卫生健康委员会辅助循环重点实验室,广东广州,510080;2.附属第一医院心血管内科,广东广州,510080)
心室重塑(ventricular remodeling,VR)是心力衰竭(心衰)发生发展的重要病理生理机制。VR是指心肌损伤坏死引发了心肌细胞和间质细胞的基因、分子和细胞水平的变化,导致心脏结构和功能逐渐演变的复杂过程,表现为心肌细胞肥大、间质纤维化和心腔扩大。随着发病率的增加,心肌梗死(心梗)已成为VR 最重要的病因之一,其中心肌间质纤维化在心梗后的VR 过程中占有重要的地位[1]。心肌发生梗死后,Ⅰ型和Ⅲ型胶原增生,心肌间质胶原纤维堆积,导致心肌的僵硬度增高,顺应性减退,早期出现舒张功能减退,后期出现收缩功能恶化。传统认为血管加压素(vasopressin,AVP)主要来源于下丘脑视上核和室旁核,它的分泌增多可能是难治性心衰稀释性低钠血症的中心环节[2]。我们近年的研究发现,在心梗后心衰大鼠的血管周围心肌组织中存在着AVP的自分泌;体外实验提示心脏微血管内皮细胞可以分泌AVP,进而促进心肌纤维化[3]。多个临床试验表明他汀类调脂药降低了急性心肌梗死的死亡率[4]。他汀类药物带来的益处不仅因为其降脂作用,还因为其具有降脂以外的作用,即多效性[5-6]。近年已有多个研究显示,他汀类调脂药通过延缓心室重塑而改善心梗患者的预后[7-9]。但是关于他汀类药物改善心室重塑的具体机制仍未完全清楚。本研究旨在探讨阿托伐他汀能否通过抑制AVP 的分泌延缓心肌纤维化,为改善心梗后心室重塑提供新思路。
1 材料与方法
1.1 实验动物
雄性SD 大鼠,体质量250~350 g。购自广东省医学实验动物中心[生产许可证号为SCXK(粤)2013-0002],无特殊病原菌(SPF)级,健康状况良好,进动物房前常规检疫一周,检疫后饲养于中山大学北校园动物实验中心[动物实验室许可证号SYXK(粤):2017-0081]。饲养环境为清洁级,室温(22-25)℃,相对湿度65%;自由摄食和取水,人为提供明暗交替各12 h(由中山大学北校园动物实验中心技术人员负责)。所有研究过程均通过中山大学实验动物伦理委员会批准(动物实验伦理批件号为:SYSU-IACUC-2018-000281)。
1.2 主要材料和仪器
阿托伐他汀(辉瑞制药有限公司赠送),40 g/L多聚甲醛固定液(艾斯金生物有限公司),Arginine Vasopressin Elisa kit(上海蓝基生物科技有限公司),一抗小鼠抗大鼠Ⅰ型胶原多克隆抗体和二抗HRP 标记山羊抗小鼠IgG(武汉赛维尔生物科技有限公司),组化试剂盒DAB 显色剂(DAKO 公司),兔抗大鼠TGF-β1 多克隆抗体(美国CST公司),辣根过氧化物(HRP)标记的羊抗兔IgG(proteintech 生物公司),兔抗大鼠GAPDH 多克隆抗体(武汉谷歌生物科技有限公司),BCA 蛋白定量分析试剂盒(英国Thermo Scientific),10%水合氯醛溶液,HX-300 小动物呼吸机(成都泰盟科技有限公司),Vevo2100 小动物超声(加拿大Visual Sonics Inc),石蜡切片机和自动组织包埋机(德国LEICA),全封闭式组织脱水机(英国Thermo Scientific)。
1.3 大鼠心梗模型的建立
参考文献,结扎大鼠冠状动脉前降支建立大鼠心梗模型[10]。术前24 h 禁食,大鼠称重后用10%的水合氯醛3 mL/kg 腹腔内注射麻醉。大鼠仰卧固定在手术台上,气管插管成功后,连接小动物呼吸机进行机械通气,潮气量(6~8)mL/次,呼吸频率70 次/min。备皮,75%酒精消毒手术区域,在胸骨左缘旁第4 肋骨与第5 肋骨之间肋间隙切开约1.5 cm 大小的开口,钝性分离肌间隙肌肉,撑开并用拉钩牵拉肋间肌使心暴露;用镊子轻柔的扯破心包,用7-0 丝线在左心耳与肺动脉圆锥之间下方1~2 mm 处结扎左前降支近端,深度为(1.0~1.5)mm。若结扎后左室壁变苍白,并出现室壁运动减弱则视为成功阻断。清理胸腔,挤出胸腔内空气,用4-0 的缝合线逐层缝合肌肉,关闭胸腔消毒切口。逐层缝合胸壁,关胸后继续机械通气30 min,动物苏醒后拔除气管导管。假手术组(sham 组)的大鼠仅在左心耳与肺动脉圆锥之间下方1~2 mm 处穿线而不结扎冠状动脉,其余步骤相同。术后青霉素钠40 万单位/kg 连续3 d肌肉注射以预防感染。
1.4 动物分组及干预
36 只大鼠中,因麻醉意外死亡1 只,手术造模过程中死亡2 只,术后1 周内死亡3 只。1 周后30只SD大鼠进入实验。将实验动物分为以下3组:①假手术组:sham 组(n=10);②心肌梗死大鼠安慰剂治疗组:MI 组(n=10);③心肌梗死大鼠阿托伐他汀治疗组:A 组(n=10)。其中A 组的大鼠每天接受20 mg/kg 的阿托伐他汀灌胃治疗(悬浮于蒸馏水中),sham 组和MI 组的大鼠接受相同体积的蒸馏水灌胃,每天1 次,时间在下午5 点,干预时间为5 周。
干预5 周后,最终存活大鼠总数为29 只;sham组、MI 组和A 组的存活大鼠数分别为10、9 和10。
1.5 超声心动图检查
实验动物在处死前接受超声心动图检查,以了解大鼠心脏的左心室结构及功能。异氟烷(浓度4.0%)并持续低流量(1 L/min)给氧进行麻醉。
用胶带将大鼠固定,在大鼠胸部均匀涂抹超声耦合剂,采用21 MHz 高频探头进行检查。旋转调节探头方向。胸骨旁长轴,M-型超声长轴切面,获得M-mode 图像,取样线位于最大腔径处。对M-型超声图像进行测量,测量指标包括:左室收缩末直径(left ventricular end-systolic diameter,LVESD)、左室舒张末期直径(left ventricular enddiastolic diameter,LVEDD)、左室射血分数(left ventricular ejection fraction,LVEF)、左室收缩期末容积(left ventricular end-systolic volume,LVESV)、左室舒张末容积(left ventricular end-diastolic volume,LVEDV)。所有数据均在实验结束后,采用超声系统自带软件进行分析。超声心动图由同一位有经验的技术员进行。实验分组对超声技术员使用盲法。
1.6 标本的获取和左室质量指数的测定
大鼠称重后给予10%的水合氯醛3 mL/kg 腹腔内注射麻醉。固定,开腹,分离出腹主动脉,以10 mL 注射器抽出4 mL 血液滴入不含抗凝剂的试管中。室温放置60 min 后,置于高速冷冻离心机中2000 ×g离心15 min,取上清保存于-80 ℃超低温冰箱备用。开胸取心,4 ℃生理盐水冲洗,滤纸吸干,快速剪去大血管、心房及右心室,称取左室及室间隔质量(left ventricular mass,LVM),以该指标除以体质量(body weight,BW),计算左心室质量指数(左心室质量/体质量,LVW/BW)。将左心室组织横切成2 小块:靠近心尖的部分,包含梗死组织和非梗死组织,浸泡于40 g/L 多聚甲醛固定液中固定,留待病理切片做Masson 染色和免疫组织化学染色;靠近心底部分主要是左室非梗死组织,先液氮速冻,再转入-80 ℃冰箱保存。
1.7 酶联免疫吸附检测心肌和血清AVP 的含量
采用酶联免疫吸附实验(ELISA)检测大鼠左心室非梗死区和血清的AVP含量。按试剂盒说明书的要求准备血清和组织标本及加样,最后用酶标仪在450nm 处测吸光度值,并利用EXCEL 软件拟合四参数Logistic 曲线(4PL)计算待测样品浓度。每个样品均重复测量3 次。
1.8 Masson 染色检测心肌间质纤维化
采用Masson 染色检测左心室非梗死区心肌间质的纤维化水平。Masson 染色的具体步骤如下:①石蜡切片脱蜡至水;②重铬酸钾染色:切片入重铬酸钾浸泡过夜,水洗;③铁苏木素染色:铁苏木素A 液与B 液等比混合成铁苏木素染液;染色3 min,自来水冲洗;采用盐酸酒精进行分化处理,自来水冲洗;④丽春红染色:丽春红酸性品红液染5~10 min,自来水漂洗;⑤磷钼酸处理:磷钼酸水溶液处理1~3 min;⑥苯胺蓝染色:苯胺蓝染液染3~6 min;⑦分化:1%冰醋酸分化,两缸无水乙醇脱水;⑧透明封片:切片放入无水乙醇5 min,正丁醇5 min,二甲苯5 min 透明,晾干,中性树胶封片;⑨显微镜下(×100)观察大鼠左心室非梗死区间质纤维化情况。
1.9 免疫组化检测左心室非梗死区Ⅰ型胶原
参考文献,采用免疫组织化学染色检测左心室非梗死区Ⅰ型胶原的表达[11]。采用保存于40 g/L 多聚甲醛固定液的心肌标本固定24 h 后,经脱水、包埋,被制成石蜡切片保存(切片厚度为4 μm)。免疫组织化学染色的具体步骤如下:①石蜡切片脱蜡至水;②修复抗原:在组化圈内滴加胃蛋白酶,37 ℃孵育30 min。③阻断内源性过氧化物酶:3%过氧化氢溶液室温避光孵育25 min;④封闭:3%BSA 室温封闭30 min;⑤一抗(小鼠抗大鼠Ⅰ型胶原多克隆抗体,1∶500)4°C 孵育过夜;⑥加二抗:PBS 洗涤3 次,每次5 min。二抗(HRP 标记山羊抗小鼠IgG,1∶200)室温孵育50 min;⑦DAB 显色:PBS 洗涤3 次,每次5 min。组化圈内滴加新鲜配制的DAB 显色液;显微镜下观察控制显色时间,自来水冲洗切片终止显色;⑧复染细胞核:Harris 苏木素复染3 min 左右,自来水洗,1%的盐酸酒精分化数秒,自来水冲洗,氨水返蓝,流水冲洗;⑨脱水封片:脱水透明,晾干,中性树胶封片;⑩显微镜观察染片效果;显微镜下高倍镜(× 200)观察大鼠左心室非梗死区Ⅰ型胶原的表达水平。使用Image J 图像分析软件进行定量分析。测定阳性染色(棕黄色)的积分光密度值,其与阳性面积的比值即平均光密度值。
1.10 Western blot 测定左心室非梗死区TGF-β1蛋白的表达
采用western-blot 检测左心室非梗死区转化生长因子-β1(transforming growth factor-β1,TGFβ1)的蛋白表达水平[12]。取大鼠左心室非梗死区组织在液氮中研磨成粉末并提取总蛋白。BCA法测定蛋白浓度后,取50 μg 总蛋白上样。室温下SDS-PAGE 电泳,完毕后4 ℃、250 mA 恒流电转2 h。结束后,PVDF 膜浸泡于新鲜配制的封闭液中(5%BSA)中室温封闭1 h;加入一抗工作液(兔抗大鼠TGF-β1 多克隆抗体,1∶500 稀释),4 ℃孵育过夜;洗涤后,加入二抗工作液(HRP 标记的羊抗兔IgG,1∶10 000 稀释),室温孵育1 h。洗膜后,将PVDF 膜置于培养皿上,把配置好的发光液均匀涂抹在膜上,室温放置1~2 min,将培养皿放置于凝胶成像系统上进行曝光。用Image J图像分析软件进行分析,测定条带的光密度值。参照文献,以GAPDH 的蛋白表达水平作为内参照来校正后,TGF-β1 蛋白表达水平以MI 组和A 组与sham 组的光密度比值来表示[13]。
1.11 统计学分析
实验结果以均数±标准差或中位数和四分位数,即:M(P25~P75)表示。多组数据比较,呈正态分布并且方差齐性采用单因素方差分析(One-way ANOVA);反之使用Kruskal-WallisH检验进行分析。多组数据比较差异有统计学意义后,组间两两比较采用Bonfferroni 法。所有的统计学检验均采用双侧检验,P<0.05 为差异有统计学意义。采用SPSS 20.0 统计软件进行分析。
2 结果
2.1 左室质量和左室质量指数
Sham 组的LVM、LVMI 分别为748(721~779)mg 和1.84(1.82~1.87)mg/g;MI 组的LVM、LVMI 分别为834(777~891)mg 和2.03(1.94~2.17)mg/g;A 组的LVM、LVMI 分别为785(762~804)mg 和1.94(1.92~1.95)mg/g;3 组间差异有统计学意义(Kruskal-WallisH,LVM:H=10.665,P=0.005;LVMI:H=18.473,P<0.001);采用Bonferroni 法进一步作两两比较,MI 组的LVM、LVMI 明显高于sham 组大鼠,差异有统计学意义(P=0.016 和P=0.005);与MI 组的大鼠比较,A 组大鼠的LVM、LVMI 显著减低,差异有统计学意义(P=0.001 和P<0.001),表明阿托伐他汀治疗减轻了MI 后心室重塑(表1)。
2.2 超声心动图检测结果
采用超声心动图检测大鼠的心功能情况。结果表明,MI 组和A 组大鼠的左心室前壁的室壁运动明显减弱;3 组间比较,LVESD、LVEDD、LVESV、LVEDV 和LVEF 差异有统计学意义(LVESD:F=25.559,P<0.001;LVEDD:F=9.758,P=0.001;LVESV:F=26.988,P<0.001;LVEDV:F=10.22,P=0.001;LVEF:H=65.826,P<0.001)。采用Bonferroni 法进一步作两两比较显示,与sham组大鼠比较,MI组和A组大鼠LVESD、LVEDD、LVESV、LVEDV明显增加,提示大鼠心梗模型建立成功(P<0.001)。Sham 组和MI组的LVEF 分别为58%(54%~66%)和36%(34%~39%),两组比较,MI 组的LVEF 明显降低,差异有统计学意义(P<0.001),表明心梗大鼠的左心室收缩功能显著降低。A 组的LVEF 为46%(44%~48%);与MI 组的大鼠比较,A 组大鼠的LVEF 明显升高,差异有统计学意义(P<0.001),提示阿托伐他汀可以改善心梗大鼠的心功能(图1、表2)。
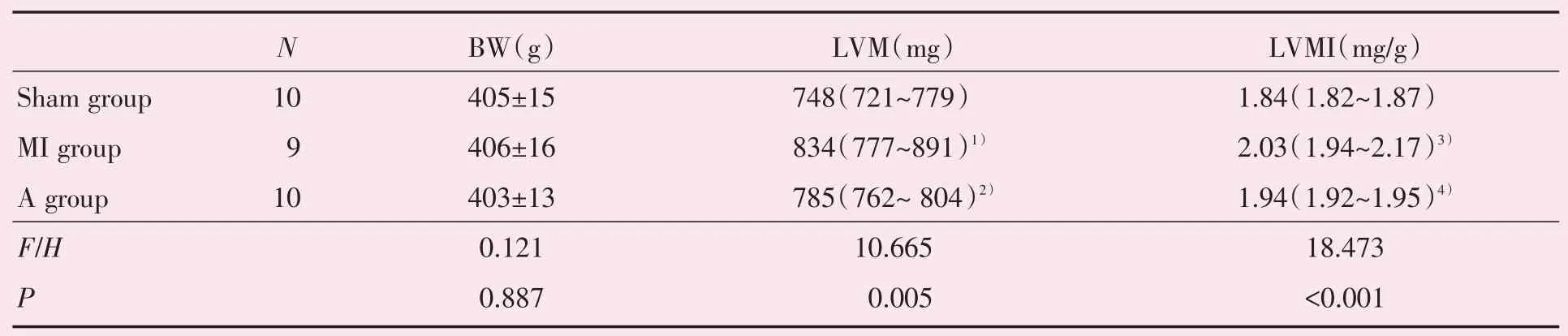
表1 大鼠左室质量和左室质量指数的结果及组间比较Table 1 LVM and LVMI of rats and comparison of three groups

图1 大鼠心功能的超声心动图检测Fig.1 Cardiac function shown by echocardiography

表2 大鼠心功能结果及组间比较Table 2 Cardiac function of rats and comparison of three groups
2.3 左心室非梗死区的Masson 染色结果
采用Masson 染色检测左心室非梗死区的纤维化水平。结果显示,左心室心肌组织Masson 染色光镜下心肌细胞呈红色,胶原纤维呈蓝色。Sham 组大鼠的心肌细胞排列整齐,无断裂;MI 组大鼠心肌细胞明显肥大,形态不规则,心肌间质见大量胶原纤维增生;A 组的细胞肥大、排列紊乱及心肌间质增生明显减轻,提示阿托伐他汀改善心肌间质纤维化(图2)。

图2 左心室非梗死区的Masson 染色(100×)Fig.2 Masson staining of left ventricular non-infarct area(100×)
2.4 左心室非梗死区Ⅰ型胶原蛋白的分布和表达
采用免疫组化染色检测左心室非梗死区Ⅰ型胶原蛋白的分布和表达。结果显示Ⅰ型胶原主要分布在心肌间质。Sham 组、MI 组和A 组大鼠左心室非梗死区Ⅰ型胶原蛋白的相对表达量分别为0.066(0.057~0.072)、0.149(0.134~0.167)和0.112(0.106~0.116);3 组间Ⅰ型胶原蛋白的表达差异有统计学意义(Kruskal-WallisH,H=24.909,P<0.001)。与Sham 组比较,MI 组的Ⅰ型胶原表达明显上调,差异有统计学意义(P<0.001);与MI 组的大鼠比较,A 组大鼠的Ⅰ型胶原表达显著上调,差异有统计学意义(P<0.001),反映阿托伐他汀能够改善心肌纤维化(图3、4)。
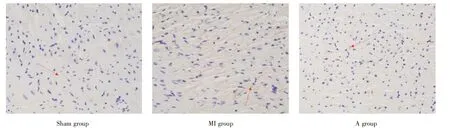
图3 左心室非梗死区的Ⅰ型胶原的蛋白表达(200×)Fig.3 Expression of type Ⅰcollagen in the left ventricular non-infarct area(200×)
2.5 左心室非梗死区心肌组织和血清AVP的含量
采用ELISA 检测左心室非梗死区和血清AVP的含量。结果表明,sham 组、MI 组和A 组在大鼠心肌组织的AVP 含量分别为(20±4)、(73±13)和(47±5)pg/g,在血清中AVP 含量分别为(344±37)、(514± 37)和(447± 28)pg/mL。3 组间比较,心肌组织和血清中的AVP 含量差异有统计学意义(心肌组织AVP:F=102.661,P<0.001;血清AVP:F=61.207,P<0.001)。与sham 组大鼠相比,MI 组心肌组织和血清AVP 的含量均明显升高,差异有统计学意义(心肌组织:P<0.001;血清:P<0.001);与MI 组相比,A 组心肌组织和血清AVP 的含量均明显降低,差异有统计学意义(心肌组织:P<0.001;血清:P=0.001);提示阿托伐他汀显著降低大鼠左心室非梗死区心肌组织和血清AVP的含量(表3)。
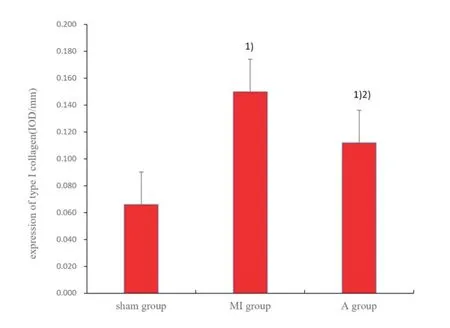
图4 左心室非梗死区的Ⅰ型胶原蛋白表达水平Fig.4 Expression of type Ⅰcollagen in the left ventricular non-infarct area
表3 大鼠心肌和血清AVP 的含量Table 3 AVP contents in myocardium and serum of the rats (±s)

表3 大鼠心肌和血清AVP 的含量Table 3 AVP contents in myocardium and serum of the rats (±s)
AVP:vasopressin ;sham group:sham surgery rats;MI group:myocardial infarction rats;A group:myocardial infarction rats fed with atorvastatin.One-Way ANOVA was used to test the difference of AVP contents in myocardium and serum between three groups(cardiac AVP:F=102.661,P <0.001;serum AVP:F=61.207,P <0.001).Bonferroni method was used for multiple comparison.1)P <0.001 vs. sham group;2)P <0.001 vs.MI group;3)P=0.001 vs.MI group
2.6 左心室非梗死区TGF-β1 的蛋白表达水平
采用western blot 检测左心室非梗死区TGF-β 1 的蛋白表达水平。结果显示,MI 组和A 组大鼠左心室非梗死区TGF-β1 的蛋白相对表达水平分别为2.86(2.68~2.94)和1.95(1.89~2.04),3 组间TGF-β1 的蛋白相对表达差异有统计学意义(Kruskal-WallisH,H=25.951,P<0.001)。MI 组和A 组比较,差异有统计学意义(P<0.001);表明阿托伐他汀可以下调心梗大鼠左心室非梗死区TGF-β1 的蛋白表达(图5)。
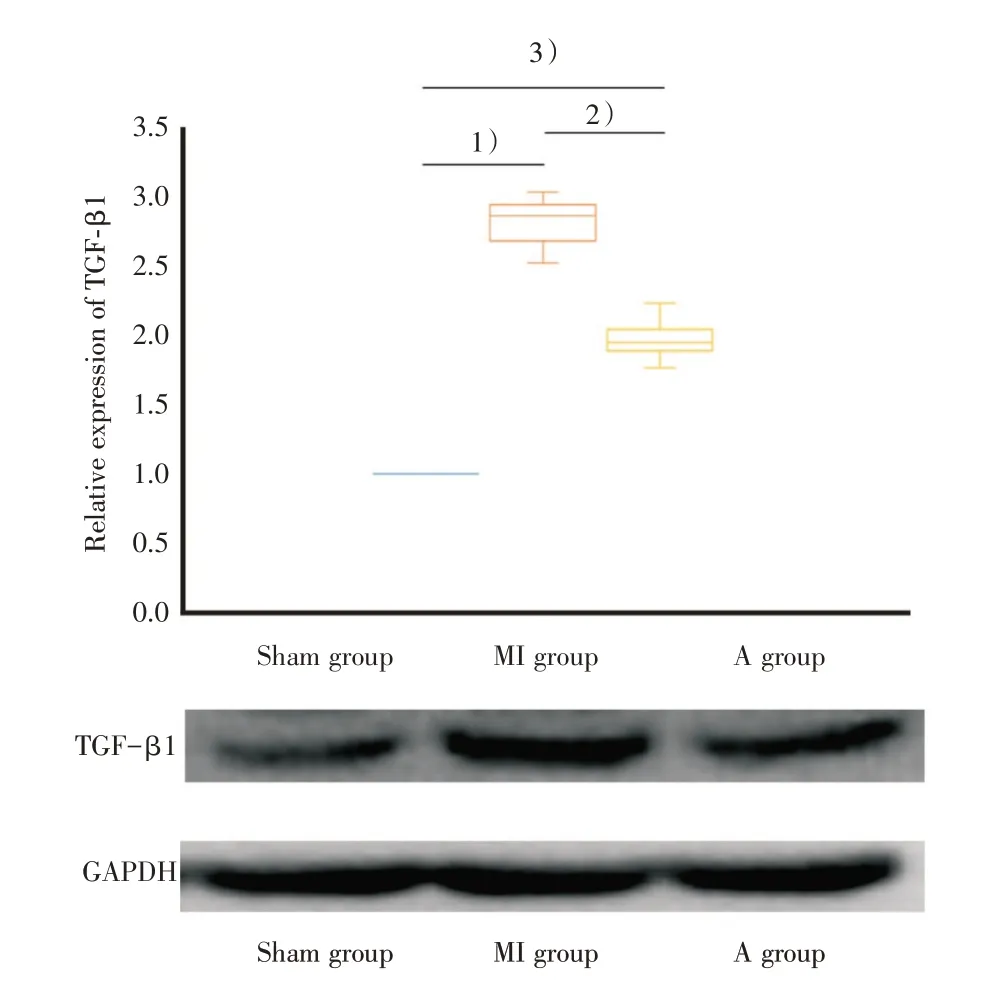
图5 左心室非梗死区TGF-β1 的蛋白表达水平Fig.5 Expression of TGF-β1 in the left ventricular noninfarct area
3 讨论
自2002 年以来,我国急性心梗的死亡率呈持续上升趋势,而心衰是急性心梗死亡的独立预测因素,因此关于改善梗死后心功能的研究是当今心血管领域的热点之一[14]。他汀类调脂药通过竞争性抑制HMG-CoA 还原酶的活性而阻断胆固醇的合成,降低低密度脂蛋白胆固醇水平,最终减少了急性冠脉综合征的发病率和死亡率。研究表明,他汀类调脂药还具有抑制炎症、氧化应激,稳定斑块、改善内皮功能、防止血栓形成等降脂以外的效应[15]。本研究发现,大鼠发生心梗后,LVESD、LVEDD、LVESV、LVEDV 增加,LVEF 降低;阿托伐他汀治疗后,LVESD、LVEDD、LVESV、LVEDV 显著缩少,LVEF 显著升高;表明阿托伐他汀治疗能够改善心梗大鼠的心功能,这与以往的研究结果相似。
既往研究表明,心梗后的心室重塑是心衰的核心机制,LVMI 增加是衡量心室重塑的重要指标[16]。心室重塑包括心肌细胞的肥大和心肌间质胶原增生堆积。其中非梗死区的纤维化是梗死后心室重塑的重要内容。本研究结果显示,与假手术组大鼠比较,心梗大鼠的LVMI 增加,左心室非梗死区Ⅰ型胶原的蛋白表达明显上调,提示心梗后左心室非梗死区发生纤维化;阿托伐他汀干预后,LVMI 减少,左心室非梗死区Ⅰ型胶原的蛋白表达下调,与心功能的改善呈正相关,表明阿托伐他汀通过减轻心肌纤维化而延缓心梗后心功能的恶化。
心衰时神经内分泌系统激活,释放多种神经内分泌激素,如AVP,促进心衰的发生发展。多项研究发现心衰患者血浆AVP 水平升高,升高程度与心衰严重程度及长期预后不良有关[17]。我们新近的研究发现,心衰大鼠血浆AVP 水平与心功能呈负相关,与心室重塑呈正相关;Kv2.1 激动剂减少心衰大鼠AVP 表达和分泌,缓解稀释性低钠血症,减轻心室重塑,阻止心功能恶化,提示血浆中的AVP 参与了心室重塑[13]。传统认为,血浆AVP主要由下丘脑视上核和室旁核的大细胞神经元合成分泌。近年多个研究报道,下丘脑以外组织也能合成AVP。既往研究怀疑心脏内可能存在AVP的自分泌,但并未作深入研究[18]。我们以前的研究发现在心梗大鼠中,随着心功能的恶化,心肌组织中的AVP 水平呈进行性升高,提示心肌组织中存在着AVP 的自分泌机制;细胞实验显示AVP 主要分布在细胞胞浆[3]。与前述研究类似,本研究发现,与假手术组大鼠相比,心梗大鼠左心室非梗死区AVP 的含量明显升高;阿托伐他汀治疗显著降低心梗大鼠左心室非梗死区AVP 的含量,提示抑制心室局部组织AVP 的合成和分泌可能是阿托伐他汀改善心室重塑的分子生物学机制之一。至于阿托伐他汀下调AVP 表达的具体机制,目前尚未完全清楚,可能与其抑制甲羟戊酸的合成有关,而与其降低血脂水平的关系不大。
在体外实验中,TGF-β1 已被证明是促进成纤维细胞增殖和转变成肌成纤维细胞的主要效应分子,然后促进这两种细胞产生大量的细胞外基质,如胶原纤维,纤维粘连蛋白等,从而促进心肌纤维化[19]。Zhai[20]等的研究发现在自发性高血压大鼠中,心肌组织TGF-β1 参与了心肌纤维化,而氟伐他汀治疗通过下调TGF-β1 的表达而减轻心肌纤维化。本研究结果显示,心梗大鼠的TGF-β1 的蛋白表达水平较假手术组大鼠明显增加,阿托伐他汀治疗显著下调了左心室非梗死区TGF-β1 的蛋白表达水平,且TGF-β1 的表达与AVP 的表达相关,表明TGF-β1 可能是AVP 引起心室重塑的下游分子。
综上所述,本研究发现阿托伐他汀可能通过减少心肌组织AVP 的合成和分泌,下调TGF-β1的表达,抑制心肌纤维化,从而改善心室重塑,最终延缓心梗后心功能的恶化。
