Periostin对接触性超敏反应中的中性粒细胞调控作用的影响
2020-06-02张钟元姜美花
张钟元,姜美花
(中山大学中山医学院干细胞与组织工程研究中心,广东广州 510275)
炎症反应是免疫系统对感染和组织损伤的一种急性反应,能够保护机体免受损伤。而长期慢性的炎症反应是有害的,在关节炎、阿尔茨海默病、1 型和2 型糖尿病以及心血管病等疾病的发展中起着重要作用[1-2]。Periostin 又被称为成骨细胞特异性因子2(osteoblast-specific factor2),1993 年被首次发现[3],并根据其在成年小鼠牙周韧带和骨膜中的表达而命名。随后的研究显示,Periostin广泛存在于各种正常成人组织和胎儿组织中,包括胚胎骨膜、牙周韧带、胎盘、心脏瓣膜、肾上腺、肺、甲状腺组织等,在体内发挥重要的作用。研究发现,Periostin 在慢性炎症性疾病如哮喘、特应性皮炎、嗜酸性粒细胞性慢性鼻窦炎/慢性鼻窦炎伴鼻息肉、过敏性结膜炎中高表达,并在这些疾病的发病机制中起重要作用[4]。接触性超敏反应(contact hypersensitivity,CHS)是作为典型的炎症反应动物模型而广泛使用,其发生过程和发生机制复杂,由多种免疫细胞共同参与,其中炎症早期中性粒细胞起到了重要的驱动作用。已有研究表明,Periostin 分别与炎症中后期T 细胞、B 细胞以及巨噬细胞之间存在相互作用并影响炎症反应过程,而Periostin 对中性粒细胞的影响尚不清楚。因此,本研究主要探讨了Periostin在接触性超敏反应早期对中性粒细胞的调控作用。
1 材料与方法
1.1 实验动物与分组
正常野生型(WT 组)(购自中山大学动物实验中心)和Periostin 敲除(POSTN-/-组)(购自厦门大学)C57 小鼠,雄性,10 周龄,SPF 级。饲养于中山大学动物实验中心SPF 级饲养室,本研究已通过实验动物伦理委员会审查,饲养条件遵照《实验动物环境及设施国家标准(GB149252001)》规定,对实验动物的处理根据中山大学动物实验中心的实验动物操作标准进行。
1.2 CHS 模型制备
使用1%戊巴比妥钠轻度麻醉小鼠,千分尺测量小鼠双耳顶端下缘厚度并记录基础值;在背部剃毛1.5 cm2区域,涂抹0.5%致敏剂[2,4-二硝基氟苯(2,4-dinitrofluorobenzene,DNFB)溶于橄榄油与丙酮按1∶4 比例配成的混合液中]25 μL 进行预致敏;5 d 后,在小鼠右耳双面分别涂抹0.2%致敏剂(DNFB 溶于橄榄油与丙酮按1∶4 比例配成的混合液中)10 μL,左耳双侧不涂作为对照[5];致敏后24 h 测量耳廓厚度。
1.3 流式细胞术检测中性粒细胞比率
CHS 造模后分别取WT 组及POSTN-/-组小鼠各3 只,麻醉后,剪取耳组织并将其剪碎,加入IV型胶原酶(thermo 美国)、DNaseⅠ(thermo 美国),用组织匀浆仪制备细胞悬液,离心后弃上清,PBS(phosphate buffer saline,磷酸缓冲盐溶液)重悬;加入红细胞裂解液(1∶10;Biogems 美国),室温避光10 min,离心后弃上清,PBS 重悬;加入小鼠流式抗体Anti-mouseIgG1 CD45-PE(1∶100;Abcam英国)、Anti-mouse IgG2a CD11b-FITC(1∶100;Abcam 英国)、Anti-mouseIgG1 ly6g-PEcy7(1∶100;Abcam 英国),4 ℃避光孵育30 min,PBS 清洗、离心、重悬。4 ℃避光孵育30 min,PBS清洗、离心、重悬流式细胞仪检测CD45+CD11b+及ly6ghigh 细胞群。
1.4 HE 染色
65 ℃烤片2 h;二甲苯脱蜡,洗脱3 次(10 min/次);依次用100%、95%、85%和70%的酒精、去离子水梯度去除二甲苯,每步浸泡5 min;依次用苏木素、伊红染色;依次使用70%、85%、95%和100%的酒精梯度脱水,每步浸泡5 min;二甲苯透明10 min后,使用中性树胶封片。
1.5 免疫组化染色
65 ℃烤片2 h;二甲苯洗脱3 次(10 min/次);依次用100%、95%、85%和70%的酒精、去离子水梯度去除二甲苯,每步浸泡5 min;柠檬酸盐缓冲液浸泡玻片,95 ℃水浴15 min,进行抗原修复;用3% H2O2封闭15 min,PBS 漂洗3 次,5 min/次;山羊血清封闭10 min;孵育一抗Anti-mouseMPO(Abcam 英国)、Anti-mouse ly6g(Abcam 英国),4 ℃过夜;使用免疫组化试剂盒(迈新),加入A液、B 液、C 液;使用DAB 显色试剂盒(迈新)显色;苏木素复染细胞核;分别用70%、85%、95%和100%的酒精梯度脱水,每步浸泡5 min;二甲苯透明10 min 后,使用中性树胶封片。
1.6 RNA 提取、逆转录及qRT-PCR
小鼠耳朵剪碎,加入钢珠及1 mL Trizol,组织震荡匀浆仪研磨,加入氯仿0.2 mL,充分震荡,室温放置5 min,4 000 ×g离心15 min,取上层水相,加入等量异丙醇,室温静置10 min,4 000 ×g离心10 min,弃上清,75%乙醇洗2 次,4 000 ×g离心5 min,吸除乙醇,室温静置晾干,适量DEPC 水溶解。逆转录试剂盒(novoprotein)合成cDNA 后进行实时荧光定量PCR(qRT-PCR),反应体系包括cDNA 1 μL、上下游引物各1 μL、2× Mix 10 μL、DEPC 水7 μL,引物序列如表1 所示;反应条件:95 ℃10 min,95 ℃5 min,60 ℃30 s,72 ℃30 s,设置45 个循环。

表1 小鼠qRT-PCR 引物序列信息Table 1 Mouse qRT-PCR Primer Sequence Information
1.7 统计学分析
实验数据采用Excel、Graphpad、Image J 进行统计学分析,服从正态分布的计量资料以均数±标准差表示,两组间比较采用两独立样本t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 Periostin 敲除参与促进CHS 早期阶段耳廓肿胀过程
为了证明Periostin在CHS早期对肿耳的影响,本研究比较了POSTN-/-组 与WT 组在CHS 造模后24 h 小鼠耳廓的肿胀程度。HE 低倍镜(50×)下示Periostin 敲除后耳朵肿胀程度更明显(图1A),经千分尺测量POSTN-/-组(n=6)耳廓厚度较WT 组(n=6)明显增大[厚度增加均值为27.83 μm,其95%置信区间为18.57~37.10 μm,(158.30±2.95)μmvs(130.50 ± 2.93)μm,t=6.693,P<0.000 1;图1B],差异有统计学意义。
2.2 Periostin敲除增加耳组织炎症细胞浸润数目
本研究采用HE 染色观察CHS 后炎症细胞募集情况。结果显示,CHS 造模后耳组织中被募集的炎症细胞总体数目POSTN-/-组明显高于WT 组[增加细胞均数为27.67(个),其95%置信区间为21.81~33.52;n=3;40.67 ± 1.76vs13.00 ± 1.16,t=13.12,P=0.000 2;图2]。
2.3 Periostin 敲除前后肿耳组织中性粒细胞的浸润比率
由于炎症反应早期的主要效应细胞为中性粒细胞,因此本研究采用免疫组化染色以及流式细胞分析的方法反映了接触性超敏反应早期中性粒细胞在肿耳组织的浸润程度。免疫组化结果表明在CHS 发生后24 h,POSTN-/-组较WT 组中性粒细胞浸润数目明显增加[增加细胞均数为16.67个,其95%置信区间为12.63~20.70,n=3,(14.00 ±1.16)vs(5.33 ± 0.88),t=5.965,P=0.004;图3C、D],流式结果与免疫组化结果一致,POSTN-/-组较WT 组中性粒细胞比率更高[增加比率为14.12%,其95%置信区间为(11.89~16.35)%,n=3,(39.42±0.43)%vs(25.30±0.68)%,t=17.56,P<0.000 1;图3F]。
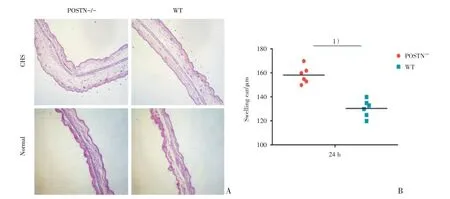
图1 Periostin 敲除促进CHS 早期阶段耳廓肿胀Fig.1 Periostin deficiency caused significant ear swelling in the early stages of CHS
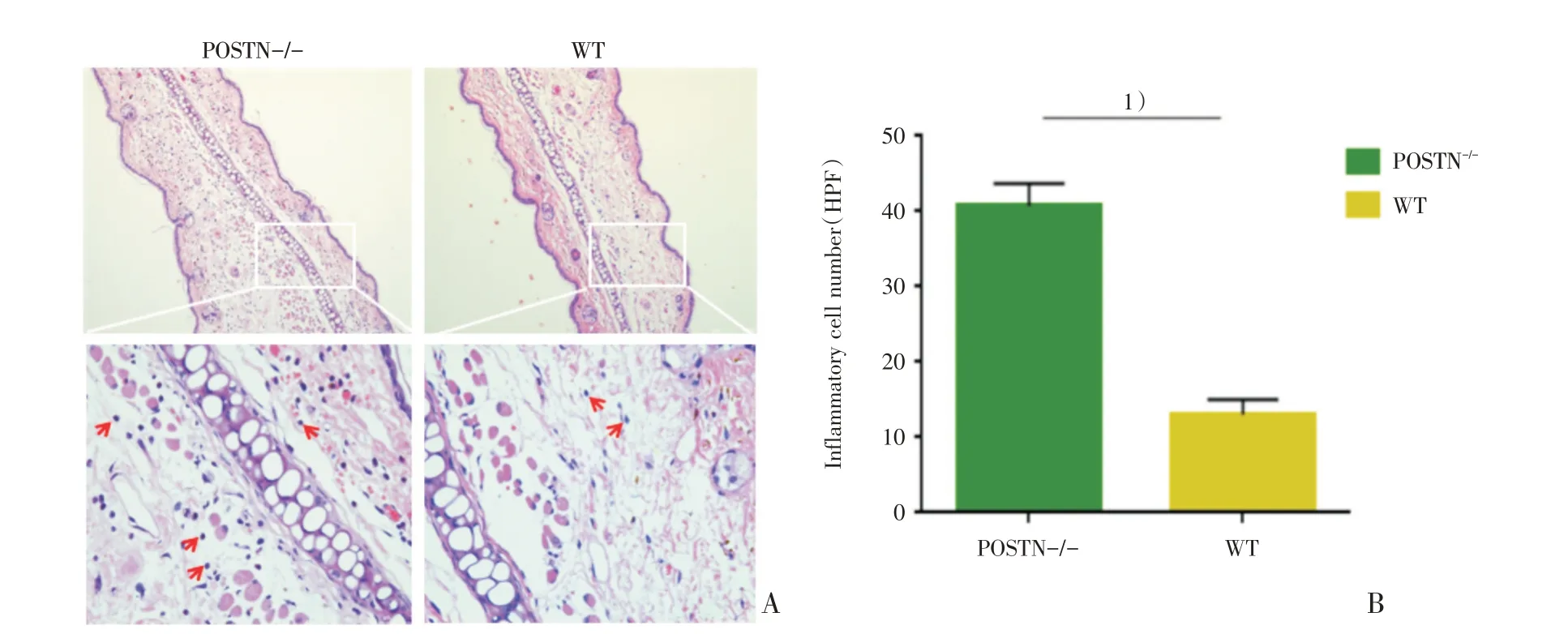
图2 CHS 造模后POSTN 敲除组肿耳组织炎症细胞的浸润增多Fig.2 The inflammatory cells infiltration in the swollen ear tissue increased in POSTN-/-group after CHS
2.4 Periostin敲除前后耳廓组织炎症因子的表达
炎症反应早期中性粒细胞浸润与中性粒细胞相关的趋化因子和细胞因子有显著相关[12]。CHS 后24 h,POSTN-/-组 与WT 组 相 比,CXC 家族趋化因子CXCL1/CXCL2/CXCL9/CXCL10,CC 家族趋化因子CCL2/CCL3/CCL4,促炎型细胞因子IL-6/IL-18/MIF,在mRNA 水平表达上升。其中CXCL1(t=7.621,P=0.004 7)和CXCL2(t=65.90,P<0.000 1)是募集中性粒细胞的主要趋化因子(图4)。
3 讨论

图3 致敏后耳廓组织中中性粒细胞的浸润比率在perionstin 敲除鼠显著增高Fig.3 Neutrophil infiltration rate was significantly higher in perionstin knockout mice in the auricle tissue after DNFB treatment
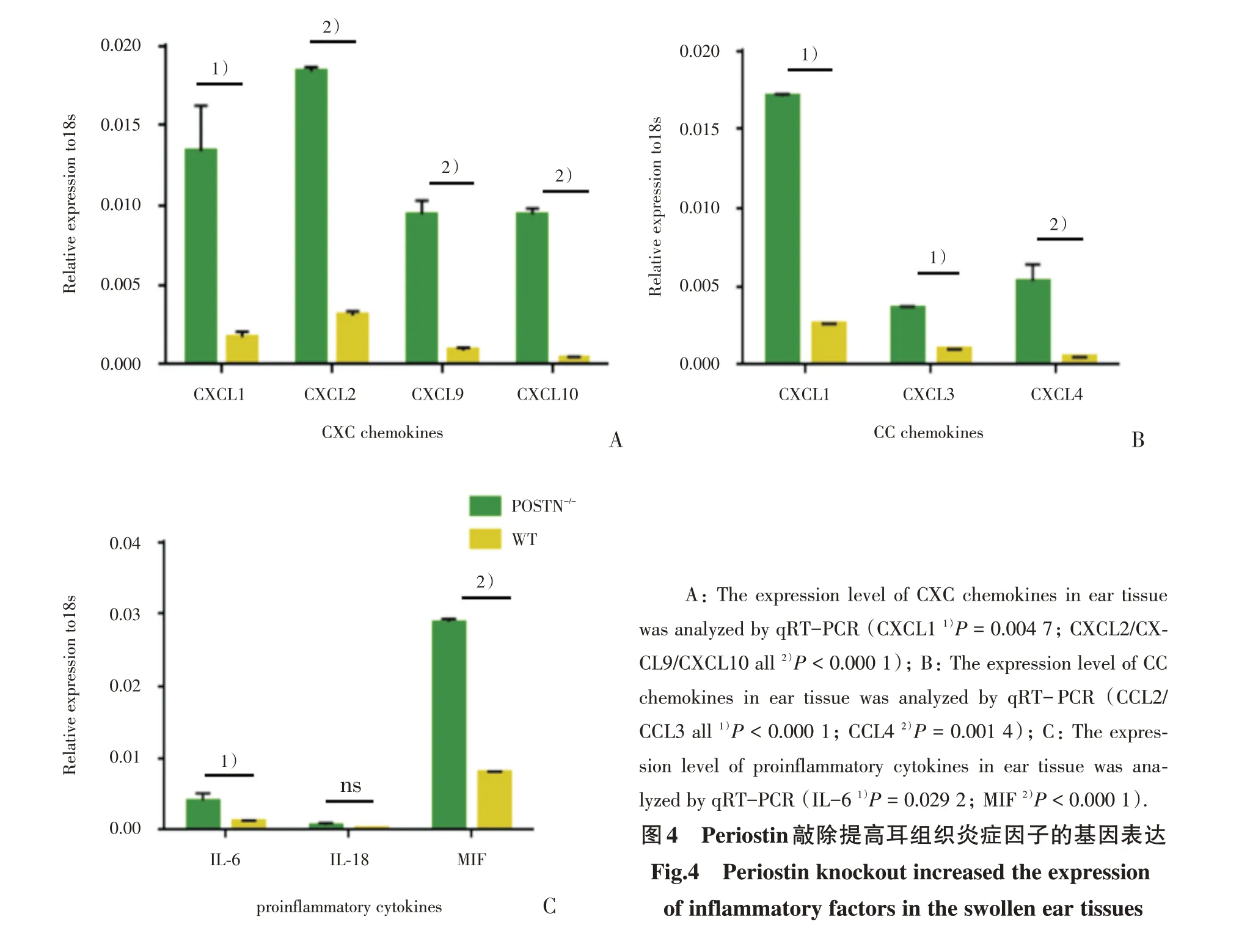
图4 Periostin 敲除提高耳组织炎症因子的基因表达Fig.4 Periostin knockout increased the expression of inflammatory factors in the swollen ear tissues
已有的研究表明,Periostin 作为一种分泌蛋白,在多种间质细胞中有表达,同时参与免疫炎症发展过程的调节。炎症过程经过早期的中性粒细胞浸润,随后炎症因子释放从而招募巨噬细胞,T细胞以及B 细胞等共同参与[6]。有研究显示,胶质瘤细胞可通过分泌Periostin 招募M2 型肿瘤相关巨噬细胞,在胶质瘤发病过程中,发挥免疫抑制作用并促进肿瘤生长[7]。骨髓间充质细胞分泌的Periostin 通过调节白血病细胞释放的CCL2 能够促进急性B 淋巴细胞白血病的疾病进展[8]。在慢性过敏反应中,Periostin 还可影响Th2 效应细胞的作用从而加重过敏症状[9]。而Periostin 是否对炎症早期中性粒细胞具有调控作用,以及针对中性粒细胞在具体疾病中是否具有重要意义等的研究尚未得到证明。
炎症是机体组织对有害刺激包括病原体、受损细胞以及刺激物在内的复杂生物反应的一部分,是涉及免疫细胞、血管和分子介质的保护性反应,在疾病进展中具有重要意义[10-11]。早期炎症反应对于疾病的发生发展尤为重要。因此本研究主要揭示了在炎症反应发生的早期阶段,发挥主要作用的中性粒细胞与Periostin 之间的相关性。CHS 模型是与人接触性过敏性皮炎相对应的动物模型,是一种因反复接触过敏原而引发的炎症性皮肤病,属于迟发型超敏反应。在致敏情况下,肥大细胞会首先触发中性粒细胞的募集,且中性粒细胞会进一步以群集方式促进自身的募集,随后树突状细胞激活并迁移,以及致敏原诱发的特异性效应性T 细胞的启动。此外,也已有文献证明,在博来霉素诱导形成的肺纤维化小鼠模型中,Periostin 对趋化因子的表达很重要,能够协同诱导多种趋化因子和细胞因子的产生从而招募中性粒细胞和巨噬细胞到达损伤部位[12-14]。本研究显示,在CHS 发生24 h,POSTN-/-组耳组织肿胀程度较WT 小鼠显著,且炎症细胞浸润数目增多,其中以中性粒细胞浸润为主。POSTN-/-组中性粒细胞浸润比例与中性粒细胞相关趋化因子和促炎因子表达水平均显著增加。以上结果显示,在炎症反应早期过程中,Periostin 参与调控中性粒细胞的相关趋化因子以及促炎型细胞因子的表达水平,并且提高了中性粒细胞在炎症部位的浸润以及炎症造成的肿胀。而关于Periostin 与中性粒细胞之间的相互作用的具体分子机制仍需进一步深入探究。
在多种临床疾病的进展中,炎症反应是必不可少的重要病理过程,因此能够在早期对中性粒细胞进行调控对控制疾病发生发展起到关键作用,Periostin 是否能够做为疾病干预靶点尚有待于进一步研究。本研究利用Periostin 敲除小鼠的CHS 动物炎症模型,初步证明了Periostin 的缺失促进炎症早期组织内中性粒细胞浸润及趋化因子的表达,阐明了Periostin 具有调控中性粒细胞的作用,并为以中性粒细胞炎症过程为主要病理过程的相关疾病研究提供新思路,为后续的临床治疗研究提供新靶点。
