缺氧条件下乙酰肝素酶抑制剂PI-88对人视网膜血管内皮细胞自噬的影响
2020-06-02苑玉鑫李树华苏焜仪
苑玉鑫,李树华,玄 猛,苏焜仪,吕 林,胡 洁
(1.中山大学中山眼科中心//眼科学国家重点实验室,广东广州 510060;2.广州中医药大学第二附属医院//广东省中医院,广东广州 510120)
视网膜新生血管性疾病,例如增殖性糖尿病视网膜病变和早产儿视网膜病变通常是由于视网膜的缺血和缺氧引起的[1-2]。众所周知,血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)在新生血管的形成过程中起着重要作用[3-6]。目前,玻璃体腔注射抗VEGF 药物已成为视网膜新生血管性疾病的一线临床治疗方法,但是,在临床实践中发现应用抗VEGF 药物并不能完全阻止这类病变的发生发展[2],绝大多数患者需要反复的治疗,此外,部分患者对抗VEGF 药物无应答。因此,寻找VEGF 之外的其他治疗靶点是迫切和必要的。越来越多的研究发现在缺氧条件下,自噬能促进肿瘤组织和心血管系统的新生血管形成[7-9],并且该过程不伴随VEGF表达水平的变化[7],提示自噬可能是引起新生血管形成的另一途径。因此,从细胞自噬的角度研究视网膜新生血管性疾病可能为其治疗提供新的思路。最新的研究表明,哺乳动物中唯一的细胞外基质裂解酶-乙酰肝素酶(heparanase,Hpa)可以正向调控肿瘤胶质细胞的自噬水平,当敲除小鼠胚胎纤维母细胞的Hpa 后,细胞的自噬水平降低[10]。然而,在缺氧状态下,Hpa 对人视网膜血管内皮细胞(human retinal endothelial cells,HREC)自噬水平的影响尚未见报道。本研究拟通过观察缺氧状态下,Hpa 的竞争性抑制剂-硫代磷酸甘露醇戊糖(phosphomannopentaosesulfate,PI-88)[11]对HREC 自噬的作用,探讨Hpa 对HREC 自噬的影响。
1 材料与方法
1.1 主要试剂
HREC 购自西班牙innoprot 公司;内皮细胞培养基(Endothelial Cell Medium)培养基(美国Sciencell 公司),胎牛血清(美国Sciencell 公司),内皮细胞生长补充剂(endothelial cell growth supplement,ECGS,美国Sciencell 公司),双抗混合液(青霉素+链霉素,美国Sciencell 公司);PI-88(澳大利亚Progen Industrials 公司);氯化钴(CoCl2,美国Sigma公司);PBS 溶液(美国Hyclone 公司);40 g/L 多聚甲醛(广州威佳科技有限公司);兔抗人LC3B 抗体、兔抗人GAPDH 抗体、AlexaFluor 488 羊抗兔二抗、HRP-山羊抗兔二抗(美国CST 公司);HB AP 210 0001 绿色荧光蛋白自噬相关蛋白标记腺病毒(上海汉恒生物技术有限公司);DAPI(Sigma 公司);牛血清蛋白(美国Sigma 公司);TritonX-100(北京博奥森公司);抗荧光衰减封片剂(Vector 公司);BCA 蛋白定量试剂盒(thermo 公司);PVDF 膜(Milipore 公司);激光共聚焦显微镜(德国Zeiss 公司);Western Blot配胶试剂盒、细胞裂解液(RIPA)、蛋白酶抑制剂(PMSF)、5×Page 蛋白电泳上样缓冲液(碧云天生物)。
1.2 细胞培养及干预
HREC 的细胞系放置于37 ℃,体积分数5%的CO2的培养箱中培养,在细胞生长至80%~90%融合时传代,取对数生长期的细胞用于实验。使用100 mL/L 的胎牛血清、1%ECGS 及1%抗生素(青霉素+链霉素)的ECM 培养基培养。细胞培养液中加入PI-88 在的终浓度为5 μg/mL。本实验共分为3 组:正常组(ECM 空白对照)、缺氧组(含CoCl2 100 μmol/L 的培养液中培养24 h)、实验组(缺氧+PI-88 组,PI-88 终浓度5 μg/mL 在CoCl2100 μmol/L 的培养液中培养24 h)。
1.3 Western Blot
收集每组的HREC,用含有蛋白酶抑制剂(PMSF)的细胞裂解液(RIPA)(PMSF∶RIPA=1∶100)提取蛋白质,并用BCA 法进行定量。采用10%的SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),然后200 mA 电转1.5 h 转至PVDF 膜,使用5%脱脂奶粉在室温下进行摇床封闭,时长1 h,随后分别加入兔抗人LC3B IgG(1∶1 000)、兔抗人GADPH IgG(1∶1 000),在4 ℃冰箱中过夜;用TBS-T 溶液清洗PVDF 膜3 次,每次10 min,洗涤后加HRP 标记山羊抗兔IgG(1∶1 000),并在室温下孵育1 h,用TBS-T 清洗PVDF 膜3 次,每次10 min;用化学发光试剂盒进行条带显影,在BIO-RAD 专用化学曝光仪内进行曝光,并使用Image Lab5.2.1 软件进行对蛋白质的灰度值的半定量检测,比较各组间LC3-Ⅱ与LC3-Ⅰ灰度值之比。
1.4 免疫荧光染色
通过免疫荧光染色法检测不同Hpa 表达状态下HREC 的自噬水平。消化HREC 后在无菌玻璃进行细胞爬片的接种,待载玻片上的细胞长到70%后,将其在上述分组中分别处理24 h,在无菌环境中去除盖玻片,并使用40 g/L 多聚甲醛在室温下固定20 min,用5%BSA 封闭1 h,用1% TritonX-100 渗透5 min,放于湿盒中并添加5%BSA 稀释的兔抗人LC3 IgG(1∶1 000),置于4 ℃冰箱中过夜;次日置于水平摇床上以PBS-T 溶液清洗上述的细胞爬片,每次10 min,共清洗3 次,然后使用Alexa-Fluor 488 羊抗兔二抗孵育,时长1 h,随后洗涤3 次,每次10 min;使用DAPI 对细胞核进行染色10 min,再洗涤2 次,每次10 min,使用封片剂进行封片后,在激光共聚焦显微镜下观察LC3 蛋白的分布和表达水平。
1.5 LC3-GFP 偶联腺病毒检测活细胞HREC 内的自噬体形成
外源性导入GFP-LC3 腺病毒转染细胞,将模型建立24 h 后的各组细胞直接置于活细胞荧光显微镜下,观察活细胞荧光强度。对随机视野进行拍摄照片并对照片上荧光亮点数目进行计数。
1.6 统计学分析
使用SPSS 25.0 对所有统计数据进行统计学分析,实验重复3 次,呈正态分布的定量资料采用平均值±标准差的形式表示,多组均数比较,各组定量资料都呈正态分布并且方差齐性采用单因素方差分析进行,有统计学差异时进一步采用Bonferroni 法进行多重比较;反之,用Kruskal WallisH检验进行统计分析。P<0.05 被认为具有统计学意义。
2 结果
2.1 缺氧状态下HREC 内自噬标记蛋白表达水平上调
自噬相关蛋白LC3 的含量能间接反映细胞自噬水平的高低,通常情况下LC3 含量越高,反映细胞的自噬水平越高。免疫荧光结果显示,缺氧条件下,HREC 内的LC3 蛋白含量比正常组的明显增多(图1)。图1A 示正常组,图1B 示缺氧组(100 μmol/L CoCl2),蓝色为DAPI 标记的细胞核(图1A,箭头所指示),绿色为自噬相关蛋白LC3(图1B,箭头所示)。缺氧组HREC 内绿色荧光较正常组明显增强。
细胞内自噬发生的情况下,LC3-Ⅰ蛋白会向LC3-Ⅱ蛋白转化,因此LC3-Ⅱ与LC3-Ⅰ的比例越高,细胞的自噬水平就越高,LC3B 蛋白抗体可以同时标记LC3-Ⅱ与LC3-Ⅰ蛋白,故我们进行了Western Blot 实验,可以同时显示LC3-Ⅱ与LC3-Ⅰ条带,进行二者量的对比,结果显示:3 组间存在统计学差异(F=33.04,P=0.000 6 <0.05),采用Bonferroni 法进一步作两两比较,发现与正常组相比,缺氧组HREC 内LC3-Ⅱ/LC3-Ⅰ比例增高(灰度值,2.14 ± 0.33 比4.69 ± 0.54,P=0.001 <0.05),说明缺氧条件下,LC3-Ⅰ向LC3-Ⅱ蛋白增加,HREC 自噬水平升高(图2)。
2.2 Hpa 抑制剂PI-88 可以降低缺氧状态下HREC 的自噬标记蛋白的表达量
免疫荧光结果显示,缺氧条件下,HREC 内的LC3 蛋白含量较正常组的明显增加,而加入了Hpa抑制剂PI-88 的缺氧组细胞内LC3 含量明显下降(图1B、C)。图1B示缺氧组(100 μmol/L CoCl2),图1C 示实验组(100 μmol/L CoCl2+5 μg/mL PI-88)。绿色为自噬相关蛋白LC3(图1B-C,箭头所指)。Hpa 抑制剂PI-88 可以抑制缺氧条件下HREC 中自噬相关蛋白LC3 的表达。

图1 HREC 内LC3 免疫荧光结果Fig.1 Immunofluorescent detection of cellular distribution of LC3 in HREC
Western Blot结果显示:缺氧+PI-88组LC3-Ⅱ/LC3-Ⅰ(灰度值)比值下降(与缺氧组比较,3.51±0.20比4.69±0.54,P=0.027 <0.05),表明在缺氧条件下,Hpa 被抑制后,LC3-Ⅰ向LC3-Ⅱ的转化水平下降,HREC的自噬水平降低。证明Hpa可以正向调节HREC 的自噬水平(图2)。
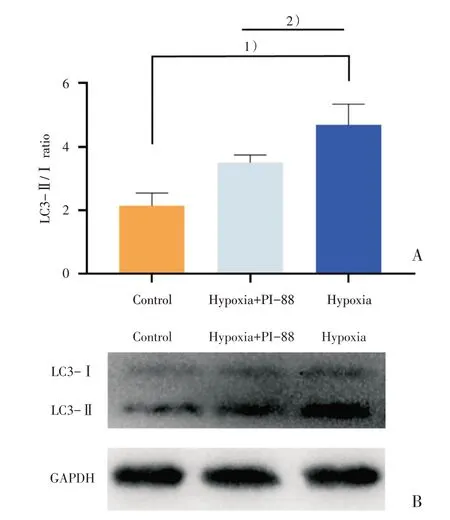
图2 HREC 中LC3-Ⅱ/Ⅰ的比值Fig.2 The ratio of LC3-Ⅱ/Ⅰin HREC
2.3 Hpa 抑制剂PI-88 可减少缺氧状态下活细胞中自噬体的数量
LC3 作为研究细胞自噬常用的标记蛋白,在正常细胞内绝对含量并不高,因此,行荧光染色的最佳实验方案为外源性导入GFP-LC3 腺病毒转染细胞,提高LC3 含量并使其与绿色荧光蛋白GFP 偶联,可直接在活细胞下观察细胞的自噬水平。细胞自噬水平低时,GFP 呈散在的绿色荧光;细胞自噬水平高时,由于LC3蛋白聚集于自噬体周围,故自噬体呈现点状绿色强荧光,故此方法能更加直接地反映细胞的自噬水平(图3)。结果显示:与缺氧组相比,实验组HREC 的细胞内荧光亮点数目明显减少(图3)。图3A为缺氧组(100 μmol/L CoCl2),图3B为实验组(100 μmol/L CoCl2+5 μg/mL PI-88),图中每个亮点代表一个自噬泡,亮点数量越多,自噬水平越强,荧光弥散则代表自噬水平低。表明Hpa 抑制剂PI-88 可以抑制缺氧条件下的HREC 自噬水平。

图3 LC3-GFP 免疫荧光结果Fig.3 LC3-GFP immunofluorescent detection in HREC
3 讨论
自噬是细胞中一种进化比较保守的分解代谢途径。细胞质成分,包括异常积累的蛋白质、脂类等生物大分子以及受损的细胞器,都是通过自噬作用被包裹在自噬体的囊泡中,随后自噬体可以与溶酶体进行融合,实现细胞内物质的降解及回收。这个过程正常发生在每个细胞水平,以代谢和去除异常折叠的蛋白质和受损的细胞器,为细胞的重建、修复和再生提供原材料,从而维持细胞内环境的稳定[12-14]。
研究表明在慢性缺氧和缺血疾病中,自噬现象会增加,并且自噬能促进心脑血管系统中的新生血管形成[7]。Du 等[7]在体外培养的牛主动脉血管内皮细胞中加入自噬抑制剂3-MA 和沉默ATG-5 后,细胞的成管和迁移降低,而过表达ATG-5 以促进细胞自噬时,细胞的增殖和迁移也显著增强,而诱导新生血管形成的重要上游因子,例如VEGF、血小板源生长因子和整合素α-V 的水平是保持不变的,提示自噬在新生血管的形成中不依赖VEGF 的经典通路而发挥重要的作用。
Hpa 可以正向调控肿瘤细胞中的自噬水平。Hpa 是哺乳动物中唯一能够裂解硫酸乙酰肝素的酶,参与许多重要的病理生理过程,例如胚胎发育、组织修复、炎症等。其作为一种潜在酶被细胞分泌,可被内化在自噬-溶酶体系统中进行蛋白水解和激活的过程。研究显示在肿瘤细胞中,过表达Hpa 可使胶质瘤细胞的自噬水平升高;而沉默小鼠胚胎纤维母细胞的Hpa,细胞自噬水平会降低[10]。
Hpa 实际上是一种葡糖苷酸内切酶,其作用是水解硫酸乙酰肝素蛋白多糖HS 侧链与其应的核心蛋白之间的糖苷键[15-17]。PI-88 与硫酸乙酰肝素蛋白多糖的HS 侧链结构相似,即与Hpa 作用的底物结构高度类似,故可以竞争性结合Hpa,抑制Hpa 对HS 的降解活性,从而抑制Hpa 发挥作用[11]。我们前期的研究工作也证明,对低氧诱导小鼠腹腔注射PI-88 可以明显减少视网膜组织的Hpa 含量,在体外培养的HREC 中加入PI-88 也可以显著降低细胞内的Hpa 水平[18-19]。
我们的研究通过对HREC 进行缺氧诱导,并在此基础上利用Hpa 抑制剂PI-88 作用于上述细胞,形成组间Hpa 差异。采用免疫荧光和蛋白质印迹对HREC 的表达的LC3 水平进行检测。LC3是细胞自噬的特定标记物,其含量可反映自噬水平。其可分为两个亚型,包括LC3-Ⅰ和LC3-Ⅱ。当细胞发生自噬,LC3-Ⅰ可转为LC3-Ⅱ转化,因此LC3-Ⅱ与LC3-Ⅰ的比率可以反映细胞自噬初始阶段的水平[20]。研究结果显示,在PI-88 抑制HREC 的Hpa 表达后,除了LC3-Ⅰ和LC3-Ⅱ的表达量降低外,LC3-Ⅱ/LC3-Ⅰ的比值也明显降低,提示自噬水平降低。为了进一步证明研究结果,我们使用GFP-LC3 偶连腺病毒转染HREC,使细胞的自噬泡被带有荧光素GFP-LC3 标记,在活细胞状态下观察Hpa 被抑制后,细胞内自噬泡数量明显减少,进一步直接证明抑制Hpa 可以降低HREC 的自噬水平。
Hpa 可能通过哺乳动物雷帕霉素靶蛋白复合体1(mammalian target of rapamycinm complex1,mTOR1)的通路来调节细胞自噬。mTOR1 是一种对营养敏感的激酶,研究显示,在饥饿时,其可负向调控自噬[21]。Shteingauz 等[10]报道,在过表达Hpa的肿瘤细胞中,mTOR1 下游特异的磷酸-RPS6KB/p70 S6 激酶水平降低,同时,细胞的自噬水平显著提高;而抑制这些细胞的Hpa 表达,则可以增加磷酸-RPS6KB/p70 S6 激酶表达,而细胞的自噬水平降低。因此,本研究推断Hpa 在HREC 中可能通过激活mTOR1 途径而实现对细胞自噬水平的调节,这需要我们在未来的研究中进一步证实。
长久以来,VEGF 被认为是导致视网膜新生血管性眼病的重要因素,目前其治疗也主要基于抗VEGF 药物。本研究通过免疫荧光染色,蛋白免疫印迹法和GFP-LC3 腺病毒转染实验,发现在HREC 中,使用Hpa 的抑制剂PI-88 可以降低细胞的自噬水平,从而提示Hpa-自噬通路可能为新生血管性疾病的治疗提供新思路。
