芽孢杆菌 NH-8对番茄根结线虫病的生防效果
2020-06-01李德全邓自发曹云英孙利军
李德全 邓自发 曹云英 孙利军

摘要:芽孢杆菌NH-8对多种植物病害均有较好的防治效果。为进一步验证其田间防治效果,进行生防菌剂防治番茄根结线虫病的田间试验。结果表明,设施大棚中使用生防菌剂NH-8能有效防治番茄根结线虫病,校正防效达到81.18%,同时对番茄还有一定的促生作用。菌剂处理20 d后,番茄苗株高、鲜质量和干质量分别比清水对照增加29.51%、49.94%、55.14%。
关键词:芽孢杆菌;番茄;根结线虫;防治效果;生防菌剂
中图分类号:S436.412.1 文献标志码: A
文章编号:1002-1302(2020)08-0108-03
收稿日期:2019-07-20
基金项目:国家自然科学基金(编号:81272378);南通市应用基础研究(编号:MS12015089);南通大学重点项目(编号:03080227)。
作者简介:李德全(1975—),男,江苏徐州人,博士,副教授,主要从事生物防治和抗性生理研究。E-mail:lidequan@ntu.edu.cn。
根结线虫作为一类重要的植物病原物,分布范围十分广泛,包括热带和亚热带地区。危害比较严重的南方根结线虫,目前报道的接近80种[1]。根结线虫在我国大多数省份均有发现,可侵染多种农作物,致使寄主常年减产15%~25%,有时高达75%以上,严重影响了粮食、蔬菜、果树、花卉等作物的生产和出口创汇。蔬菜中尤以种植面积较大的番茄、黄瓜等受害最重[2]。对于根结线虫病的防治,传统以化学药剂为主。但化学杀线虫剂对环境污染严重,使用过程中对人、畜也不安全,因此,生物防治方法日益受到重视。其中应用微生物农药进行根结线虫防治的研究较多。微生物农药是指由微生物及其代谢产物加工而成的具有杀虫、杀菌、除草或调节植物生长的具有农药活性的物质,包括农用抗生素和活体微生物农药,是生物防治的物质基础和重要手段[3-7]。目前,生產中已有一些芽孢杆菌用于根结线虫防治,效果良好。阿维菌素是由灰色链霉菌发酵产生的一种新型抗生素,对根结线虫病具有良好的防效。目前,防治线虫的生防资源主要有真菌、细菌等,防治线虫的细菌主要有芽孢杆菌和假单胞菌[8-10]。
江苏省南通市是保护地蔬菜种植的重要基地。但近年来,根结线虫危害日益严重,给设施蔬菜生产造成很大损失,严重影响本地农业的可持续发展。为解决生产中根结线虫病的防治问题,近年来有一些关于中低毒药剂和生防菌防治根结线虫病方面的试验报道[11]。为保护本地蔬菜免受根结线虫的危害,减轻根结线虫对蔬菜产量的损失,南通大学生命科学学院细菌实验室开展了根结线虫生防菌株的筛选应用。筛选到的芽孢杆菌NH-8对多种植物病害有较好的防治效果。为进一步验证其田间防治效果,进行生防菌剂防治番茄根结线虫病田间效果试验。
1 材料与方法
1.1 供试材料
1.1.1 供试菌株
NH-8菌株由笔者所在实验室从南通市近海海藻中分离获得。将NH-8菌株在28 ℃、130 r/min条件下振荡培养48 h的菌液,用无菌水配成 1.0×1010 CFU/mL 的菌悬液,以备灌根使用。
1.1.2 供试作物
供试番茄品种为苏粉8号。
1.2 试验地点
田间试验选取在江苏省海门市正余镇昌盛村以及如皋市石庄镇杨庄村设施番茄田块进行,室内试验在南通大学生物技术重点实验室进行。试验土壤类型为沙土两合土,肥力中等偏上,有机质含量为 14 g/kg。在定植时采用处理药剂进行灌根。
1.3 试验方法
1.3.1 生防菌剂处理番茄
棚内面积为400 m2(50 m×8 m),设3个处理,每个处理3次重复,共设置9个小区,采用随机区组排列。每个小区 48 m2 左右,各小区间设置2行隔离区,以防止药液互相干扰。于移栽前整地时施用充分腐熟的有机肥。番茄移栽时采用NH-8发酵液灌根处理,每株灌根250 mL。并在移栽10、20 d后分别用药剂处理1次。以清水处理为对照。
1.3.2 生防菌对番茄生长作用的影响
番茄移栽后20 d,随机抽取移栽好的番茄苗,采用5点取样法,每点取番茄苗3株,调查地上部分植株的鲜质量和地下部根质量。将番茄植株用自来水洗净晾干,用直尺测量株高,游标卡尺测量主茎粗度,电子秤称量植株鲜质量和干质量。称量干质量时,先将番茄植株在烘箱中45 ℃烘干,每个处理重复3次。
1.4 病害调查与统计分析
1.4.1 病害调查
于移栽后60 d调查根结线虫的危害程度,以及各处理的病情指数和病株防效。按照Luc等提出的病级标准记录病级数[12],计算病害严重度和防效。病害严重度和防效的计算公式为
病害严重度=∑(病植株数×病级数)/(总植株数×最高病级数)×100%;
防效=(对照病害严重度-处理病害严重度)/对照病害严重度×100%。
校正防效用Henderson-Tdlton公式计算。校正防治效果=(1-处理区药后病情指数×对照区药前病情指数)/(处理区药前病情指数×对照区药后病情指数)×100%。
1.4.2 数据分析
利用DPS软件对数据进行统计分析,采用Duncans新复极差法对各个处理进行显著性验证。
2 结果与分析
2.1 生防菌剂NH-8对番茄的促生作用效果
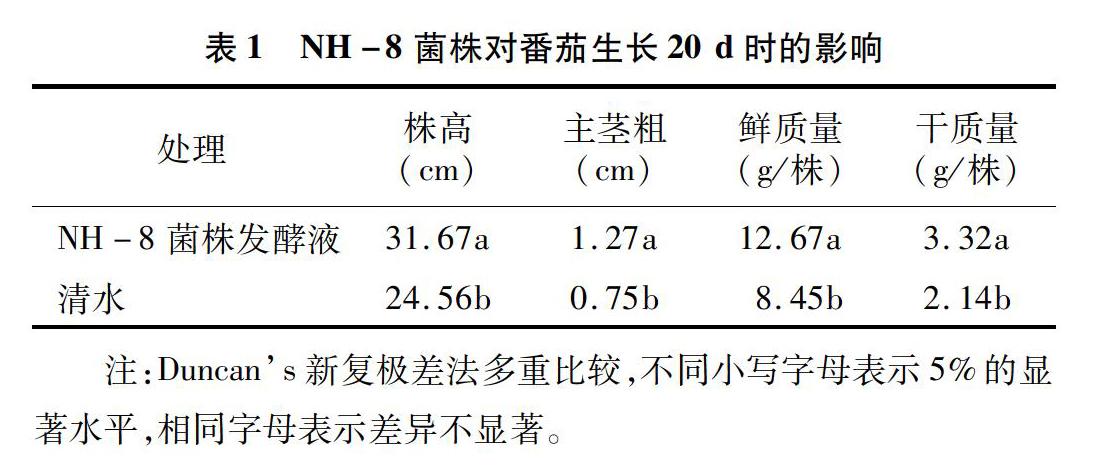
NH-8菌株对番茄生长影响的测定结果(表1)显示,菌株发酵液处理对番茄生长具有显著的促进作用。其中,菌株发酵液处理20 d后,苗株高、鲜质量和干质量分别比清水对照增加 28.95%、4994%、55.14%。
2.2 生防菌剂NH-8对番茄根结线虫病的防治效果
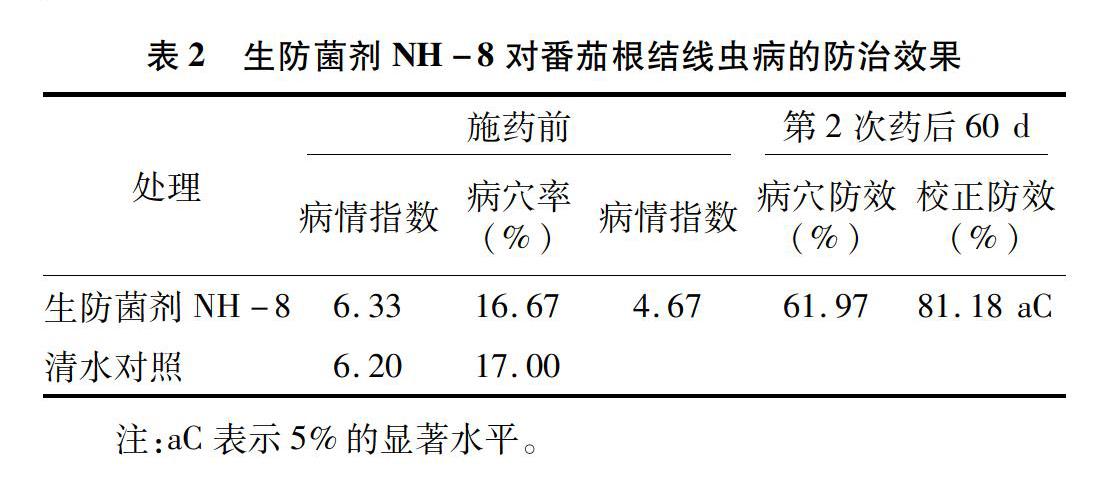
试验地区连续6年种植番茄的大棚里,根结线虫及腐霉、疫霉等多种病原物引起的根部病害非常严重。在此进行的田间生物防治,试验结果表明,生防菌剂NH-8对番茄根结线虫病有着良好的防治效果,根系增多壮实且相对光滑,根结明显减少(图1)。方差分析结果表明,生防菌剂NH-8的校正防效达到81.18%,有显著提高(表2)。
3 讨论
根结线虫病是影响番茄生产的重要病害之一,目前防治主要利用杀线虫剂,但应用化学杀线虫剂会严重影响人畜健康,对环境不友好。近年来,随着人们对健康的重视和环保意识的增强,根结线虫病的生物防治也越发受到重视。开发利用生防因子来防治根结线虫病害,一直是人们关注的热点问题[13-14]。Sharond等研究发现,哈茨木霉对爪哇根结线虫病具有很好的防治效果,并对植株的生长有显著促进作用[15]。Roberts等研究發现,绿木霉菌株GL3对南方根结线虫卵的孵化产生很好的抑制作用,同时对立枯丝核菌和疫霉均有较好的防治效果[16]。Becker等研究发现,假单胞菌和芽孢杆菌的一些菌株能杀灭根结线虫的活性,具有较好的防治效果[17]。
枯草芽孢杆菌(Bacillus subtilis)在自然界中广泛存在,同时还是植物体内常见的内生细菌,对人畜无毒害,对环境无污染,具有显著的抗菌活性和极强的抗逆能力。同时,枯草芽孢杆菌生长快、容易培养。本试验利用的枯草芽孢杆菌NH-8菌株对多种植物病原生物具有具有较强的拮抗性能,在温室试验中,对南方根结线虫的二龄幼虫也有很好的防治效果,表现出较强的生防性能[18]。本试验结果进一步表明,生防菌剂NH-8对番茄根结线虫有着良好的防治效果,使番茄根系粗壮且相对光滑,根结明显减少,校正防效达到81.18%。同时试验结果还表明,该生防菌剂对供试植株具有很好的促生作用。由于试验所选用田块长期连作发病较重,在移栽初期用药进行灌根处理,可有效抑制土壤中根结线虫低龄幼虫进入番茄根内,防效较高。但随着生长期的延长,药剂药效逐渐降低,土壤中根结线虫密度增大,番茄根结线虫病病情加重。如果在番茄不同生长期进行施药处理,防治效果或许更好,其结果有待进一步试验验证。同时试验没有在不同番茄品种间进行防病促生作用的对比,有待进一步研究。
参考文献:
[1]丁国春,付 鹏,李红梅,等. 枯草芽孢杆菌AR11菌株对南方根结线虫的生物[J]. 南京农业大学学报,2005,28(2):46-49.
[2]魏利辉,周冬梅,王云鹏,等. 枯草芽孢杆菌168的遗传修饰菌株对番茄根结线虫病的生防作用[J]. 农业生物技术学报,2011,19(4):740-745.
[3]赵鸿孙,彭德良,朱建兰. 根结线虫的研究现状[J]. 植物保护,2003,29(6):5-9.
[4]李红梅,沈培垠,徐建华. 江苏省进出口园林植物寄生线虫的调查研究[J]. 南京农业大学学报,2000,23(1):34-38.
[5]Kiewnick S,Sikora R A.Biological control of the root-knot nematode Meloidogyne incognita by Paecilomyces lilacinus strain 251[J]. Biological Control,2005,38(2):179-187.
[6]Oka Y,Koltai H,Bar E M,et al. New strategies for the control of plant-parasitic nematodes[J]. Pest Management Science,2000,56(11):983-988.
[7]朱玉坤,尹衍才. 微生物农药研究进展[J]. 生物灾害科学,2012,35(4):431-434.
[8]Mohammed S H,Saedy M A,Enan M R,et al.Biocontrol efficiency of Bacillus thuringiensis toxins against root -knot nematode,Meloidogyne incognita[J]. Journal of Cell and Molecular Biology,2008,7(1):57-66.
[9]Xiao T J,Tan S Y,Shen Q R,et al. Bacillus cereus X5 suppresses root -knot nematode of tomato by colonizing in roots and soil[J]. African Journal of Microbiology Research,2012,6(10):2321-2327.
[10]Reddy P P.Recent advances in crop protection,in avermectins[M]. London:Springer,2013.
[11]丁晓帆,梁 蓉,王新军. 甲氨基阿维菌素苯甲酸盐对南方根结线虫的毒力、防效[J]. 南京农业大学学报,2009,32(4):85-88.
[12]Luc M,Sikora R A,Bridge J. Plant parasitic nematodes in subtropical and teopical agriculture[M]. CAB Internation,1990.
[13]彭 震,蒋春号,魏利辉,等. 生物农药“使命”对黄瓜防病促生的试验分析[J]. 上海农业学报,2014,30(4):60-74.
[14]万景旺,邵 颖,朱 华,等. 生防菌Jdm2与生物源农药混用防治黄瓜根结线虫病的效果[J]. 江苏农业科学,2014,42(4):108-110.
[15]Sharond E,Bar E M,Chet I,et al. Biological control of the root-knot nematode Meloidogyne javanic by Trichoderma harzianum[J]. The American Phytopathological Society,2001,91(7):687-693.
[16]Roberts D P,Lohrke S M,Meyer S L F,et al. Biocontrol agents applied individually and in combination for suppression of soilborne diseases of cucumber[J]. Crop Protection,2005,24(2):141-155.
[17]Becker J O,Zavaetam E. Effects of rhizobacteria on root nem a- todes and form ation[J]. Phytopathology,1988,78(11):1466-1469.
[18]李德全,周鸣鸣,谈 蓉,等. 筛选和利用海洋细菌防治玉米纹枯病试验[J]. 江苏农业科学,2014,42(8):118-121.
