罗汉果分子生物学研究进展
2020-06-01唐美琼李刚胡营覃芳闫志刚韦荣昌
唐美琼 李刚 胡营 覃芳 闫志刚 韦荣昌
摘要:罗汉果是广西著名的道地药材,也是我国特有的药食两用植物,具有重要的药用价值和开发前景。近年来,罗汉果分子生物学的研究涉及罗汉果种质资源鉴定、功能基因克隆、抗病性育种等方面,这些技术研究内容主要包括罗汉果性别鉴定、遗传多样性、转录组特征及功能基因克隆等。应用现代分子生物学技术已实现了罗汉果幼苗性别鉴定,全面揭示了其遗传多样性及品种间的亲缘关系;通过构建罗汉果转录组数据库,促进了对该植物的果实生长发育和代谢调控相关功能基因的研究;利用RNAi技术有望获得抗病毒病的罗汉果转基因植株。今后可利用罗汉果基因组数据,深入挖掘基因资源,研究候选基因的功能,明确罗汉果果实生长发育过程中的基因调控网络,利用基因工程手段促进罗汉果种质资源开发及分子遗传育种发展。
关键词:罗汉果;分子标记;遗传差异;基因克隆;转基因
中图分类号:S567.901文献标志码: A
文章编号:1002-1302(2020)08-0013-05
收稿日期:2019-03-07
基金项目:国家自然科学基金(编号:81860678);广西自然科学基金(编号:2017GXNSFAA198232、2015GXNSFBA139149、2017GXNSFAA198280、2016GXNSFAA380174、2015GXNSFBA139134)。
作者简介:唐美琼(1984—),女,广西全州人,硕士,助理研究员,主要从事药用植物遗传育种研究。E-mail:tangmeiqiong2006@163.com。
通信作者:韦荣昌,博士,高级工程师,主要从事生药学研究。E-mail:wrc830612@163.com。
罗汉果(Siraitia grosvenorii)为葫芦科罗汉果属多年生藤本植物,是我国特有的药食两用植物,主要产于广西桂北地区[1]。罗汉果以果实入药,味甘,性凉,具有清热润肺、利咽开音、滑肠通便[2]和抗癌[3]等功效。罗汉果应用广泛,除用作饮片外,仅以罗汉果冠名的中成药就有几十种。近年来,随着罗汉果提取物市场需求的急剧增加,罗汉果成为产量增长最快的中药品种之一。
长期以来,人们对罗汉果的研究主要集中在地理分布[4]、主栽品种[5]、繁殖技术[6]、化学成分[7]、药理作用[8]和开发利用[9]等方面。近年来,国内外学者将分子生物学技术应用到罗汉果性别鉴定、遗传差异分析、功能基因克隆及抗病毒等研究中,取得了一些重要进展。本文就罗汉果分子生物学方面的最新研究进展进行综述,为开展罗汉果的分子育种提供参考。
1 罗汉果性别性状的遗传标记
罗汉果雌雄异株,须进行人工授粉才能结实,生产中需要大量的雌株,在未开花之前难以通过形态特征进行鉴别。DNA分子标记技术以其快速、准确和可信度高等优点,广泛应用于雌雄异株植物早期性别分子鉴定研究。目前,用于罗汉果幼苗雌雄鉴别研究的DNA分子标记有AFLP和RAPD 2种。
陶莉等建立的AFLP 标记技术,结合数量性状分析,可以快速经济地鉴别罗汉果幼苗雌雄株[10]。对RAPD标记的研究方面,韦弟等发现S143是1条与雄性连锁的分子标记[11]。黄夕洋获得4条可用于罗汉果栽培品种性别鉴定的引物(S60、S90、S100、S343、S357)[12]。黄姿梅通过对栽培品种青皮果的雌雄株进行RAPD标记,发现引物S47和S103能在雄集群DNA池和单株中扩增出雄特异性条带,引物S43则在栽培品种青皮、长滩、冬瓜和红毛的雌集群DNA池扩增出雌性特异性条带[13]。这些研究结果表明,分子标记技术可以对罗汉果幼苗进行雌雄鉴别。
2 罗汉果种质资源的遗传差异分析
DNA分子标记技术不仅在罗汉果雌雄性别鉴定中发挥重要作用,而且在罗汉果种质资源遗传多样性、亲缘关系以及育种材料的遗传背景分析等研究方面也展示出广阔的应用前景。
2.1 遗传多样性分析
罗汉果在长期的人工栽培及自然选择过程中,形成了许多优良品种及丰富的野生类型。由于生产上长期采用无性繁殖方式,使栽培罗汉果的遗传结构变的脆弱,严重阻碍了罗汉果种质资源的合理利用。
已有大量的研究工作通过采用不同的分子标记研究罗汉果不同居群的遗传结构,并为种质资源保护策略的制定提供理论指导。彭云滔等利用ISSR标记法对来源地不同的罗汉果野生居群进行遗传多样性分析,发现不同居群间的遗传变异较大[14]。黄江等采用RAPD技术对罗汉果10个栽培品种和5份野生种质进行遗传分析和鉴定表明,圆果类栽培品种间亲缘关系较近,长果类栽培品种与野生种质的亲缘关系较近,长果类品种与圆果类品种间在亲缘关系上存在明显差异[15]。周俊亚等用ISSR和RAPD对罗汉果栽培品种进行分析发现,主要的栽培品种青皮果、红毛果和爆棚籽的遗传多样性很低,而茶山果和冬瓜汉具有较高的遗传多样性[16-17]。戴俊采用ISSR和RAPD 对野生和栽培罗汉果进行遗传差异分析,结果均显示野生种质的遗传多样性高于栽培种质[18]。此外,李媛采用15个RAPD引物對4个野生罗汉果种群共351个样品分布格局及克隆结构进行研究,结果显示,野生罗汉果种群具有相对较高的克隆多样性[19]。这些研究结果表明,营养繁殖方法是造成栽培罗汉果遗传多样性低的主要原因,有必要扩大栽培罗汉果的遗传基础。
2.2 育种材料遗传背景分析
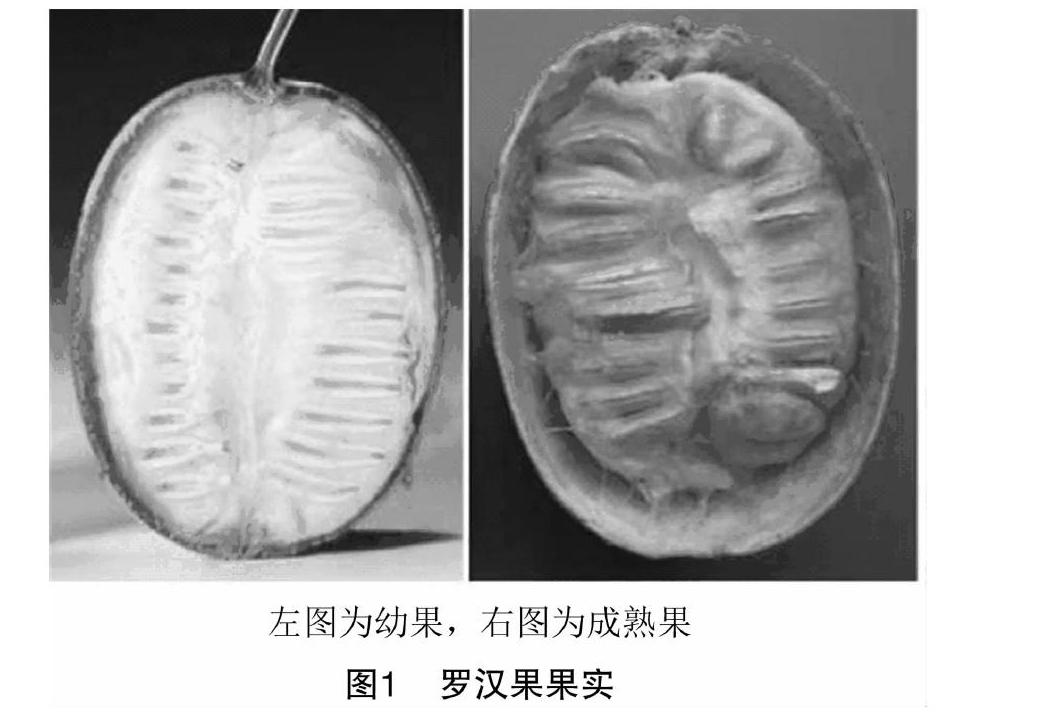
甜苷Ⅴ是罗汉果主要活性成分和甜味成分,由于甜度高(为蔗糖甜度的425倍),热量低,口感好,从而成为理想的天然甜味剂[20-21],是糖尿病人、肥胖病人理想的食糖代用品,具有极高的经济价值。研究显示,甜苷Ⅴ仅仅存在于果肉和果皮中,罗汉果种子数量多,且不含甜苷Ⅴ[22],使得罗汉果果实的利用率非常低,大大增加了提取难度和生产成本(图1)。从分子水平上研究多倍体无籽罗汉果育种材料的遗传背景,可以克服无籽罗汉果新品系选育中杂交亲本选配和组配时的盲目性,提高育种效率。
付伟采用SRAP技术对罗汉果二倍体和四倍体的基因组水平进行遗传变异分析,结果表明羅汉果二倍体及四倍体株系之间基因组DNA的SRAP多态性较低,遗传差异较小[23]。韦荣昌等应用ISSR技术对多倍体无籽罗汉果及其亲本材料的遗传背景进行分析,结果表明,F1代从四倍体母本上继承的遗传物质更多,遗传上倾向母本,且F1代与亲本之间的平均遗传相似性系数大于或小于亲本之间,随亲本的组合和相应的F1代而定,聚类图和双变量主坐标表明罗汉果三倍体雌株和二倍体雄株遗传背景的复杂性较低,存在一定的丰富性,体现了“子似亲”的遗传现象[24-25]。该课题组采用RAPD技术得到同样的结果,建议尽快采取相应措施,进行罗汉果种质创新,以丰富无籽罗汉果亲本的遗传背景[26]。
此外,向巧彦等运用ISSR分子标记技术对空间诱导罗汉果DNA突变进行全基因组检测和聚类分析发现,太空环境可对罗汉果造成诱变效应,部分航天种质可能获得了有益突变,可为罗汉果新品种培育和杂交亲本选配提供科学依据[27]。
2.3 遗传图谱构建及农艺性状QTL定位
遗传图谱即遗传连锁图谱,指基因组中基因及专一的多态性标记之间相对位置的图谱。覃嘉明利用1个有167个株系的F1代群体,根据63对引物组合扩增出的131个SRAP多态性数据,构建了首张罗汉果遗传框架图谱,其中112个SRAP标记分属于23个连锁群,覆盖罗汉果基因组总长度725.6 cM,标记间平均图距6.48 cM[28]。刘丽华利用ISSR和SRAP对以罗汉果野生红毛一号为母本、长滩果为父本杂交获得的150株F1子代单株作图群体进行遗传学分析,得到1张包含203个标记的罗汉果遗传图谱,其中有29个ISSR标记、173个SRAP标记和1个性别标记,包含27个连锁群,图谱总长度1 474.1 cM,图谱覆盖率为65.2%,连锁群长度在19.5~152.6 cM之间,平均长度54.6 cM[29]。运用软件Windows QTL Cartographer V2.5的复合区间作图法获得与农艺性状相关的QTLs位点33个。这些研究结果为罗汉果改良应用提供了有价值的科学依据。
3 罗汉果的功能基因研究
罗汉果分子生物学研究主要集中在分子标记应用、组织培养等方面。2011年,Tang等应用Solexa高通量测序技术对授粉后3、50、70 d的罗汉果果实进行转录组测序和表达谱分析,开启了关于罗汉果功能基因的研究[30]。
3.1 cDNA文库构建和转录组分析
唐其等以罗汉果授粉后50、70 d果实为材料,利用抑制消减杂交技术构建了罗汉果果实在不同生育时期皂苷生物合成相关基因的差减cDNA文库,对随机挑选的641个cDNA阳性克隆测序,最终获得622条有效序列,发现其中421个ESTs序列和能量代谢、次生代谢、转录因子、衰老及抗病性等蛋白有高度相似性[31]。通过对不同生长时期的罗汉果果实进行转录组测序,罗汉果甜苷Ⅴ生物合成途径中的基因、萜类和甾体2条代谢途径所有已知关键酶基因基本可以确定[30,32]。甜苷Ⅴ合成有关的候选基因分属于角鲨烯环氧酶、三萜类物质合成酶、环氧化物水解酶、细胞色素P450单加氧酶、UDP-糖基转移酶五大基因家族[33]。转录组测序也鉴定到了可能参与罗汉果甜苷合成调控和黄酮类化合物合成调控相关的转录因子[34]。赵欢采用转录组测序和表达谱分析对三倍体无籽罗汉果和二倍体罗汉果果实进行分析,发现329个基因是二倍体果实所特有,303个基因是三倍体果实所特有,并找出1个编码T-细胞质雄性不育恢复因子的基因、2个注释为STP合酶的基因以及2个参与雄性减数分裂的基因都显著下调,推测这几个基因都可能与雄性不育有关,该研究结果从分子水平上加深了对三倍体果实和种子形成的理解,为无籽罗汉果育种研究提供了重要的基因资源[35]。
3.2 功能基因克隆及鉴定
罗汉果的基因克隆主要涉及罗汉果甜苷Ⅴ生物合成途径及罗汉果生长发育相关的生物过程。
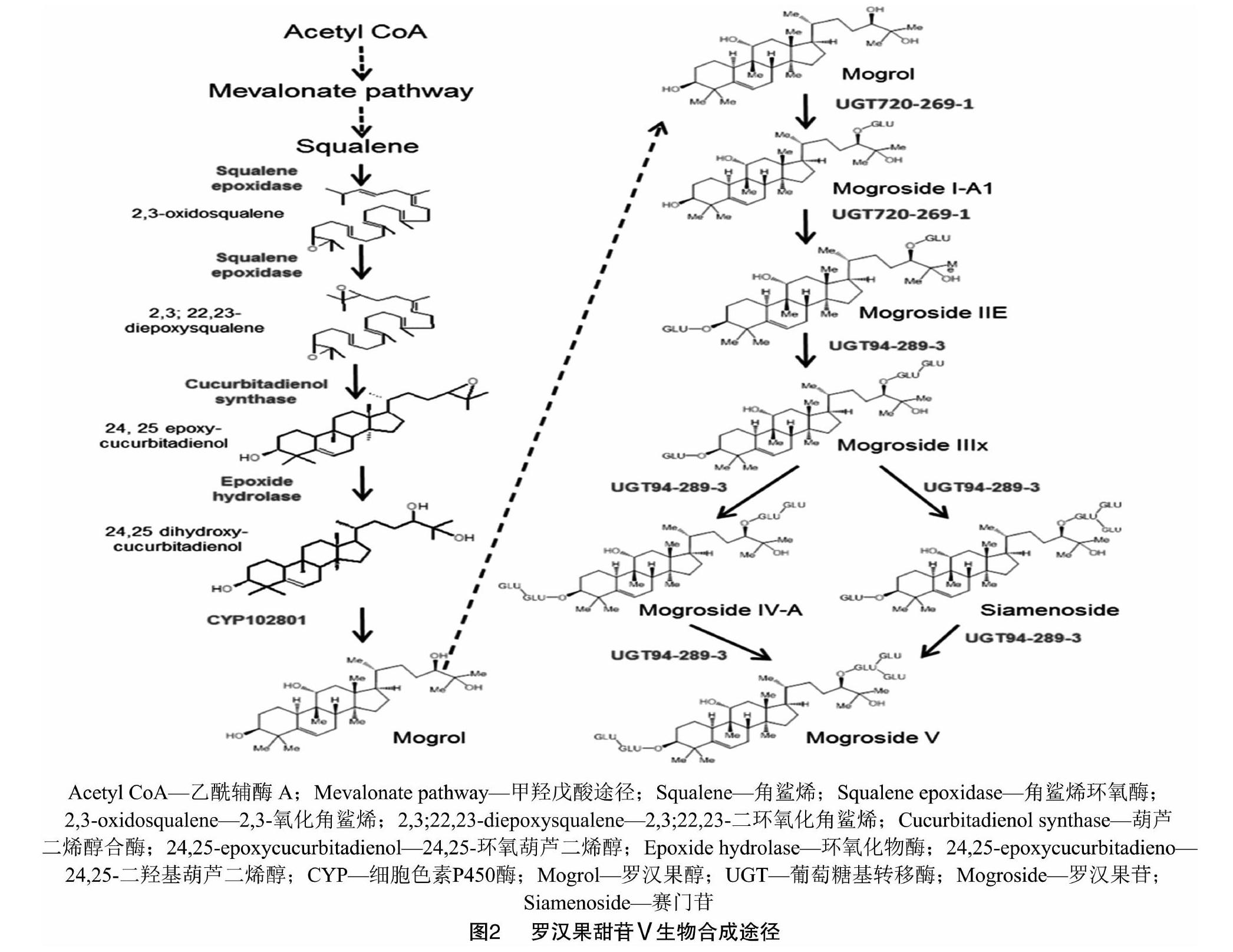
罗汉果甜苷Ⅴ属于葫芦烷型四环三萜类物质,而3-羟基-3-甲基戊二酸单酰辅酶A还原酶(HMGR)位于甲羟戊酸(MVA)途径中,是萜类化合物生物合成途径中的第1个限速酶,是罗汉果甜苷Ⅴ生物合成途径中的重要调控位点,sgHMGR在罗汉果中的叶片、茎和果实中的表达差异明显,在果实中与甜苷Ⅴ合成积累变化规律相似[36-37]。角鲨烯合成关键酶角鲨烯合酶(SQS)、葫芦二烯醇合酶(CS)、环阿乔醇合酶(CAS)基因均已被克隆,生物信息学信息、时空表达规律及亚细胞定位等已经开展研究[35]。以色列科学家研究发现,甜苷Ⅴ产生于细胞质中的MVA途径。来源于该途径的异戊二烯焦磷酸(IPP)与牻牛儿基焦磷酸(GPP)在法尼基焦磷酸合酶(FPS)的催化下形成法尼基焦磷酸(FPP),FPP在角鲨烯合酶(SQS)的作用下头尾结合成为角鲨烯,角鲨烯环氧化酶(SQE)2次作用将角鲨烯催化成2,3;22,23-二环氧化角鲨烯,经葫芦二烯醇合酶(CS)催化形成环氧葫芦二烯醇,经环氧化物酶催化形成二羟基葫芦二烯醇,接着在CYP102801的作用下形成罗汉果醇。罗汉果醇在UGT720-269-1的连续作用下逐步形成罗汉果苷Ⅰ-A1和罗汉果苷ⅡE,接着在UGT94-289-3的持续作用下又形成罗汉果苷Ⅲx、罗汉果苷Ⅳ-A和赛门苷,最终合成甜苷Ⅴ[33](图2)。
罗汉果雌雄异株,在栽培中需要进行人工授粉才能正常结实,严重制约了罗汉果种植业的发展,选育单性结实雌性系或者可自花授粉的两性花品种,是罗汉果生产中亟待解决的关键问题。生长素类物质调控植物生长发育和器官的形态发生,目前,已有关于罗汉果中与生长素合成与调控相关基因研究的报道。例如,罗汉果中可能与生长素极性运输及果实起始发育迅速发生密切相关的sgNPY2基因的克隆与表达研究[38];参与罗汉果生长发育调节过程,尤其与雌蕊和幼果的器官形态建成密切相关的生长素响应因子sgARF8的鉴定[39];直接参与植物生物素合成途径的关键基因sgTAR2的克隆与表达分析[40]。周琼等采用农杆菌介导法构建果实特异启动子2A11与生长素合成相关基因iaaM的嵌合基因(2A11-iaaM)过表达载体,转罗汉果后得到5株在田间正常开花的阳性植株,并表现单性结实[41]。乙烯合成酶sgACS1基因[42]和sgACS3基因[43]可能参与花芽的形成、雌蕊原基分化、蕾中雄蕊发育以及雌花形成。这些结果对研究生长素调控罗汉果发育和器官形态发生的分子机制具有重要意义。
[21]Zhang H Y,Yang H H,Zhang M,et al. Identification of flavonol and triterpene glycosides in Luo-Han-Guo extract using ultra-high performance liquid chromatography/quadrupole time-of-flight mass spectrometry[J]. Journal of Food Composition and Analysis,2012,25(2):142-148.
[22]苏小建,刘国雄,聂 晓,等. 罗汉果甜苷Ⅴ在各部位的含量分布[J]. 食品科技,2007,32(5):76-78.
[23]付 伟. 罗汉果二倍体及四倍体遗传变异研究[D]. 北京:北京协和医学院,2011.
[24]韦荣昌,李 虹,蒋建刚,等. 多倍体无籽罗汉果及其亲本遗传背景的ISSR分析[J]. 园艺学报,2012,39(2):387-394.
[25]韦荣昌,白隆华. 罗汉果三倍体雌株与二倍体雄株遗传背景的ISSR分析[J]. 中草药,2015,46(6):881-886.
[26]韦荣昌,马小军,闫志刚,等. 罗汉果三倍体雌株与二倍体雄株遗传背景的RAPD分析[J]. 江苏农业科学,2015,43(2):241-243,293.
[27]向巧彦,黄夕洋,李 虹,等. 利用ISSR分子标记检测空间诱导罗汉果DNA突变[J]. 广西植物,2017,37(5):581-586,598.
[28]覃嘉明. 罗汉果品种资源花粉质量研究及遗传框架图构建[D]. 南宁:广西大学,2009.
[29]刘丽华. 罗汉果遗传图谱构建及农艺性状QTL定位[D]. 北京:北京协和医学院,2010.
[30]Tang Q,Ma X J,Mo C M,et al. An efficient approach to finding Siraitia grosvenorii triterpene biosynthetic genes by RNA-seq and digital gene expression analysis[J]. BMC Genomics,2011,12(1):343.
[31]唐 其,邱德有,马小军,等. 罗汉果果实不同发育时期SSH文库的构建[J]. 广西植物,2011,31(3):388-392.
[32]莫长明. 罗汉果苷代谢酶基因转录组研究及葡萄糖基转移酶基因克隆与表达[D]. 南宁:广西大学,2015.
[33]Itkin M,Davidovich-Rikanati R,Cohen S,et al. The biosynthetic pathway of the nonsugar,high-intensity sweetener mogroside Ⅴ from Siraitia grosvenorii[J]. Proceedings of the National Academy of Sciences of the United States of America,2016,113(47):7619-7628.
[34]张凯伦,罗祖良,郭玉华,等. 不同生长时期罗汉果果实转录因子的转錄组分析及酵母单杂交文库的构建[J]. 中国现代中药,2016,18(3):945-950.
[35]赵 欢. 三倍体罗汉果转录组表达谱分析及甜苷Ⅴ生物合成中4个关键酶基因的功能研究[D]. 北京:北京协和医学院,2014.
[36]郭茜茜,马小军,白隆华,等. 罗汉果内参基因筛选和3-羟基-3-甲基戊二酰辅酶A还原酶时空表达分析[J]. 中草药,2014,45(15):2224-2229.
[37]赵 欢,莫长明,唐 其,等. 罗汉果SgHMGR基因的克隆、分析及原核表达[J]. 广西植物,2015,35(6):796-801.
[38]莫燕梅,闵丹丹,郑 珊,等. 罗汉果SgNPY2基因的克隆及在单性结实幼果中的表达[J]. 分子植物育种,2016,14(6):1403-1409.
[39]郝庆林,郑 珊,李 刚,等. 罗汉果生长素响应因子SgARF8基因的克隆及表达分析[J]. 分子植物育种,2018,16(6):1784-1791.
[40]郑 珊,闵丹丹,莫燕梅,等. 罗汉果色氨酸转氨酶基因SgTAR2的克隆及表达分析[J]. 广西植物,2017,37(3):365-372.
[41]周 琼,胡珊珊,郝庆林,等. 用单性结实基因2A11-iaaM转化罗汉果的研究[J]. 广西植物,2018,38(12) :1614-1625.
[42]曾娜霞,胡珊珊,周 琼,等. 罗汉果乙烯合成酶SgACS1基因的克隆与表达分析[J]. 分子植物育种,2017,15(3):821-832.
[43]曾娜霞,胡珊珊,郝庆林,等. 罗汉果乙烯合成关键酶基因SgACS3的克隆及表达分析[J]. 农业生物技术学报,2018,26(5):784-792.
[44]甘晓静. 侵染罗汉果的小西葫芦黄化花叶病毒基因组全长序列的测定及其结构分析[D]. 南宁:广西大学,2005.
[45]谭秀梅. 利用RNAi技术培育抗花叶病毒转基因罗汉果的研究[D]. 吉首:吉首大学,2015.
[46]李文兰,李景剑,李华英. 农杆菌介导系统获得性抗性调节基因(NPR1)转化罗汉果的研究[J]. 上海农业学报,2010,26(4):15-19.
[47]Xia M,Han X,He H,et al. Improved de novo genome assembly and analysis of the Chinese cucurbit Siraitia grosvenorii,also known as monk fruit or luo-han-guo[J]. Gigascience,2018,7(6):1-9.
