化学计量学方法在蜂蜜鉴伪中的应用研究进展
2020-06-01相倩倩张云权王小花张晓甜黄文耀
相倩倩 张云权 王小花 张晓甜 黄文耀


摘要:蜂蜜作为一种天然甜味剂,不仅具有较高的营养价值还具有一定的药理功能。然而,当前市售蜂蜜的真实性面临巨大挑战,尤其是外源糖浆掺假和低价杂花蜜的冒充。随着科技的发展,现代分析技术结合化学计量学手段已被广泛应用于蜂蜜的掺假及溯源等研究中。通过详细介绍红外、核磁共振等常见的分析技术、谱图数据的提取和预处理以及模式识别方法的使用,系统地疏理化学计量学方法在蜂蜜鉴伪中的应用。该研究可为食品领域从业人员进行蜂蜜品质鉴定,及监管部门制定蜂蜜检测新标准提供新思路。
关键词:蜂蜜;鉴伪;分析技术;模式识别;化学计量学;应用
中图分类号: TS207.3文献标志码: A
文章编号:1002-1302(2020)08-0032-09
收稿日期:2019-03-18
基金项目:湖北省卫生健康委面上项目(编号:S2017WJ10);湖北省食品质量安全监督检验研究院自主立项科研项目(编号:ZZLX2017001);湖北省自然科学基金(编号:2016CFB212)。
作者简介:相倩倩(1991—),女,江苏扬州人,硕士,助理工程师,主要从事食品检验及相关鉴伪研究。E-mail:617641206@qq.com。
通信作者:张云权,博士,主要从事数据挖掘方法及应用研究,E-mail:Yun-quanZhang@whu.edu.cn;黄文耀,主任技师,主要从事环境与健康关系研究,E-mail:313234967@qq.com。
蜂蜜是蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物混合后,经充分酿造而成的天然甜物质[1]。除了主要的糖类外,蜂蜜中还有很多有机酸、活性酶、与人体血液含量相当的矿物元素等[2-3]。许多研究表明[3-6],蜂蜜的摄入可刺激胰岛素的分泌,有提高血红蛋白浓度,降低血糖浓度,改善血脂等作用;还具有抗炎、抗动脉硬化和免疫调节等功能。
正是其较高的营养价值,天然蜂蜜深受广大消费者的青睐。目前市售蜂蜜普遍存在因过度使用抗生素导致的兽药残留问题以及因病虫防治引起的农药残留问题等[7-8]。除此之外,蜂蜜真实性问题已经成为食品生产、消费和研究领域面临的巨大挑战[9]。当前市场上,影响蜂蜜真实性的因素最主要的是掺假,通过掺入果葡糖浆、淀粉糖浆、大米糖浆等来冒充真實蜂蜜;其次是以低价蜂蜜掺入高价蜜或以杂花蜜冒充单花蜜来以次充好。
传统的蜂蜜品质鉴定方法有感官鉴别、花粉鉴别以及色泽、电导率、酸度、糖类等理化指标的鉴别[7]。这些传统方式具有主观经验性、不确定性、不可靠性,已不满足市场的需求。随着色谱技术的发展与成熟,更多的研究人员选择从蜂蜜的特殊成分以及掺假糖浆中引入的外源物质着手,以靶向物判定蜂蜜的真伪[8]。但这些技术普适性较低,一方面是因为此类技术多针对单花蜜,而蜂蜜类型受地域差异、加工过程等影响较大,通过靶向物的判定能否普适我国的蜂蜜花种仍有待研究;另一方面,引入的外源物质成分不定且只是针对单一类型掺假,若造假者针对性去除靶向物质,鉴定的技术又将面临挑战。现如今,基于指纹图谱的多元统计分析技术飞速发展,这种以化学计量学为理念建立数据库的方法已经成为当下食品品质鉴定的主流,已经在食品成分分析、真伪鉴定、品质评价、食品产地及年份等领域广泛应用[10-13]。
利用化学计量学方法鉴定蜂蜜品质在国外已经得到普遍运用,而我国对此项技术的应用尚未成熟。本文通过详细介绍红外、紫外、电子鼻(舌)及核磁共振等常见的分析技术、谱图数据的提取和预处理以及模式识别方法的使用,系统地疏理化学计量学方法在蜂蜜鉴伪中的应用。该研究可为食品领域从业人员进行蜂蜜品质鉴定,及监管部门制定蜂蜜检测新标准提供新思路。
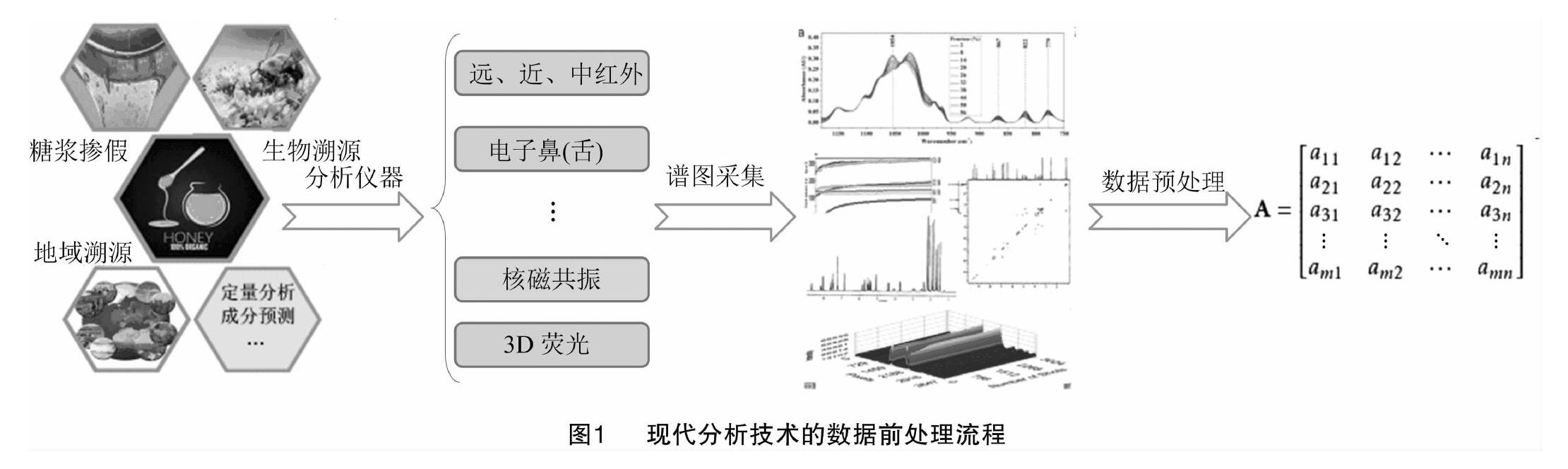
1 仪器分析技术及数据前处理
随着蜂蜜掺假技术的升级,分析手段也逐步更新,包括以液质联用为首的碳稳定同位素分析法[14-16]、以色谱为主的分离方法[17-19]、各种光谱及传感器的指纹图谱技术[20-22]等。此处以指纹图谱技术展开,如图1所示,基于红外、荧光、电子鼻(舌)、核磁共振这几种常见的分析手段,详细地描述了分析技术的谱图预处理、数据的提取方式、数据前处理等,用以后续模式识别的判定。
1.1 红外谱仪
红外技术鉴定蜂蜜品质离不开化学计量学的参与,不论中红外(MIR)还是近红外(NIR)技术,其过程主要包括光谱图的预处理、异常样品的剔除、样本集的划分和分析模型的建立[23]。
为消除噪声干扰、基线漂移、光程变化等因素,红外光谱预处理主要有除滤噪音和基线校正。最常用的噪音除滤技术是Savitsky-Golay平滑过滤法,其思想是求解并确立一条多项式曲线,使得图谱中每个点的横坐标带入的所得值与该对应点的纵坐标的差值平方和最小,以此确保曲线拟合度最高,从而达到平滑过滤的效果[24]。而基线校正方法有微分法、多元散射校正法、归一化法等,其中常见的多元散射法主要是利用平均光谱代替理想光谱,再以理想光谱校正与之呈线性关系的样品光谱,可消除如样品粒径不一致以及镜面反射引起的一系列系统误差等[23]。
校准完谱图之后便是对图谱信息的数据提取。在红外谱图中,根据“点线面体”的思想,其图像信息实则由多个连续点连接而来,将经预处理的谱图选择适合的频率段,选择此区间下特定的间隔频率(或波数)及其对应的光强度作为一系列的数据矩阵,用于后续分析模型的建立。
1.2 荧光谱仪
蜂蜜中的氨基酸、维生素、酚类物质等具有荧光效应,为荧光光谱的应用提供了可能。其中三维荧光谱图以其丰富的信息量在食品鉴定中备受青睐。它是由荧光强度-发射波长-激发波长表征的矩阵光谱,通常以三维立体图或等高线图形象地描绘[25]。
若要建立优质的分析模型,谱图前处理是关键。不仅要对荧光强度进行平滑过滤,去除因系统、环境及样品本身的杂波干扰,还要对图谱中固定位置的拉曼光及二级峰等进行削峰处理。其次,剔除离异点要审视光谱概貌并结合实验过程判定数据的真伪[26]。
此外,对于三维谱图特征参数的提取也至关重要。由于三维荧光谱是二维区域上的能量连续分布图,通常从3个方面进行提取:一是荧光强度的分布特征,包括荧光强度的平均值、标准差等;二是荧光谱在波长空间域的分布特征,有原点矩、中心矩、密集椭圆的长轴斜率等;另外,还有荧光谱在发射波长的边际累积分布特征,又称一维边际分布[27-28]。由于这些特征参数的量纲和变化幅值不同,须进行无量纲的标准化处理来消除这些差异。一般采用标准差变换或极差标准化处理数据矩阵。为提高计算效率,可以将相关性较高的特征参数进行合并。
1.3 电子鼻与电子舌
电子鼻、电子舌分别是模拟哺乳动物的嗅觉和味觉功能而建立的人工嗅觉及味觉仪器,电子鼻配备的10个金属氧化物传感器对不同气体具有交互敏感性,呈现出不同的电阻值;而电子舌中7个传感器对不同的呈味物质(酸、咸、甜、苦、鲜)表现不同的灵敏度,呈现不同的电位差,从而使检测样品具有不同的气体或液体的“指纹信息”[29-30]。
传感器信号的预处理是关键环节,信号的预处理包括滤波处理、基线处理、漂移补偿及信息压缩等。一般情况下,商业化的电子鼻和电子舌仪器,内置的硬件和相关软件可直接进行预处理过程。除此之外,对于特征值的选择也关系到接下来模式识别效果的优劣。特征值选择是从信号值中选择具有代表性的数据,例如最大值、最小值、面积值、稳定值、或者某个点的值等,大多采用稳定值或者某几个代表意义的特殊点值作为特征值[30-31]。
1.4 核磁共振
1.4.1 低场核磁共振
低场核磁共振(LF-NMR)仪是指1H的共振频率小于200 MHz的配备永磁体的仪器。根据Ling于1962年提出的联合诱导理论,可将食品体系中的水分为结合水、不易流动水和自由水[32]。低场核磁共振就是通过测定氢核主要是H2O的纵向弛豫时间T1和横向弛豫时间T2来表征研究体系中水分的分布及流动状态,以此研究食品的相关特性[33-34]。
无论是纵向弛豫还是横向弛豫图谱,都以指数衰减函数来表达。单调的衰减曲线并不能很好区分其存在的差异,此时就须要对弛豫曲线进行反演。商品化的低场核磁共振仪都有内嵌的反演软件。其主要思想是,先对首次计算出的反演结果进行正演,算出与原数据的差值,再对差值反演,将差值反演后的结果加到原数据反演的结果上,并将此结果作为原数据的反演结果重复计算,直到达到设置的迭代停止条件为止。
经反演后的弛豫曲线分别以弛豫时间及信号强度为横、纵坐标,每部分可用T1i、T2i来表征第i个成分的纵向、横向弛豫时间。根据反演后的弛豫时间可以区分体系中水的分布形态。一般而言,结合水的弛豫时间小于10 ms,自由水的弛豫时间为 100 ms 以上,而弱结合水的弛豫时间在这两者之间。
因此,对于反演后图谱的特征值选取,一方面可以通过弛豫时间对应的信号强度的点数据作为数据矩阵,另一方面也可以通过信号强度与横坐标形成的面积与弛豫时间建立数据矩阵。当然,也可以在原始的弛豫衰减曲线中选取数据点。
1.4.2 高场核磁共振
高场核磁共振(NMR)波谱仪是具有超导磁体,1H的共振频率在400 MHz以上的波谱仪,鉴于其分辨率相對较高,利用NMR构建非靶向性数据库,可在化学计量学水平实现对食品产地、品种等方面的溯源鉴伪及特征表达[8]。
低场核磁共振无需对食品样品做任何的前处理,而对于高场液体的核磁共振,样品须以澄清的液体、毫摩尔以上的浓度装管检测,且须加入一定量的氘代试剂来锁场。对于蜂蜜体系的研究,一般采用低功率压水的脉冲序列获取一维的共振1H谱,例如noesygppr1d、cpmgpr1d等[8]。继而优化线宽因子(LB)以获得最佳信噪比和分辨率,再对谱图进行定标、相位调整以及基线校正等[10]。
谱图预处理完成后,还须进行分段积分。去除水峰压制处的信号峰,以一定的宽度对各个信号峰进行分段积分,以此得到化学位移对信号积分的数据矩阵。再者,为了消除样品浓度差异、仪器测量的不稳定性以及噪声等对数据的负面影响,归一化对数据处理至关重要。所谓面积归一化,是将核磁谱图的整个积分相加,再算出每个分段积分占积分总和的比例[35]。除此之外,考虑到样品中某些微量成分在模型中易被忽略,为消除这种变量间的差异,通常用的标准化分析方法包括中心化处理(Ctr)、自动换算处理(UV)、帕莱托换算(Par)以及回溯转换等[35-36]。
与红外、荧光、电子鼻相比,核磁共振在建库溯源及鉴伪方面能做到知其然更知其所以然,通过在溯源、鉴伪的多元统计分析中存在的变量差异,可以对核磁共振谱图进行归属指认,分析差异的原因,继而通过一系列二维谱图的结构解析,甚至可以找到食品体系中产地、品种之间差异的生物标志物,为食品安全监督及管理提供应用依据。
1.5 多数据联合技术
每种分析手段都各有优势,上述的几种分析手段是目前较为常见并能够在蜂蜜的实际鉴伪或溯源中独立应用的。随着社会的发展,对食品品质评估要求的提升,多数据联合技术[37]也将逐渐成为主流趋势。如今,例如在鱼、肉、果汁、茶、酒等食品及饮料的质量、产地评估中,通过气味、pH值、电导率、红外线、紫外线、核磁、质谱等多元分析手段的联合,可以更好地实现品质的评估[38-40]。不过也有例外,并不是说这种多数据联合技术适用于各种食品及任意分析手段的联合[41]。因此在蜂蜜品质的评估中,多数据联合技术的应用,可以借鉴但也不能盲目使用。
对于多数据联合的预处理类似于上述每种单一分析手段的预处理方式,包括各自的噪音过滤、基线校准、杂信号剔除等。此外,为防止单一模块数据的突出贡献,每种分析手段所对应的变量间的比例修正也至关重要,通常通过自动缩放(auto-scaling)、均方扩展(root square scaling)、对数处理(log scaling)等来实现[37]。
2 模式识别分析
由上述各种分析手段得到数据矩阵,只是化学计量学方法应用于鉴伪及品质评估的前奏,后续的模式识别分析技术才是关键。模式识别是对表征事物或现象的各种形式进行处理分析,以对事物或现象进行描述、辨认、分类和解释的过程[42]。一般用散点图表征样本聚集程度,从而获得分类信息情况并且发现异常样本点[35]。
模式识别作为蜂蜜鉴伪领域的数据分析模块,一般分为无监督分类模型、有监督分类模型和回归预测模型。回归预测模型包括主成分回归(PCR)、偏最小二乘回归(PLSR)等,多用以糖浆掺假分析、组成成分定量预测等。有监督与无监督的区别在于无监督识别模式没有任何训练样本,而直接对数据进行建模,主要有主成分分析(PCA)、聚类分析(CA)等,用来初步分析组间趋势及离异样本点。另一类是有监督的模式识别,又包括分类判别与分类建模2类,例如判别分析(DA)、支持向量机(SVM)、人工神经网络(ANN)、类模拟软独立建模(SIMCA)等。这些分类判别模型在糖浆掺假分析、生物及产地溯源中都有广泛的应用(图2)。本文将简要介绍几种常见的模型。
2.1 无监督分类模型
2.1.1 主成分分析
主成分分析(PCA)是在力求数据信息丢失最少的原则下,对高维的变量进行降维,使大部分数据信息包含在较少的新变量上,新生成的变量相互正交,彼此独立[35]。主成分(PC)是由原变量按照一定权重线性组合而成的新变量,第一主成分(PC1)贡献最大,其后次之。
无论采用何种模式识别方法,都须要进行初步的探索性分析,用来评估测量的重复性并检测出明显的离群值,PCA就是最常用的技术[43]。表现在可利用PCA的降维功能,为后续的分类或预测的多元统计分析作基础[22,44-45];其次,某些情况下,单独使用PCA模型便可对样品进行分类,例如在蜂蜜糖浆掺假分析、生物来源及地理来源分类中的应用[2,31,46-48];此外,PCA散点图既可以发现样品中的异常点[35],也可以发现潜在的组间区分趋势。尤其是Bázár等在利用近红外分析高果玉米糖浆掺假时,发现随着掺假糖浆比例的增加,其样品点的分布也逐渐由真蜂蜜向纯糖浆过渡[49]。
一般而言,PCA在蜂蜜鉴伪预测中其模型的可靠性较低,是因为当一些有用变量的相关性较小时,在提取主成分时就很容易把它们漏掉,使得最终的预测模型可靠性下降。
2.1.2 聚类分析
聚类分析(CA)的本质是对数据进行分类,将相异的数据尽量分开,相似数据聚成一个类别,达到物以类聚的效果。
CA和PCA类似,也可以用于模型的初步探索,只不过CA是基于相似性度量原则将样品分为特定的组,同样可以评估测量的重复性及检测离群值。聚类分析方法在蜂蜜鉴伪的应用中多以分层聚类分析(HCA)为主,尤其是在蜜源的生物及地域的溯源中,能够对样品进行可视化的分类[2,3,31,50-52]。但也有研究表明,这种基于相似性的分类的正确率低于其他模型[31],因此还须要结合其他更优模型达到理想的分类效果。
2.2 有监督分类模型
2.2.1 分类判别技术
分类判别技术是首先定义一个判定标准,再将所有的未知样品通过这个判定标准去划分至其中的一个类别中[43,53]。这种非一即二的判定思想,在外源糖浆掺假的判定、蜂蜜生物及地理溯源中均有很好的应用。
2.2.1.1 判别分析
判别分析(DA)是一种监督学习的降维技术,与PCA不同,它的数据集的每个样本是有类别输出的。线性判别分析(LDA)的思想可以概括为投影后类内方差最小,类间方差最大。即要将数据在低维度上进行投影,投影后希望每一种类别数据的投影点尽可能地接近,而不同类别数据的类别中心距离尽可能疏远[53]。因而,LDA不仅可用于掺假的判别,还可以用于蜜源及产地的分类[54-57]。已有研究中,利用高场核磁共振技术,简单的PCA-LDA模型便可在蜂蜜生物来源分析中的正确判定率达98.9%[58]。
此外,偏最小二乘-判别分析(partial least squares-discriminant analysis,简称PLS-DA)的类别变量并非是直接采集所得,而是一种潜在的变量分类指向,有利于数据模型指导样本分类和寻找组间的差异[59]。还有一种正交偏最小二乘-判别分析法(orthogonal to partial least squares-discriminant analysis,简称OPLS-DA),是在PLS-DA的基础上结合正交信号校正,可过滤掉与光谱变量、类别变量不相关的变量信息,提高模型的解释能力和预测性。PLS-DA、OPLS-DA在蜂蜜外源糖浆掺假以及蜂蜜生物、地域来源中都有广泛应用[60-63]。有研究表明,对于不同花型的单花蜜及百花蜜通过 PLS-DA建模,可完全無误地对其进行分类判定[45]。陈雷等利用1H核磁共振技术,对303个油菜蜜及180个不同比例高果糖浆掺假蜂蜜进行OPLS-DA的建模分析,其训练集与测试集的正确率分别为98.40%、98.24%[10]。若糖浆掺假含量在10%以上,利用OPLS-DA模型则可以准确地对掺假蜂蜜进行判定。正因糖浆对真实蜂蜜的影响,在核磁共振谱图中以“稀释”的作用呈现,这种线性的影响结合OPLS-DA模型便可完美表达。因此,这种高效的方法为蜂蜜掺假的实际应用提供了可能。
2.2.1.2 人工神经网络
人工神经网络(artificial neural network,简称ANN)作为一种机器学习方法,是对人脑的抽象、简化与模拟。其中应用较为广泛的反向传播人工神经网络(BP-ANN),是确定好网络输入及期望输出,通过对训练集反复迭代,利用信号的正向传播与误差的反向传播来控制训练集的,误差最低。
基于ANN的非線性模式识别功能,此模型在蜂蜜外源糖浆掺假分析中及蜜源、地域溯源中都有广泛的应用[24,27-28,31]。Wei等通过电子舌技术并结合ANN模型对蜂蜜花型及地域的判定正确率达95%[31]。此外,有研究表明,利用3D荧光技术在对大米糖浆掺假蜂蜜的鉴定研究中发现,BP-ANN优于PLS模型,其原因在于糖浆掺假浓度与3D荧光谱图数据并非呈线性关系,而神经网络具有很强的稳健性、较高的记忆能力以及强大的自学习能力,因此利用ANN模型解决荧光技术中的蜂蜜掺假问题更适用[27-28]。
2.2.1.3 支持向量机
支持向量机(SVM)也是一种机器学习方法,其基本思想是将数据空间映射到高维空间,通过力求训练集错误率最低来寻求空间最优超平面,使得分类间隔最大。SVM这种模型越来越受欢迎,不仅可应用于糖浆掺假的案例,在蜂蜜生物、地理溯源中应用也相当广泛[20,22,24,47-48]。
Zhu等在模拟果葡糖浆对不同地域的6种花型蜂蜜进行掺假研究中表示,糖浆掺假质量分数不低于7%时,利用LS-SVM模型优于LDA、ANN等,可达100%的正确率,对此他的解释是近红外光谱呈现的变量与糖浆掺假比例并非线性关系[24]。当然,SVM模型在紫外可见光谱[22]、近红外光谱[48]、电子鼻(舌)[20,47]技术中对蜂蜜的生物溯源的正确率也很高。
由此可见,SVM模型多应用于传感器识别及光谱检测技术之中。作为一种有监督的分类模型,通过优化参数确保训练集较高的正确率,从而也高水平地保证了测试数据集的判别率。此外,SVM与ANN模型相似,其非线性的理念符合传感器识别及光谱检测特征,因而可在此类技术中广泛应用。
2.2.2 分类建模技术
分类建模技术(class modeling techniques)是先计算出每一个单独的模型类别,再对未知样品进行归类或者拒绝。SIMCA模型就是其中最典型的分类模型,未知样本的结果输出要么被归为一类(真阳性)或几类(假阳性),要么就不归类(假阴性)[44]。
SIMCA的基本思路是在PCA结果基础上对各类样本建立相应的类模型,即首先建立每一类的PCA回归模型,再根据未知样本逐一拟合各个类模型,根据拟合结果对其进行判别及归类[64]。
Se及其团队人员基于先进的红外技术,利用SIMCA模型区分掺入质量浓度高于8%玉米糖浆和超过质量分数为2%蔗糖的蜂蜜样品,结果令人满意[44]。同样,SIMCA模型在荧光技术的糖浆掺假分析中,对掺假样品的检测敏感性和特异性均为100%[65]。不仅在糖浆掺假领域,SIMCA模型在蜂蜜地域判别、花型分类中等均有应用[2,21,66-67]。
2.3 回归预测模型
回归模型是一种预测性的建模技术,它研究的是因变量Y和自变量X之间的关系,这种技术通常用于预测分析。例如主成分回归(principle component regression,简称PCR)、多元线性回归(multiple linear regression,简称MLR)、偏最小二乘回归(partial least squares regression,简称PLSR)等,其中以PLSR应用最为广泛。
PLSR是一种多因变量Y对多自变量X的回归建模方法,不仅尽可能提取Y和X中的主成分,又利用协方差思想使提取出的主成分之间的相关性最大化。因此,PLSR已被广泛应用于蜂蜜的掺假定性以及特殊组分的定量中[68]。
不少研究表明,PLSR模型不仅可以精确定量掺假浓度[44],量化掺假范围[60],还可以利用红外、拉曼光谱定量测定蜂蜜中酚类化合物含量,例如丁香酸、香草酸、亚铁螯合物等[68]。由此可见,PLSR模型应用广泛,这种预测功能可在养蜂及制药行业用以蜂蜜的品质鉴定及评估。
总而言之,以上的模型基本涵盖了目前蜂蜜鉴伪领域中的用途,包括外源糖浆掺假、蜂蜜生物及产地的溯源,以及对蜂蜜特殊组分的预测及定量等。每种模型都各有所长,只有充分了解模型的用途、明确自己的预期结果,才能保证模型最有效地利用。此外,如何选择最优的分类模型,也要结合仪器的特性,例如,核磁共振对于掺假的线性效应,OPLS-DA模型更为适用;红外、荧光等光谱变量与掺假糖浆之间并非简单的线性关系,此时选择非线性的判别模型,例如ANN、SVM等,可能结果就会更为理想。
3 验证分析
验证分析是在建立模型的基础上,防止训练集模型发生过拟合现象,对已建立模型的有效性、可靠性进行评估的整个过程。常见的模型验证分析包括交叉验证(cross-validation)、排列试验法(permutation test)以及交叉验证-方差检验。
留一法交叉验证作为交叉验证中最常见的一种,可用于任何模型的验证分析,是利用一部分数据对另一部分数据模型拟合的验证[27,49,67]。其方法是从n个观测数据中选择1个作为验证数据,再将剩下的观测数据拟合成模型,并使用最先排除的那个观测值来验证这个模型的精度,如此重复n次。观测值与模型预测结果之间的相关系数r用以评估模型的准确性,用模型的预测误差均方根(RMSEP)来量化模型的精确度,r越接近于1,RMSEP越低,说明此模型的精度越高。
而排列实验法则多见于PLS、PLS-DA、OPLS-DA模型中[10,63],通过n次随机改变类别变量Y的顺序,求得相应不同的累计贡献率R2及预测能力Q2,若原始模型的R2、Q2大于任何类别变量随机排列模型的值,则说明该模型可靠有效。
交叉验证-方差检验同样也是用于PLS、OPLS类的模型的显著性验证[59],是在交叉验证的基础上的方差分析。此检验结果最终以P值表征模型的显著性,通常认为P<0.05时,模型有效。
模型若驗证有效,则可以继续对测试集数据进行正式建模及判定分析,若模型的验证分析效果一般,则须重新优化条件,重新建模,甚至须重新进行谱图数据的前处理,建立其他新的有效模型。
4 总结
相对于其他的食品或酒水而言,蜂蜜品质的鉴定与评估的难度系数较大。化学计量学方法的发展在蜂蜜鉴伪中正发挥其应用价值。如图3所示,首先要根据自己的需求,选择合适的训练集进行模型的初步分析,再在此基础上选择最优模型,优化参数以保证训练集的高准确率。至此,为防止模型过拟合,须要对模型做验证分析。在确保训练集模型的高效可靠下,最终对待测样品即测试集进行相应的模式识别和判定。根据统计学的理念,当真蜂蜜样本的数据库足够大,即训练集足够涵盖各种花型、产地等信息时,建立好最优的判定模型可对未知蜂蜜样品的分类作出正确判定。
参考文献:
[1]中华人民共和国卫生部. 蜂蜜:GB 14963—2011[S]. 北京:中国标准出版社,2011.
[2]Boffo E F,Tavares L A,Tobias A,et al. Identification of components of Brazilian honey by 1H NMR and classification of its botanical origin by chemometric methods[J]. LWT - Food Science and Technology,2012,49(1):55-63.
[3]Olga E,María F G,Carmen S M. Differentiation of blossom honey and honeydew honey from northwest Spain[J]. Agriculture,2012,2(4):25-37.
[4]Jamróz M K,Paradowska K,Zawada K,et al. 1H and 13C NMR-based sugar profiling with chemometric analysis and antioxidant activity of herbhoneys and honeys[J]. Journal of the Science of Food and Agriculture,2014,94(2):246-255.
[5]Piljac-egarac J,Stipcˇevic' T. Antioxidant properties and phenolic content of different floral origin honeys[J]. Journal of ApiProduct and ApiMedical Science,2009,1(2):43-50.
[6]Molan P C. The evidence supporting the use of honey as a wound dressing[J]. The International Journal of Lower Extremity Wounds,2006,5(1):40-54.
[7]裴高璞,史波林,赵 镭,等. 蜂蜜质量市场动态及掺假检测方法现状分析[J]. 食品科学,2013,34(15):329-336.
[8]Siddiqui A J,Musharraf S G,Choudhary M I,et al. Application of analytical methods in authentication and adulteration of honey[J]. Food Chemistry,2017,217:687-698.
[9]Soares S,Amaral J S,Oliveira M,et al. A comprehensive review on the main honey authentication issues:production and origin[J]. Comprehensive Reviews in Food Science and Food Safety,2017,16(5):1072-1100.
[10]陈 雷,刘红兵,罗立廷. 氢核磁共振结合正交偏最小二乘法对油菜蜜中果葡糖浆掺假的判别分析[J]. 食品科学,2017,38(4):275-282.
[11]Nunes C A. Vibrational spectroscopy and chemometrics to assess authenticity,adulteration and intrinsic quality parameters of edible oils and fats[J]. Food Research International,2014,60:255-261.
[12]Ma H L,Wang J W,Chen Y J,et al. Rapid authentication of starch adulterations in ultrafine granular powder of Shanyao by near-infrared spectroscopy coupled with chemometric methods[J]. Food Chemistry,2017,215:108-115.
[13]Shi T,Zhu M T,Chen Y,et al. 1H NMR combined with chemometrics for the rapid detection of adulteration in camellia oils[J]. Food Chemistry,2018,242:308-315.
[14]Guler A,Kocaokutgen H,Garipoglu A V,et al. Detection of adulterated honey produced by honeybee (Apis mellifera L.) colonies fed with different levels of commercial industrial sugar (C3 and C4 plants) syrups by the carbon isotope ratio analysis[J]. Food Chem,2014,155:155-160.
[15]Dong H,Xiao K J,Luo D H,et al. Adulteration identification of commercial honey with the C-4 sugar content of negative values by an elemental analyzer and liquid chromatography coupled to isotope ratio mass spectroscopy[J]. Journal of Agricultural and Food Chemistry,2016,64(16):3258-3265.
[16]Luo D H,Luo H Y,Dong H,et al. Hydrogen(2H/1H)combined with carbon(13C/12C)isotope ratios analysis to determine the adulteration of commercial honey[J]. Food Analytical Methods,2015,9(1):255-262.
[17]Wang S Q,Guo Q L,Wang L L,et al. Detection of honey adulteration with starch syrup by high performance liquid chromatography[J]. Food Chemistry,2015,172:669-674.
[18]Yilmaz M T,Tatlisu N B,Toker O S,et al. Steady,dynamic and creep rheological analysis as a novel approach to detect honey adulteration by fructose and saccharose syrups:correlations with HPLC-RID results[J]. Food Research International,2014,64:634-646.
[19]Wang J M,Xue X F,Du X J,et al. Identification of acacia honey adulteration with rape honey using liquid chromatography-electrochemical detection and chemometrics[J]. Food Analytical Methods,2014,7(10):2003-2012.
[20]Bougrini M,Tahri K,Saidi T,et al. Classification of honey according to geographical and botanical origins and detection of its adulteration using voltammetric electronic tongue[J]. Food Analytical Methods,2016,9(8):2161-2173.
[21]Gallardo-Velázquez T,Osorio-Revilla G,Zuiga-de Loa M,et al. Application of FTIR-HATR spectroscopy and multivariate analysis to the quantification of adulterants in Mexican honeys[J]. Food Research International,2009,42(3):313-318.
[22]Almaleeh A A,Adom A H,Fathinul-Syahir A S. Classification of the botanical origin for Malaysian honey using UV-vis spectroscopy[C]. AIP Conference Proceedings,2017,1808:020008.
[23]李水芳. 蜂蜜質量的近红外光谱分析技术研究[D]. 长沙:中南林业科技大学,2012.
[24]Zhu X R,Li S F,Shan Y,et al. Detection of adulterants such as sweeteners materials in honey using near-infrared spectroscopy and chemometrics[J]. Journal of Food Engineering,2010,101(1):92-97.
[25]Sergiel I,Pohl P,Biesaga M,et al. Suitability of three-dimensional synchronous fluorescence spectroscopy for fingerprint analysis of honey samples with reference to their phenolic profiles[J]. Food Chemistry,2014,145:319-326.
[26]田广军. 基于三维荧光谱参数化及模式识别的水中油类鉴别与测定[D]. 秦皇岛:燕山大学,2005.
[27]Chen Q S,Qi S,Li H H,et al. Determination of rice syrup adulterant concentration in honey using three-dimensional fluorescence spectra and multivariate calibrations[J]. Spectrochimica Acta Part A-Molecular and Biomolecular Spectroscopy,2014,131:177-182.
[28]赵杰文,韩小燕,陈全胜,等. 基于三维荧光光谱技术对掺假蜂蜜无损鉴别研究[J]. 光谱学与光谱分析,2013,33(6):1626-1630.
[29]裘姗姗. 基于电子鼻、电子舌及其融合技术对柑橘品质的检测[D]. 杭州:浙江大学,2016.
[30]Peris M,Escuder-Gilabert L. Electronic noses and tongues to assess food authenticity and adulteration[J]. Trends in Food Science & Technology,2016,58:40-54.
[31]Wei Z B,Wang J,Liao W Y. Technique potential for classification of honey by electronic tongue[J]. Journal of Food Engineering,2009,94(3/4):260-266.
[32]Ling G N. A physical theory of the living state:the association-induction hypothesis[J]. Academic Medicine,1963,38(6):530.
[33]Ribeiro R O R,Mársico E T,da Silva Carneiro C,et al. Classification of Brazilian honeys by physical and chemical analytical methods and low field nuclear magnetic resonance (LF 1H NMR)[J]. LWT-Food Science and Technology,2014,55(1):90-95.
[34]Ribeiro R O R,Mársico E T,da Silva Carneiro C,et al. Detection of honey adulteration of high fructose corn syrup by low field nuclear magnetic resonance (LF-1H-NMR)[J]. Journal of Food Engineering,2014,135:39-43.
[35]徐 姍. 肿瘤发生发展对非涉及器官代谢组的影响规律研究[D]. 武汉:华中师范大学,2016.
[36]王小花. 基于NMR技术的国内外食醋质量与安全研究[D]. 武汉:中国科学院大学(中国科学院武汉物理与数学研究所),2016.
[37]Borràs E,Ferré J,Boqué R,et al. Data fusion methodologies for food and beverage authentication and quality assessment - a review[J]. Analytica Chimica Acta,2015,891:1-14.
[38]Shen F,Wu Q,Su A,et al. Detection of adulteration in freshly squeezed orange juice by electronic nose and infrared spectroscopy[J]. Czech Journal of Food Sciences,2016,34(3):224-232.
[39]Alamprese C,Casale M,Sinelli N,et al. Detection of minced beef adulteration with Turkey meat by UV-vis,NIR and MIR spectroscopy[J]. LWT - Food Science and Technology,2013,53(1):225-232.
[40]Ottavian M,Fasolato L,Serva L,et al. Data fusion for food authentication:fresh/frozen-thawed discrimination in West African goatfish(Pseudupeneus prayensis)fillets[J]. Food and Bioprocess Technology,2013,7(4):1025-1036.
[41]Louw L,Roux K,Tredoux A,et al. Characterization of selected South African young cultivar wines using FTMIR spectroscopy,gas chromatography,and multivariate data analysis[J]. Journal of Agricultural and Food Chemistry,2009,57(7):2623-2632.
[42]史海成,王春艷,张媛媛. 浅谈模式识别[J]. 今日科苑,2007(22):169.
[43]Biancolillo A,Bucci R,Magrì A L,et al. Data-fusion for multiplatform characterization of an Italian craft beer aimed at its authentication[J]. Analytica Chimica Acta,2014,820:23-31.
[44]Se K W,Ghoshal S K,Wahab R A,et al. A simple approach for rapid detection and quantification of adulterants in stingless bees (Heterotrigona itama) honey[J]. Food Research International,2018,105:453-460.
[45]Schievano E,Peggion E,Mammi S. 1H nuclear magnetic resonance spectra of chloroform extracts of honey for chemometric determination of its botanical origin[J]. Journal of Agricultural and Food Chemistry,2010,58(1):57-65.
[46]Tiwari K,Biswas S,Tudu B,et al. Development of metal oxide-modified carbon paste based sensor for honey analysis using electronic tongue[J]. Materials Today:Proceedings,2017,4(9):9500-9504.
[47]Gan Z L,Yang Y,Li J,et al. Using sensor and spectral analysis to classify botanical origin and determine adulteration of raw honey[J]. Journal of Food Engineering,2016,178:151-158.
[48]Minaei S,Shafiee S,Polder G,et al. VIS/NIR imaging application for honey floral origin determination[J]. Infrared Physics & Technology,2017,86:218-225.
[49]Bázár G,Romvári R,Szabó A,et al. NIR detection of honey adulteration reveals differences in water spectral pattern[J]. Food Chemistry,2016,194:873-880.
[50]Chen H,Jin L H,Chang Q Y,et al. Discrimination of botanical origins for Chinese honey according to free amino acids content by high-performance liquid chromatography with fluorescence detection with chemometric approaches[J]. Journal of the Science of Food and Agriculture,2017,97(7):2042-2049.
[51]Arvanitoyannis I S,Chalhoub C,Gotsiou P,et al. Novel quality control methods in conjunction with chemometrics (multivariate analysis) for detecting honey authenticity[J]. Critical Reviews in Food Science and Nutrition,2005,45(3):193-203.
[52]Tuberoso C I,Jerkovic′ I,Sarais G,et al. Color evaluation of Seventeen European unifloral honey types by means of spectrophotometrically determined CIE L* C*abh°ab chromaticity coordinates[J]. Food Chemistry,2014,145:284-291.
[53]Wu L,Du B,Heyden Y V,et al. Recent advancements in detecting sugar-based adulterants in honey-a challenge[J]. Trac Trends in Analytical Chemistry,2016,86:25-38.
[54]Oroian M,Ropciuc S,Paduret S,et al. Authentication of romanian honeys based on physicochemical properties,texture and chemometric[J]. Journal of Food Science and Technology,2017,54(13):4240-4250.
[55]Amiry S,Esmaiili M,Alizadeh M. Classification of adulterated with date and invert syrups[J]. Food Chem,2017,224:390-397.
[56]Nayik G A,Suhag Y,Majid I,et al. Discrimination of high altitude Indian honey by chemometric approach according to their antioxidant properties and macro minerals[J]. Journal of the Saudi Society of Agricultural Sciences,2018,17(2):200-207.
[57]Gerhardt N,Birkenmeier M,Schwolow S,et al. Volatile-Compound fingerprinting by headspace-gas-chromatography ion-mobility spectrometry (HS-GC-IMS) as a benchtop alternative to 1H NMR profiling for assessment of the authenticity of honey[J]. Analytical Chemistry,2018,90(3):1777-1785.
[58]Gerhardt N,Birkenmeier M,Kuballa T,et al. Differentiation of the botanical origin of honeys by fast,non-targeted 1H-NMR profiling and chemometric tools as alternative authenticity screening tool[C]//Proceedings of the ⅩⅢ international conference on the applications of magnetic resonance in food science,2016.
[59]Eriksson L,Trygg J,Wold S. CV-ANOVA for significance testing of PLS and OPLS models[J]. Journal of Chemometrics,2008,22(11/12):594-600.
[60]Li S F,Zhang X,Shan Y,et al. Qualitative and quantitative detection of honey adulterated with high-fructose corn syrup and maltose syrup by using near-infrared spectroscopy[J]. Food Chemistry,2017,218:231-236.
[61]Jandric′ Z,Haughey S A,Frew R D,et al. Discrimination of honey of different floral origins by a combination of various chemical parameters[J]. Food Chemistry,2015,189:52-59.
[62]Zuccato V,Finotello C,Menegazzo I,et al. Entomological authentication of stingless bee honey by 1H NMR-based metabolomics approach[J]. Food Control,2017,82:145-153.
[63]Zheng X,Zhao Y R,Wu H F,et al. Origin identification and quantitative analysis of honeys by nuclear magnetic resonance and chemometric techniques[J]. Food Analytical Methods,2015,9(6):1470-1479.
[64]Maesschalck R D,Candolfi A,Massart D L,et al. Decision criteria for soft Independent modelling of class analogy applied to near infrared data[J]. Chemometrics & Intelligent Laboratory Systems,1999,47(1):65-77.
[65]Mehretie S,Al Riza D F,Yoshito S,et al. Classification of raw Ethiopian honeys using front face fluorescence spectra with multivariate analysis[J]. Food Control,2018,84:83-88.
[66]Aliferis K A,Tarantilis P A,Harizanis P C,et al. Botanical discrimination and classification of honey samples applying gas chromatography/mass spectrometry fingerprinting of headspace volatile compounds[J]. Food Chemistry,2010,121(3):856-862.
[67]Herrero Latorre C,Pea Crecente R M,García Martín S,et al. A fast chemometric procedure based on NIR data for authentication of honey with protected geographical indication[J]. Food Chemistry,2013,141(4):3559-3565.
[68]Tahir H E,Xiaobo Z,Zhihua L,et al. Rapid prediction of phenolic compounds and antioxidant activity of Sudanese honey using Raman and Fourier transform infrared (FT-IR) spectroscopy[J]. Food Chemistry,2017,226:202-211.
