丛枝菌根真菌促进南美蟛蜞菊在低磷环境下的生长
2020-06-01陈琪程浩李琴贺芙蓉吴闻文祁珊珊戴志聪杜道林
陈琪 程浩 李琴 贺芙蓉 吴闻文 祁珊珊 戴志聪 杜道林

摘要:目前,外来入侵植物南美蟛蜞菊已经造成了严重的生态环境问题。尽管已经有很多研究报道了南美蟛蜞菊快速扩张的机制,但是关于南美蟛蜞菊在低营养环境下依旧能够保持较快扩散能力机制的研究却很少。旨在探讨不同磷环境下丛枝菌根真菌对南美蟛蜞菊快速生长的影响及其机制。结果表明,丛枝菌根真菌与南美蟛蜞菊可以形成良好的共生关系,在低磷环境下,可以明显优化南美蟛蜞菊的生物量分配策略,地下、地上的生物量分配支持最优分配理论。此外,丛枝菌根真菌可以显著提高低磷环境下南美蟛蜞菊叶片中的茉莉酸、赤霉素含量,从而促进植物生长。以上研究结果说明,丛枝菌根真菌可以通过调节植物体内的激素含量而对南美蟛蜞菊的生物量分配策略产生影响,从而促进南美蟛蜞菊在低磷环境下的快速生长与扩张。
关键词:丛枝菌根真菌;南美蟛蜞菊;激素;入侵植物;资源分配策略
中图分类号: S451;S182文献标志码: A
文章编号:1002-1302(2020)08-0103-05
收稿日期:2019-03-20
基金项目:国家自然科学基金(编号:31700342、31600326、31770446);江苏省自然科学基金(编号:BK20150503)。
作者简介:陈 琪(1994—),男,江苏常州人,硕士研究生,主要从事入侵生态学研究。Tel:(0511)88790955;E-mail:chen1455526947@163.com。
通信作者:祁珊珊,博士,讲师,从事入侵生态学、农业生态等方面的研究。Tel:(0511)88790955;E-mail:qishanshan1986120@163.com。
随着人类社会的进步与发展,国家间经济贸易自由及人员交流的全球化进程不断加快,外来植物入侵(alien plant invasion)已经成为全球性问题。入侵植物不仅对当地的生态系统、生物多样性造成严重破坏,还会造成巨大的经济损失,对农业生态环境的影响尤为严重[1]。2017年在浙江杭州召开的第三届国际入侵生物学大会(ICBI 2017)指出:中国的外来入侵物种已达620余种,其中入侵植物500多种,造成了逾2 000亿元人民币的经济损失。对于外来植物入侵的机制,研究人员给出了很多假说和解释[2-5],其中部分入侵植物在新栖息地能够充分利用资源(甚至是低营养环境)而拥有快速生长的能力,从而促进其成功入侵[6]。营养对于植物来说是至关重要的,然而即使在营养匮乏的环境中,如沙地、城市建筑荒地等[7-8],入侵植物依然能够快速地生长,其原因尚不清晰。
丛枝菌根(Arbuscular mycorrhizal)是植物界存在的最古老、最广泛的共生组织之一,迄今为止已有4亿年的历史[9]。丛枝菌根真菌(arbuscular mycorrhizal fungi,简称AMF)可以侵染80%以上的植物根部并与植物形成高效的共生关系[10]。这种高效的共生体主要依靠真菌在植物根部遍布的菌丝形成的菌丝网络[11],从而为植物提供必需的矿物质和营养元素,例如磷、氮等[12-13]。而作为回报,植物则给真菌提供光合产物有机碳源[14]。正因为这样,AMF可以提高植物在逆境下对营养元素的利用效率[15],却会在营养充足的环境中削弱与植物的共生关系[16]。相关研究表明,AMF能够促进植物对磷元素的吸收[12],影响植物的生长[17],并且能够促进入侵植物的生长[18],进而提高其竞争力[19]。南美蟛蜞菊[Wedelia trilobata (L.) A.S. Hitchc.]是原产于南美洲的一种多年生常绿克隆植物[20],目前被列为世界上100种恶性入侵种之一[21]。自20世纪70年代被引入我国华南以来,南美蟛蜞菊快速生长传播,目前已在地表形成浓密的覆盖层,排挤当地植物的生存空间,并在荒地形成大片单一的密集种群,严重影响当地植物的多样性,甚至会造成生态系统的功能失衡[22]。虽然目前关于南美蟛蜞菊局部适应性和表型可塑性研究[23]、分子角度对南美蟛蜞菊的入侵性研究[24]、南美蟛蜞菊的化感作用研究[25]等相关研究已有很多,但是关于AMF在南美蟛蜞菊应对低磷环境影响的作用及其应对机制却鲜有研究。
因此,本研究致力于探讨AMF在低磷营养环境中对南美蟛蜞菊生长的作用,以期揭示南美蟛蜞菊在低磷环境中快速扩张的机制,丰富和发展入侵生态学理论,为外来植物入侵的科学防治工作提供理论基础。
1 材料与方法
1.1 试验材料
本试验选取的入侵植物南美蟛蜞菊采自我国海南省海口市,在江苏大学温室内扩繁。选取生长健康、长势(长短、粗细)一致的南美蟛蜞菊茎段,每个茎段保留2个茎节,所有茎段均在5%次氯酸钠溶液中表面消毒灭菌10 min,然后用无菌水洗涤5次备用。
AMF选用的地表球囊霉(Glomus versiforme,簡称GV)购自北京农林科学院植物营养与资源研究所。本试验所用GV菌剂为自行扩繁后的含培养基质、孢子、菌丝和侵染根段的混合物,其孢子数量为 4个/g。具体扩繁过程如下:选取粒径小于2 mm、洗净后的河沙与沸石(按体积比1 ∶1混合均匀)作为基质,装在布袋中,于121 ℃高压灭菌2 h;烘干冷却后,装入消过毒的花盆(20 cm×15 cm×15 cm)中至约2/3高度,将100 g菌剂均匀撒在花盆中,接着铺上2 cm厚的基质;将高粱[Sorghum bicolor (L.) Moench]种子表面消毒、洗净后点播在基质中,每盆播种5粒种子,最后用基质将种子盖好,将其置于温室中,用无菌水浇灌培养4个月,其间每周补充1次300 mL的1×Hoaglands营养液;收获时去除地上部分和表层基质后,将根剪碎,与地下部分的基质混合均匀,自然风干后装入密封袋内,于4 ℃冰箱保存备用。
1.2 试验设计
本试验采用盆栽培养,共设置4个处理。营养浓度处理:(1)正常营养;(2)低磷营养。AMF处理:(1)不添加GV菌剂;(2)添加GV菌剂。正常营养处理的植株添加含有181.3 mg/L氮、30.9 mg/L磷的1×Hoaglands营养液;低磷营养处理的植株添加含有 181.3 mg/L 氮、1.545 mg/L磷的低磷1×Hoaglands营养液。其中,氮、磷的形式分别为NO-3、PO3-4。
本试验采用沙培法培养,每个方形塑料盆(10 cm×10 cm×10 cm)中含有700 g洗凈、灭菌烘干的河沙(直径<2 mm,无任何营养添加)。其中,添加AMF的处理方法如下:将5 g GV菌剂与695 g河沙混合均匀后加入盆中;将选取的植物茎段垂直扦插在花盆中的相同位置,每盆插入1个茎段,保持1个茎节埋在沙中,所有植株均放置于相对湿度为70%、温度为25 ℃、光—暗周期为16 h—8 h的温室内进行培养。每天用蒸馏水浇灌植物,并且每3 d分别添加50 mL正常或低磷的1×Hoaglands营养液,共培养2个月,在此期间每盆共计添加1 000 mL正常营养或低磷营养的Hoaglands营养液。
1.3 菌根定殖率的测定
依据Phillips等的方法评估菌根定殖率[26]。从方盆3 cm深处取出大小合适的幼根,用蒸馏水轻轻洗净后切成2 cm的碎片。然后在10% KOH中消化,接着放入H2O2中漂洗,随后用1% HCl酸化,再用0.05%台盼蓝染色,最后用50%乳酸脱色后,在显微镜下观察。
1.4 叶片激素含量的测定
用酶联免疫吸附法测定茉莉酸、赤霉素含量[27]。
1.5 数据分析
使用SPSS 17.0,采用单因素方差分析法(one-way ANOVA)进行不同处理间的差异显著性分析(Duncans test,α=0.05)。用Origin 8.1对数据统计分析结果进行作图。
2 结果与分析
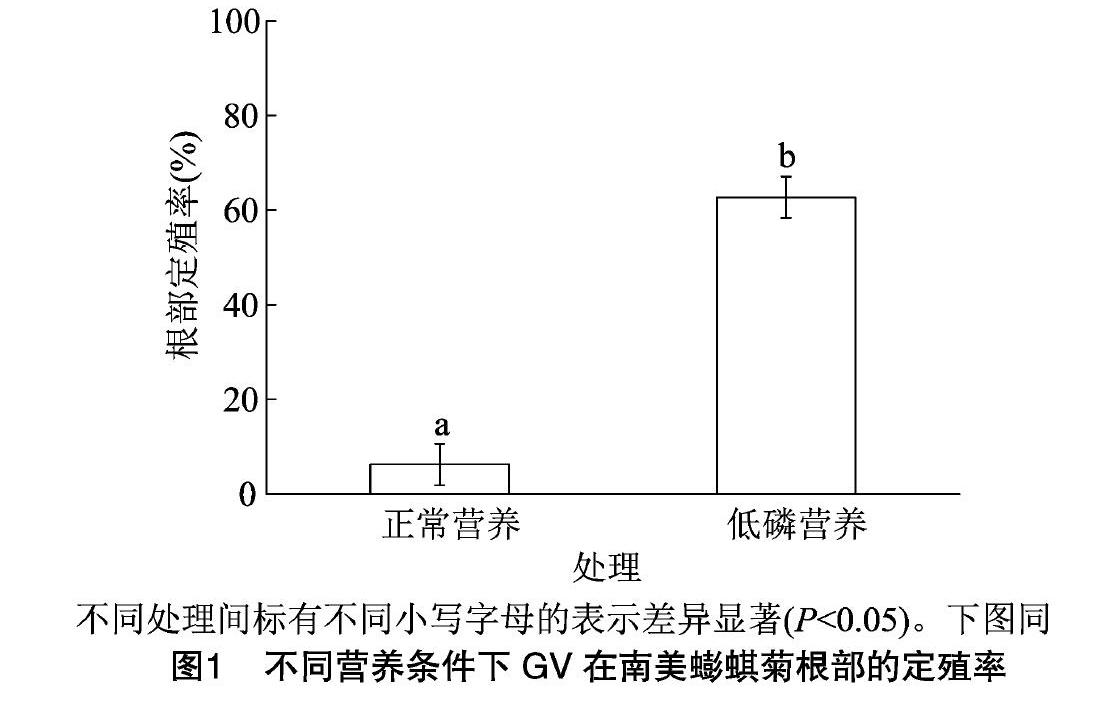
由图1可以看出,在正常营养、低磷营养处理下,GV在南美蟛蜞菊根部均有定殖,但是在低磷处理下GV的定殖率(62.7%)显著高于正常营养处理下GV的定殖率(4.3%)。
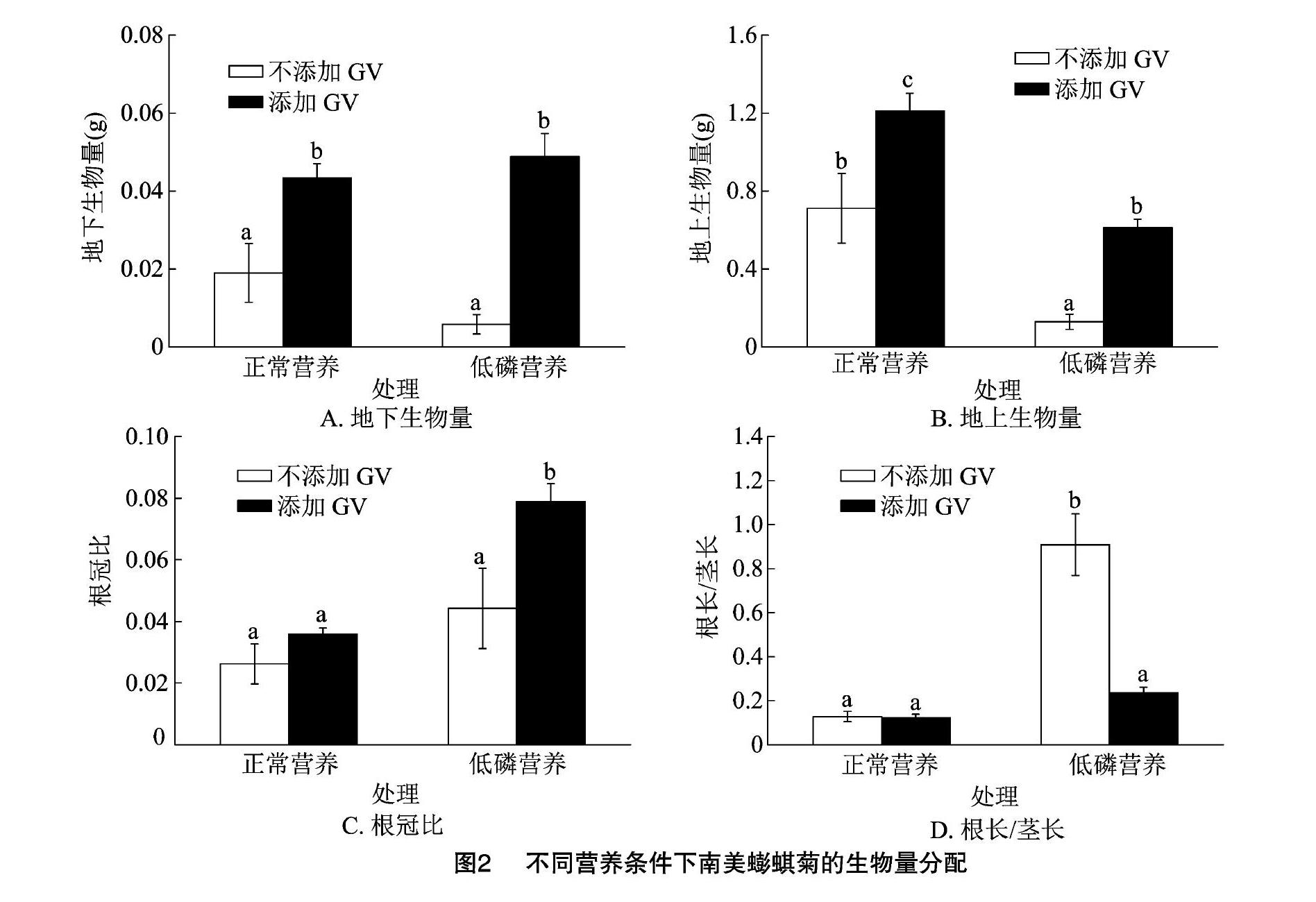
由表1可以看出,AMF对植株的4个生长指标都有显著(P<0.05)或极显著(P<0.01)影响。由图2-A、图2-B可以看出,与对照组相比,添加GV显著增加了低磷、正常营养处理下的地上、地下部生物量(P<0.05)。由图2-C、图2-D可以看出,在低磷处理下,添加GV显著提高了生物量的根冠比(P<0.05),但是显著降低了根长与茎长的比值;此外还可以看出,在正常营养条件下,添加GV与不添加GV处理间的根冠比、根长与茎长的比值均无显著差异。由图3、图4可以看出,添加GV显著增加了低磷处理下南美蟛蜞菊体内的茉莉酸、赤霉素含量(P<0.05)。
3 讨论
本研究发现,AMF与南美蟛蜞菊可以形成良好的共生关系,在低磷环境下,可以通过增加地下部分的生物量投入来优化南美蟛蜞菊生物量的分配策略。此外,添加AMF可以显著提高低磷处理下南美蟛蜞菊体内的茉莉酸、赤霉素含量,对南美蟛蜞菊的生物量分配策略进行调控,从而促进植物生长。这些发现可以部分解释南美蟛蜞菊在营养贫瘠的环境中依旧能够快速生长的原因,同时也表明,AMF在外来植物入侵中发挥着重要作用。本研究还发现,在低磷处理下的GV在南美蟛蜞菊根部的定殖率显著高于正常营养处理。在资源丰富的环境中,丛枝菌根真菌的定殖率和生物量往往会下降[16,28],这是因为植物通过根部的吸收作用就能满足本身的需求,而在低营养环境中则需要与AMF相互合作,在结合部位投入更多的能量,通过遍布根部的菌丝来捕获有限的资源[11],如磷元素等[12]。
自然环境中的资源分布是不均匀的,当植物受到低营养胁迫时,会通过调整根系生长趋势,如改变资源分配策略来应对逆生境[29]。最优分配理论(optimal allocation theory)指出,植物应当分配资源来增强对稀缺资源的获取能力[30]。本研究结果显示,在低磷环境下添加GV,可以显著提高地下生物量,从而显著提高南美蟛蜞菊的根冠比;然而添加GV后,低磷处理下南美蟛蜞菊的根长显著缩短。研究结果表明,GV极有可能通过增加根的数量而非根长来提高根的有效吸收面积、扩大根对磷营养的“觅食”范围、增强对稀缺资源的获取,从而提升南美蟛蜞菊应对低磷环境胁迫下的资源分配调节能力。植物激素是植物自身产生的微量高效、能调节自身生理生化功能的有机物。茉莉酸、赤霉素是2种广泛存在于植物体内的、能有促进植物生长发育的植物激素。茉莉酸可以影响植物的新陈代谢,主要参与种子萌发[31]、植物生长[32]和病虫抗逆性形成[33]等植物生理过程。研究表明,茉莉酸可以帮助入侵植物躲避食草动物,从而促进植物入侵[34]。赤霉素能够调节植物生长并影响植物发育[35]。内源赤霉素含量与入侵植物南美蟛蜞菊的茎长、不定根长度呈正相关,因此加快了入侵植物的生长并提升了其入侵竞争力[36]。本研究发现,在低磷处理下,GV可以显著提高叶片中的茉莉酸、赤霉素含量,说明在低磷环境中,AMF极有可能通过增加植物体内的激素含量来促进南美蟛蜞菊的生长。
已有研究发现,AMF可以诱导独脚金内酯的合成,进而提高植物的抗旱能力[37];AMF也可调节植物体内的激素含量,从而使植物应对环境变化引起的根部压力损伤[38]。此外,AMF可以刺激植物内源生长素的增加、改善盐胁迫下营养的获取等[39]。因此可见,AMF可以通过调节植物激素表达网络的方式来调节植物应对环境胁迫的方式。本研究发现,AMF可以增加植物体内的赤霉素、茉莉酸水平,从而优化南美蟛蜞菊的资源分配策略、调节根的发育以应对低磷胁迫,最终实现在低磷环境中的快速生长。未来可以从如何破除AMF与南美蟛蜞菊的共生关系入手,进一步研究相应的方法,以实现对南美蟛蜞菊的防治。
參考文献:
[1]Pimentel D,McNair S,Janecka J,et al. Economic and environmental threats of alien plant,animal,and microbe invasions[J]. Agriculture Ecosystems & Environment,2001,84(1):1-20.
[2]Blossey B,Notzold R. Evolution of increased competitive ability in invasive nonindigenous plants:a hypothesis[J]. The Journal of Ecology,1995,83(5):887-889.
[3]Callaway R M,Aschehoug E T. Invasive plants versus their new and old neighbors:a mechanism for exotic invasion[J]. Science,2000,290(5491):521-523.
[4]Eppinga M B,Rietkerk M,Dekker S C,et al. Accumulation of local pathogens:a new hypothesis to explain exotic plant invasions[J]. Oikos,2006,114(1):168-176.
[5]Keane R M,Crawley M J. Exotic plant invasions and the enemy release hypothesis[J]. Trends in Ecology & Evolution,2002,17(4):164-170.
[6]Funk J L,Vitousek P M. Resource-use efficiency and plant invasion in low-resource systems[J]. Nature,2007,446(7139):1079-1081.
[7]Liao C Z,Luo Y Q,Jiang L F,et al. Invasion of Spartina alterniflora enhanced ecosystem carbon and nitrogen stocks in the Yangtze Estuary,China[J]. Ecosystems,2007,10(8):1351-1361.
[8]Wang C Y,Jiang K,Zhou J W,et al. Solidago canadensis invasion affects soil N-fixing bacterial communities in heterogeneous landscapes in urban ecosystems in East China[J]. Science of the Total Environment,2018,631/632:702-713.
[9]Verzeaux J,Hirel B,Dubois F,et al. Agricultural practices to improve nitrogen use efficiency through the use of arbuscular mycorrhizae:basic and agronomic aspects[J]. Plant Science,2017,264:48-56.
[10]Vangelisti A,Natali L,Bernardi R,et al. Transcriptome changes induced by arbuscular mycorrhizal fungi in sunflower (Helianthus annuus L.) roots[J]. Scientific Reports,2018,8:4.
[11]Turrini A,Bedini A,Loor M B,et al. Local diversity of native arbuscular mycorrhizal symbionts differentially affects growth and nutrition of three crop plant species[J]. Biology and Fertility of Soils,2018,54(2):203-217.
[12]Battini F,Grnlund M,Agnolucci M,et al. Facilitation of phosphorus uptake in maize plants by mycorrhizosphere bacteria[J]. Scientific Reports,2017,7(1):4686.
[13]Pepe A,Sbrana C,Ferrol N,et al. An in vivo whole-plant experimental system for the analysis of gene expression in extraradical mycorrhizal mycelium[J]. Mycorrhiza,2017,27(7):659-668.
[14]Smith S E,Read D J. Mycorrhizal symbiosis[M]. 2nd ed. London:Academic Press,1997.
[15]Liu H,Song F B,Liu S Q,et al. Arbuscular mycorrhiza improves nitrogen use efficiency in soybean grown under partial root-zone drying irrigation[J]. Archives of Agronomy and Soil Science,2019,65(2):269-279.
[16]Jeske E S,Tian H,Hanford K,et al. Long-term nitrogen fertilization reduces extraradical biomass of arbuscular mycorrhizae in a maize (Zea mays L.) cropping system[J]. Agriculture Ecosystems & Environment,2018,255:111-118.
[17]Vilma C M,Javier V,Silvia W,et al. Root colonisation by the arbuscular mycorrhizal fungus Glomus intraradices alters the quality of strawberry fruits (Fragaria×ananassa Duch.) at different nitrogen levels[J]. Journal of the Science of Food and Agriculture,2010,90(11):1774-1782.
[18]Awaydul A,Zhu W Y,Yuan Y G,et al. Common mycorrhizal networks influence the distribution of mineral nutrients between an invasive plant,Solidago canadensis,and a native plant,Kummerowa striata[J]. Mycorrhiza,2019,29(1):29-38.
[19]Zhang F J,Li Q,Yerger E H,et al. AM fungi facilitate the competitive growth of two invasive plant species,Ambrosia artemisiifolia and Bidens pilosa[J]. Mycorrhiza,2018,28(8):703-715.
[20]Qi S S,Dai Z C,Miao S L,et al. Light limitation and litter of an invasive clonal plant,Wedelia trilobata,inhibit its seedling recruitment[J]. Annals of Botany,2014,114(2):425-433.
[21]Qin Z,Zhang J E,Ditommaso A,et al. Predicting invasions of Wedelia trilobata (L.) Hitchc. with Maxent and GARP models[J]. Journal of Plant Research,2015,128:763-775.
[22]Qi S S,Dai Z C,Zhai D L,et al. Curvilinear effects of invasive plants on plant diversity:plant community invaded by Sphagneticola trilobata[J]. PLoS One,2014,9(11):e113964.
[23]Si C C,Dai Z C,Lin Y,et al. Local adaptation and phenotypic plasticity both occurred in Wedelia trilobata invasion across a tropical island[J]. Biological Invasions,2014,16(11):2323-2337.
[24]Dai Z C,Qi S S,Miao S L,et al. Isolation of NBS-LRR RGAs from invasive Wedelia trilobata and the calculation of evolutionary rates to understand bioinvasion from a molecular evolution perspective[J]. Biochemical Systematics and Ecology,2015,61:19-27.
[25]Dai Z C,Wang X Y,Qi S S,et al. Effects of leaf litter on inter-specific competitive ability of the invasive plant Wedelia trilobata[J]. Ecological Research,2016,31(3):367-374.
[26]Phillips J M,Hayman D S. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection[J]. Transactions of the British Mycological Society,1970,55(1):158-161.
[27]赫冬梅,胡國公,穆 琳. 烟草内源激素的酶联免疫吸附法(ELISA)测定[J]. 烟草科技,2000(5):41-42.
[28]Johnson N C,Rowland D L,Corkidi L,et al. Nitrogen enrichment alters mycorrhizal allocation at five mesic to semiarid grasslands[J]. Ecology,2003,84(7):1895-1908.
[29]Karban R. Plant behaviour and communication[J]. Ecology Letters,2008,11(7):727-739.
[30]Ericsson T. Growth and shoot:root ratio of seedlings in relation to nutrient availability[J]. Plant & Soil,1995,168:205-214.
[31]Ran J R,Lewak S. Interaction of jasmonic and abscisic acid in the control of lipases and proteases in germinating apple embryos[J]. Physiologia Plantarum,1995,93(3):421-426.
[32]Wasternack C,Hause B. Jasmonates:biosynthesis,perception,signal transduction and action in plant stress response,growth and development. An update to the 2007 review in Annals of Botany[J]. Annals of Botany,2013,111(6):1021-1058.
[33]Liu Y Y,Du M M,Deng L,et al. MYC2 regulates the termination of jasmonate signaling via an autoregulatory negative feedback loop[J]. Plant Cell,2019,31:106-127.
[34]Cipollini D,Lieurance D M. Expression and costs of induced defense traits in Alliaria petiolata,a widespread invasive plant[J]. Basic and Applied Ecology,2012,13(5):432-440.
[35]Peng J R,Harberd N P. The role of GA-mediated signalling in the control of seed germination[J]. Current Opinion in Plant Biology,2002,5(5):376-381.
[36]Dai Z C,Fu W,Qi S S,et al. Different responses of an invasive clonal plant Wedelia trilobata and its native congener to gibberellin:implications for biological invasion[J]. Journal of Chemical Ecology,2016,42(2):85-94.
[37]Ruiz-Lozano J M,Aroca R,ZamarreoM,et al. Arbuscular mycorrhizal symbiosis induces strigolactone biosynthesis under drought and improves drought tolerance in lettuce and tomato[J]. Plant Cell and Environment,2016,39(2):441-452.
[38]Bi Y L,Zhang J,Song Z H,et al. Arbuscular mycorrhizal fungi alleviate root damage stress induced by simulated coal mining subsidence ground fissures[J]. Science of The Total Environment,2019,652(20):398-405.
[39]Hashem A,Abd-Allah E F,Alqarawi A A,et al. Comparing symbiotic performance and physiological responses of two soybean cultivars to arbuscular mycorrhizal fungi under salt stress[J]. Saudi Journal of Biological Sciences,2019,26(1):38-48.
