冷冻切片后甲醛固定石蜡包埋组织DNA质量分析
2020-06-01蒙秋萍
郑 晶,蒙秋萍,翁 阳
在病理科日常工作中,为协助外科医师及时确定手术范围并做出相应的处理,病理医师有时需要在手术过程中做出快速诊断,尤其是肿瘤的良、恶性诊断,快速冷冻切片是应用最广泛的方法。该方法通常是在手术过程中切取部分病变组织,用冷冻切片技术制片后用以病理诊断。冷冻切片后组织经甲醛固定制成蜡块,并切片及HE染色,以便与术中冷冻切片比较,来验证冷冻切片结果的准确性;若送检标本较多,未经冷冻切片的送检组织也需固定后制成蜡块,并进行切片及HE染色,以便进一步明确诊断,必要时进行用于指导用药及预后判断的分子病理学检测。但有时病变组织少或送检组织有限,为确保术中快速冷冻病理诊断的准确性,需将全部组织进行冷冻切片。这样就只剩下冷冻切片后冻融组织而缺乏常规石蜡包埋组织来进行分子病理学诊断。冷冻切片后冻融组织再行固定及包埋对形态及蛋白水平检测的负面影响已被广泛认同[1-3]。但冻融后再行固定及包埋对组织DNA水平的影响却鲜有报道。因此,本文以肺腺癌组织为代表,分析冷冻切片后甲醛固定石蜡包埋组织DNA质量,以探讨其在分子病理检测中的应用价值。
1 材料与方法
1.1 材料收集海南医学院第一附属医院病理科2017年12月~2018年5月确诊为“肺腺癌”且经术中快速冷冻病理诊断14例组织标本,同一病例包含2个组织蜡块:一个为冷冻切片后冻融组织再行固定及包埋蜡块,另一个为送检剩余病变组织(未经冷冻切片)常规固定及包埋蜡块。
1.2 试剂QIAamp DNAFFPE Tissue Kit DNA提取试剂盒(QIAGEN公司)及Amoy Dx人类EGFR基因21种突变检测试剂盒(厦门艾德公司)。
1.3 方法
1.3.1DNA提取 依据HE切片上肿瘤细胞的分布,在蜡块表面勾勒出肿瘤细胞集中区域,并用刀片在该区域内将组织块修成大小1.0 cm×1.0 cm,每个蜡块切4片,每片厚度为5 μm,以保证用于提取DNA的组织大小基本一致。DNA提取操作步骤严格按照试剂盒说明书进行。
1.3.2DNA浓度和纯度检测 NanoDrop 2000型全波长超微量分光光度计测量提取DNA浓度及OD260/OD280比值。
1.3.3DNA完整性检测 以提取DNA为模版,行多重PCR反应。参照Biomed-2系统,设置4个内参目的基因,分别为TBXAS1(外显子9;GenBank登录号D34621)、RAG1(外显子2;GenBank登录号M29474)、PLZF(外显子1;GenBank登录号AF060568)和AF4基因(外显子3,GenBank登录号Z83679),大小分别为100、200、300及400 bp。引物序列分别为:TBXAS1:上游5′-GCCCGACATTCTGCAAGTCC-3′,下游5′-GGTGTTGCCGGGAAGGGTT-3′;RAG1:上游5′-TGTTGAC GCTATCCACCCCA-3′,下游5′-TGAGCTGCAAGTTTGGCTGA A-3′;PLZF:上游5′-TGCGATGTGGTCATCATGGTG-3′,下游5′-CGTGTCATTGTCGTCTGAGGC-3′;AF4:上游5′-CCGCAG CAAGCAACGAACC-3′,下游5′-GCTTTCCTCTGGCGGCTCC-3′。将引物混合,行多重PCR反应,条件为:95 ℃预变性7 min,95 ℃变性45 s,退火60 ℃ 45 s,延伸72 ℃ 90 s;扩增40个循环,最后72 ℃ 10 min。PCR扩增产物行聚丙烯酰胺垂直电泳,凝胶成像系统中观察电泳结果。
1.3.4ARMS法 采用ARMS法对EGFR基因突变进行检测。提取DNA产物为模板,DNA稀释浓度为1.2~1.5 ng/μL;EGFR基因突变21位点,包括18、19、20及21外显子,位点包含除了含有13种Ex19DeL以及Ex21-L858R、Ex20-T790M、Ex20-ins、3种Ex18-G719X(G719A、G719S、G719C)、Ex20-S768I及Ex21-L861Q,21种突变。突变探针由FAM信号指示,内控由VIC信号指示,外控管由FAM信号指示。内控和外控选择的检测区域是人类EGFR基因相对保守区段,约100 bp,用于监控检测样本DNA质量和PCR反应过程。实验设阴、阳性对照。EGFR的PCR反应程序:95 ℃ 5 min,1个循环;95 ℃ 25 s,64 ℃ 20 s,72 ℃ 20 s,15个循环;93 ℃ 25 s,64 ℃ 35 s(采集荧光),72 ℃ 20 s,31个循环。基因突变结果判定:严格按照试剂盒说明书提供检验结果解释进行。
1.4 统计学分析应用SPSS 17.0软件进行统计学分析,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 DNA浓度及OD260/OD280比值冷冻切片后固定包埋组织和常规包埋组织两组DNA浓度均数差异有统计学意义(t=4.76,P<0.001),前者DNA浓度低于后者,均数分别为157.33 ng/μL和349.97 ng/μL。两组DNA提取物OD260/OD280比值均数的差异亦有统计学意义(t=3.69,P=0.001),常规包埋组织DNA提取物OD260/OD280比值高于冻融后包埋组织,均数分别为2.02和1.96(表1)。

表1 冷冻切片后固定包埋组织和常规固定包埋组织DNA浓度及OD260/OD280比值
2.2 DNA完整性结果14例常规固定包埋组织提取的DNA均具有>300 bp的PCR产物,并且其中有10例具有>400 bp的PCR产物,且目标条带均较清晰。14例冷冻切片后固定包埋组织提取的DNA(图1)具有>300 bp PCR产物者有11例,仅有5例获得>400 bp的PCR产物(第4、6、13、14、15泳道,部分目的条带较弱),所有冷冻切片后包埋组织DNA均具有>200 bp的PCR产物。
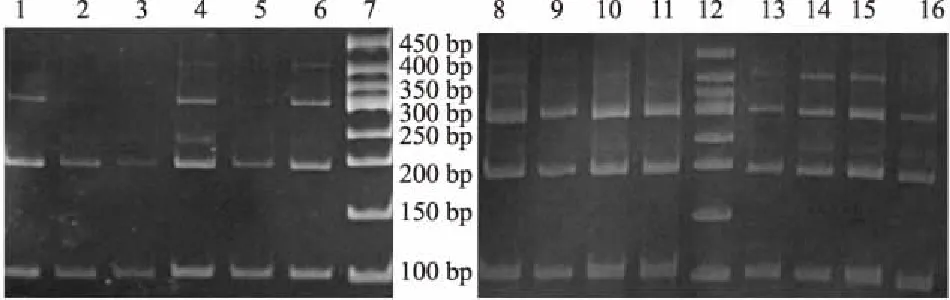
图1 冷冻切片后冰对组织DNA内参基因PCR产物电泳结果(7、12为50 bp Marker)
2.3 EGFR突变检测结果14例肺腺癌组织中有7例检测出EGFR突变,其中21号外显子的L858R突变4例,21号外显子的L861Q突变1例,19号外显子的缺失突变2例。冷冻切片后包埋组织与常规包埋组织EGFR突变检测结果完全相同,且两组内控、外控信号均正常。
3 讨论
石蜡包埋组织作为一种最为方便且保存最为长久的临床检测标本,是分子病理研究的主要信息来源。在病理科日常工作中,术中快速冷冻病理诊断是不可或缺的一部分。有时术中冷冻送检病变组织少或有限,为确保冷冻诊断的准确性,需将全部送检病变组织进行冷冻切片。这样就只剩下冷冻切片冻融后组织而缺乏常规石蜡包埋组织来进行进一步的病理学诊断及分子病理学检测。高质量的DNA是分子病理诊断顺利开展的基础。DNA的质量评价一般从三个方面进行,包括DNA浓度、纯度以及DNA的完整性[4-5]。研究表明,新鲜冷冻组织DNA质量在以上三个方面均优于甲醛固定石蜡包埋组织[6]。那么冷冻切片后再行固定、包埋组织中提取的DNA质量如何,其浓度、纯度以及DNA的完整性与常规固定包埋组织的DNA相比,是否存在差异,能否用来进行分子病理学检测呢?
本组实验结果表明,与常规固定包埋组织相比,冷冻切片后再行固定及包埋冰对组织中提取的DNA浓度明显下降,DNA完整性亦不及常规固定包埋组织,DNA片段化更为严重。由于冰对组织前期处理中有迅速冷冻及较快冻融的过程,后续处理过程与冰剩组织无异。因此笔者推测冷冻处理会对组织DNA质量产生一定的影响。有研究表明,冷冻处理会对细胞以及细胞核酸成分产生损伤。损伤机制包括:(1)冷冻过程可导致产生的高浓度活性氧成分(reactive oxidative species, ROS)增加,使细胞处于氧化应激状态,造成细胞DNA完整性破坏[7-8];(2)在快速冷冻降温过程中,细胞内部的水分来不及外渗,就会出现细胞内冰晶,甚至核内冰晶。冰晶与细胞膜、细胞器及细胞内各种成分的破坏有着很大的关系,且冰晶相对于脱水,其对细胞的损伤是致命的。核内冰晶的形成亦会对核酸结构造成破坏[9];(3)冷冻后冻融过程中,温度剧烈变化可引起细胞化学结构不同程度的改变,能量代谢紊乱,DNA链的完整性遭到破坏等[10];这些研究结果也一定程度上证实了笔者的推测,冷冻及冻融处理的确会对组织DNA造成一定程度的损伤。并且笔者认为,冻融过程使得细胞膜结构不稳定,会产生更多游离的蛋白与核酸,在福尔马林固定过程中,会产生更多的蛋白核酸交联,使得DNA的片段化更为严重。
从实验结果中亦发现,冷冻切片后包埋组织DNA提取物OD260/OD280比值低于常规包埋组织。目前常用的核算提取方法均会使产物中夹杂一些其它的分子,如蛋白、小分子化合物等,这些物质可能会对后续的检测产生影响。检测核酸纯度最常用的方法是利用分光光度计测定紫外吸光度。DNA的紫外吸收峰值在260 nm处,而蛋白质为280 nm。因此蛋白质含量高可导致OD260/OD280比值降低。本实验中冷冻切片后组织DNA提取物OD260/OD280比值低于常规包埋组织,分析原因:冻融过程使得细胞膜结构不稳定,会产生更多游离的蛋白质与核酸,在福尔马林固定过程中,会产生更多的蛋白核酸交联,继而会降低蛋白酶的消化效率。因此冻融后固定组织核酸提取物中蛋白质污染比常规固定组织更为严重。
冻融后再行固定包埋冰对组织中提取的DNA能否用于分子病理学检测呢?本实验结果表明,虽然冷冻切片后固定包埋组织DNA的浓度及DNA完整性均稍劣于常规固定包埋组织的DNA。但DNA的浓度平均值为157.33 ng/μL,仍然属于较高浓度的DNA水平;OD260/OD280比值均值为1.96,同样为纯度较好的DNA样本;不同的检测方法或检测试剂盒对被检查样本的DNA浓度要求不尽相同。常见的ARMS法对样本DNA的起始浓度范围1~3 ng/μL,荧光PCR法的范围20~30 ng/μL,Sanger测序的范围约60 ng/μL,高通量测序中Ion Torrent检测平台的范围2~5 ng/μL,ILLumia检测平台的范围10~60 ng/μL[5]。因此,从DNA浓度分析,冷冻切片后再行固定包埋冰对组织中提取的DNA适用于目前常用的分子病理检测平台。完整性方面,所有标本均能获得200 bp的PCR产物,且大部分标本能获得300 bp的PCR产物,甚至部分获得400 bp的PCR产物。因此冻融后组织DNA片段亦能满足ARMS法及大多数测序检测平台。本实验中ARMS法检测冷冻切片后包埋组织与常规包埋组织EGFR突变检测结果完全相同,且内控、外控均正常。在实际应用中亦证实冻融后固定包埋组织的DNA,可以满足常规分子病理检测要求。
