神经血管单元多靶点抗缺血性脑卒中的相关靶标及通路研究
2020-06-01黄清梁萍2欧阳扬2刘蕾2杨鎏鑫2刘佩2刘玥彤2蒙兰青
黄清,梁萍2,欧阳扬2,刘蕾2,杨鎏鑫2,刘佩2,刘玥彤2,蒙兰青
(1.右江民族医学院附属医院,广西 百色 533000;2.右江民族医学院研究生学院,广西 百色 533000)
缺血性脑卒中是受到遗传和环境因素影响的系统性疾病,发生的分子机制是多基因、多功能蛋白相互作用的调控网络异常所致。氧/糖剥夺(OGD)细胞模型能够模拟脑卒中的病理状态,常用于模拟缺血性脑卒中的体外实验[1]。神经血管单元(NVU)将脑卒中的组织关联反应视为一个整体,体现为神经元、神经胶质细胞和微血管之间相联系及相互影响[2]。基因表达量的改变是缺血性脑卒中的重要特征,它的改变也伴随着对多种蛋白质功能的影响[3]。筛选缺血性脑卒中神经血管单元的差异表达基因,对探索缺血性卒中早期诊断的生物学标志物、发病机制和发现药物靶标等都有重要的意义。本研究基于神经血管单元的主要组成成分,整合缺血性脑卒中体外模型的神经元、星形胶质细胞和血管(血管内皮细胞、周细胞)芯片数据集的差异表达基因,并对各组成成分构建PPI互作网络、功能注释及通路分析等,为多靶点治疗缺血性脑卒中提供新的理论基础。
1 材料与方法
1.1 神经血管单元GEO芯片来源 GEO数据库[4]中的GSE54037、GSE3045、GSE76739和GSE109233的芯片数据(见表1)。GSE54037[5]由葡萄牙神经科学与细胞生物学中心提供,该研究利用全基因组测序鉴定大鼠海马神经元在缺氧缺糖(OGD)中的表达差异基因,实验分有对照组和OGD组(n=6),每组分别在7 h和24 h(n=3)检测大鼠海马神经元的基因表达。GSE3045[6]是美国哥伦比亚大学对比星形胶质细胞在正常氧和缺氧状态下的基因差异研究(n=3)。GSE76739[7]是意大利Fabio Martelli等人对血管内皮细胞在暴露于常氧(n=2)、缺氧(n=4)条件下,分别于24 h和48 h研究的转录组学变化。在生理或缺血条件下,脑周细胞对于维持神经血管单元的完整性起到重要的作用,瑞士隆德大学评估了体外培养的人脑周细胞在缺氧和/或葡萄糖剥夺后的转录反应,在芯片GSE109233[8]中将选取常氧伴葡萄糖组和缺氧无葡萄糖组作为本次差异分析。
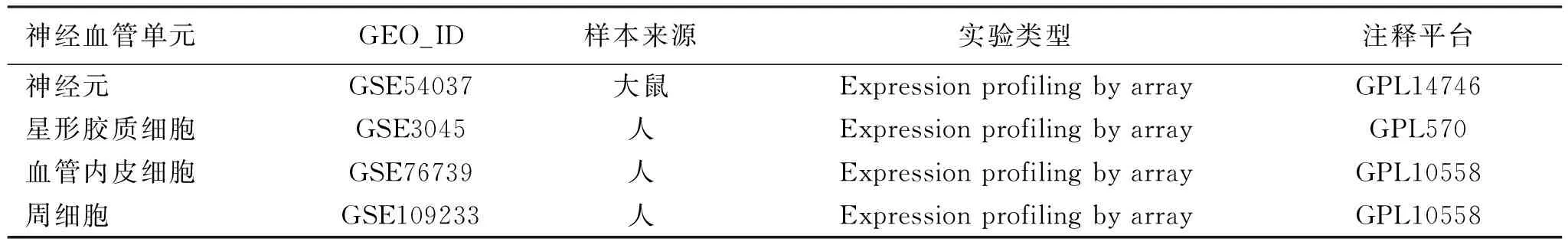
表1 神经血管单元各组成成分的芯片基本信息
1.2 表达谱数据差异基因的筛选 GEO2R是GEO数据库自带的在线分析工具,它是运用基于R编程语言的开源软件Bioconductor的Biobase 2.30,GEOquery 2.40和limma 3.26.8 软件包对原始序列矩阵数据文件中的两组或多组样本进行分析,得出显著性的差异表达基因。我们利用GEO2R工具分别对GSE54037、GSE3045、GSE76739和GSE109233中的各组数据进行分析。
1.3 缺血性脑卒中背景文库的建立 为了使上述芯片筛选出来的差异基因更具有缺血性脑卒中的属性,我们从GeneCards和OMIM人类基因数据库中以关键词“ischemic stroke” or “cerebral infarction” or “ischemic cerebrovascular disease”检索靶标,作为缺血性脑卒中的背景文库。
1.4 缺血性脑卒中神经血管单元候选靶标鉴定 用1.2中各芯片数据筛选的差异表达基因分别与缺血性脑卒中背景文库做韦恩图取交集,合并,再删除重复值,即为缺血性脑卒中神经血管单元的候选靶标。
1.5 候选靶标的功能注释和通路分析 为了更好地理解缺血性脑卒中神经血管单元发挥的生物学功能和参与的通路,我们使用OmicShare云平台来进行GO和KEGG分析。
1.6 构建候选靶标的蛋白质互作(PPI)网络 STRING[9]是一个涵盖5090个物种,通过基因组预测、高通量测序、保守/共表达和文献文本挖掘等途径,拥有24 584 628个蛋白质相互作用的数据库。为了研究缺血性脑卒中神经血管单元各组分之间的相互作用,我们将候选靶标批量导入STRING数据库,“Organism”选择“Homo sapiens”,蛋白互作置信度为0.7,隐藏网络中没有连接的节点,导出“TSV”格式的网络数据,用Cytoscape软件[10]中的cytoHubba插件[11]将整个网络节点通过Degree算法,筛选出关键基因。
2 结果
2.1 缺血性脑卒中背景文库 在GeneCards和OMIM数据库中分别检索到2266和279个缺血性脑卒中相关靶标,将2者合并,且删除重复值,最终得到2469个基因作为缺血性脑卒中的背景文库。
2.2 神经血管单元的差异表达基因 神经元GSE54037芯片按2个不同的观察时间点进行分组,根据p-value<0.05,|log(FC)|>1.2筛选得到差异表达基因,7 h组筛选到543个差异表达基因,上调239个,下调304个,24 h组有678个差异表达基因,上调145个,下调533个,分别绘制火山图(见图1A)。星形胶质细胞GSE3045芯片根据表达量,设定p-value<0.05,|log(FC)|>1.5筛选得到差异表达基因1367个,其中有部分为探针对应多个基因名,删除重复值,整理后得到1389个差异表达基因,其中上调1001个,下调388个,绘制火山图(见图1B)。血管内皮细胞GSE76739芯片根据表达量,设定p-value<0.05,|log(FC)|>1.2得到417个差异表达基因,其中上调222个,下调195个,绘制火山图(见图1C)。周细胞GSE109233芯片按2个不同的观察时间点进行分组,根据p-value<0.05,|log(FC)|>0.4筛选得到差异表达基因,2 h组筛选到156个差异表达基因,上调63个,下调93个,6 h组筛选到1292个差异表达基因,上调633个,下调659个,分别绘制火山图(见图1D)。
2.3 缺血性脑卒中神经血管单元候选基因鉴定 利用Venn工具分别对GSE54037、GSE3045、GSE76739和GSE109233芯片的差异表达基因与缺血性脑卒中背景基因进行交集分析,并绘制韦恩图(见图2)。将4个交集的基因进行整合,删除重复值,最终得到236个由神经元、星形胶质细胞、血管内皮细胞和周细胞基因芯片组成缺血性脑卒中神经血管单元的候选靶标(见表2)。
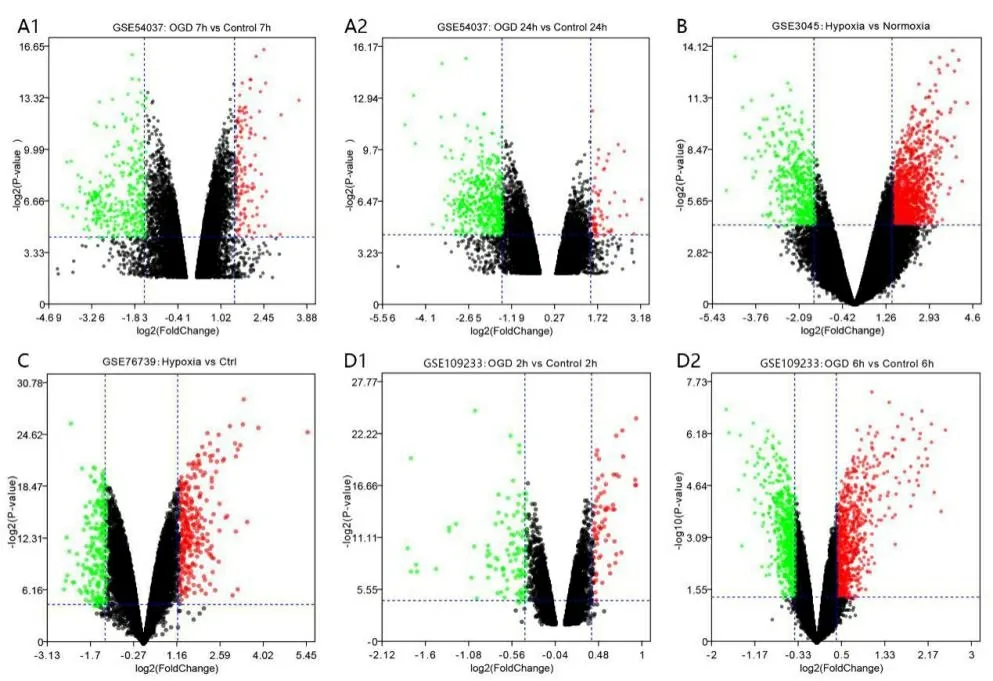
图1 神经血管单元的差异表达基因火山图
注:A为神经元GSE540377芯片(A1为7h组,A2为24h组);B为星形胶质细胞GSE3045芯片;C为血管内皮细胞GSE76739芯片;D为周细胞GSE109233芯片(D1为2h组,D2为6h组);上调为红色,下调为绿色
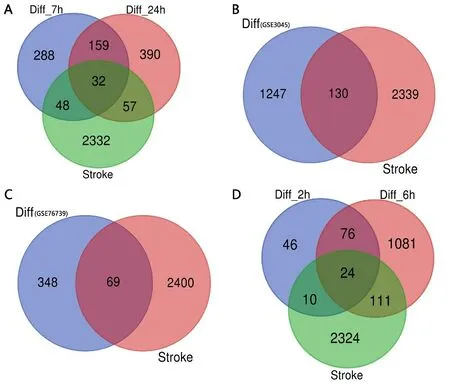
图2 神经血管单元差异表达基因与脑缺血背景基因韦恩图
注:A为神经元GSE540377芯片,B为星形胶质细胞GSE3045芯片,C为血管内皮细胞GSE76739芯片,D为周细胞GSE109233芯片

表2 缺血性脑卒中神经血管单元候选靶标列表
2.4 缺血性脑卒中神经血管单元候选靶标的功能注释和通路分析 为了更好地理解缺血性脑卒中神经血管单元发挥的生物学功能和参与的通路,我们使用OmicShare云平台来进行GO和KEGG分析。GO结果显示,显著性的生物学过程(Biological Process,BP)包括:免疫反应、细胞增殖、内皮细胞增殖、信号传导等;分子功能(Molecular Function,MF)包括:蛋白酶结合、血管内皮生长因子受体结合、钙离子结合、细胞因子活性、G蛋白偶联腺苷受体活性等;细胞组成(Cellular Component,CC)包括:神经元、血小板、细胞外基质、纤维蛋白原复合物等(见图3、表3)。KEGG结果显示,神经血管单元参与的通路有PI3K-Akt信号通路、HIF-1信号通路、补体与凝血级联、肿瘤坏死因子信号途径等(见图4、表4)。
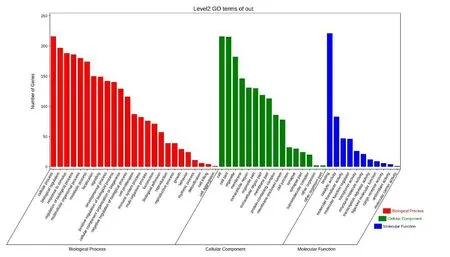
图3 缺血性脑卒中神经血管单元基因功能分析

表3 缺血性脑卒中神经血管单元前10位生物学过程
注:p-value列下的E为科学计数
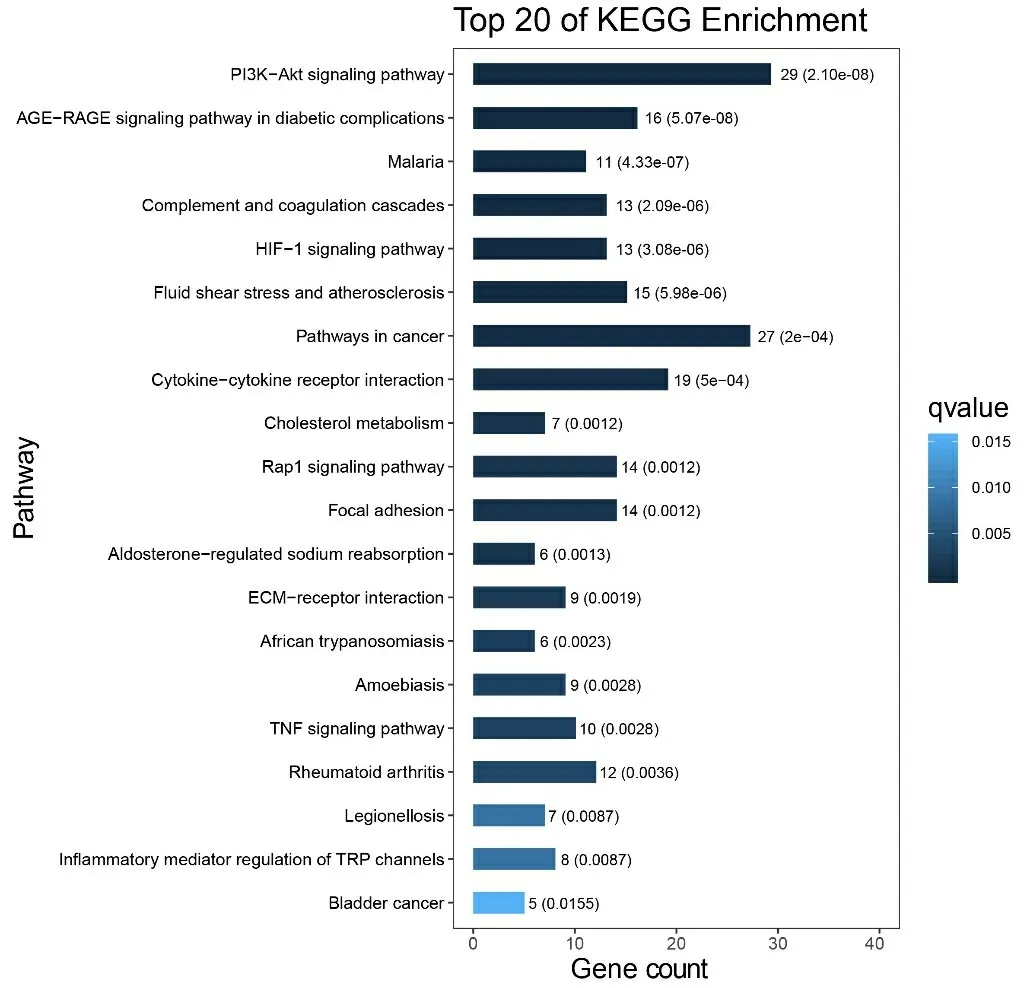
图4 缺血性脑卒中神经血管单元前20位KEGG通路柱状图
注:p-value列下的E为科学计数
2.5 缺血性脑卒中神经血管单元PPI分析 将236个候选基因批量导入STRING数据库,“Organism”选择“Homo sapiens”,蛋白互作置信度为0.7,隐藏网络中没有连接的节点,得到236个节点连接679条边,平均节点度:5.75,平均局部聚类系数:0.442,PPI富集p值:<1.0e-16的蛋白互作网络图(见图5A)。下载“TSV”格式的PPI数据,用Cytoscape软件中的cytoHubba插件将整个网络节点通过Degree算法,筛选出连接度最大的前20个靶标(VEGFA,IL6,CXCL8,SRC,IGF1,PLG,FGG,FGA,SERPINE1,CCL2,IL10,ITGB2,AHSG,SPP1,EDN1,ICAM1,TLR4,THBS1,CXCL1,MMP2),即为神经血管单元的枢纽靶标(见图5B、图5C)。STRING中的通路分析显示,显著富集的通路有PI3K-Akt信号通路、HIF-1信号通路、补体与凝血级联等(见表5)。这些靶标和通路可能是神经血管单元在缺血性脑卒中的病理过程中发挥重要作用。
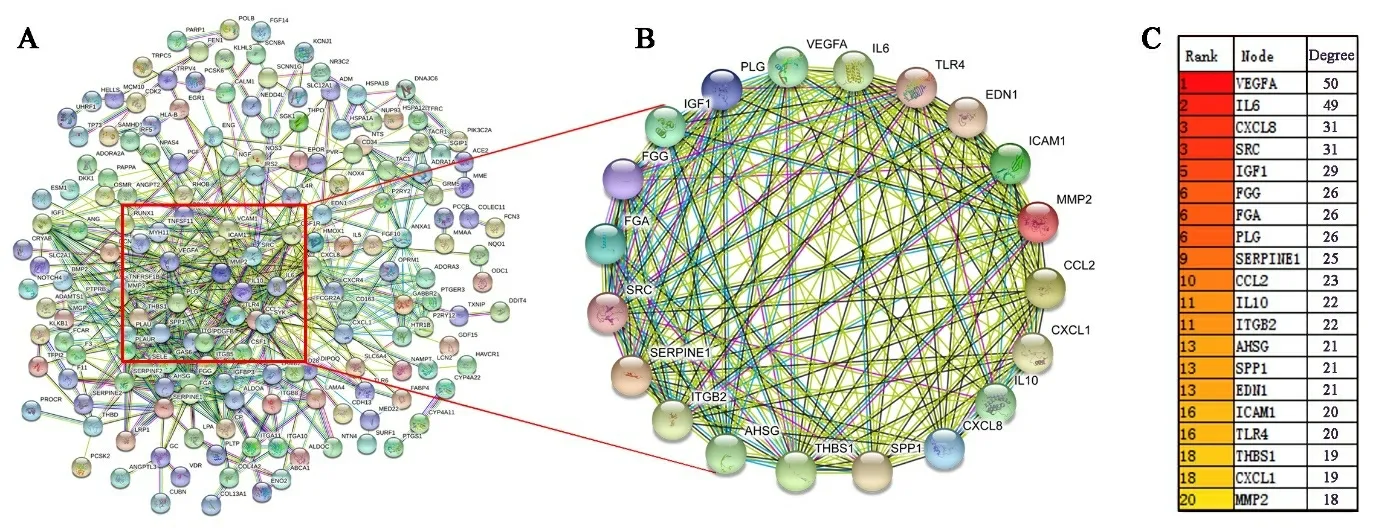
图5 神经血管单元候选靶标PPI网络
注:A为236个候选靶标的蛋白互作网络;B为由cytoHubba插件Degree算法得出的前20个连接度最大的靶标互作子网络;C为Degree排名方法
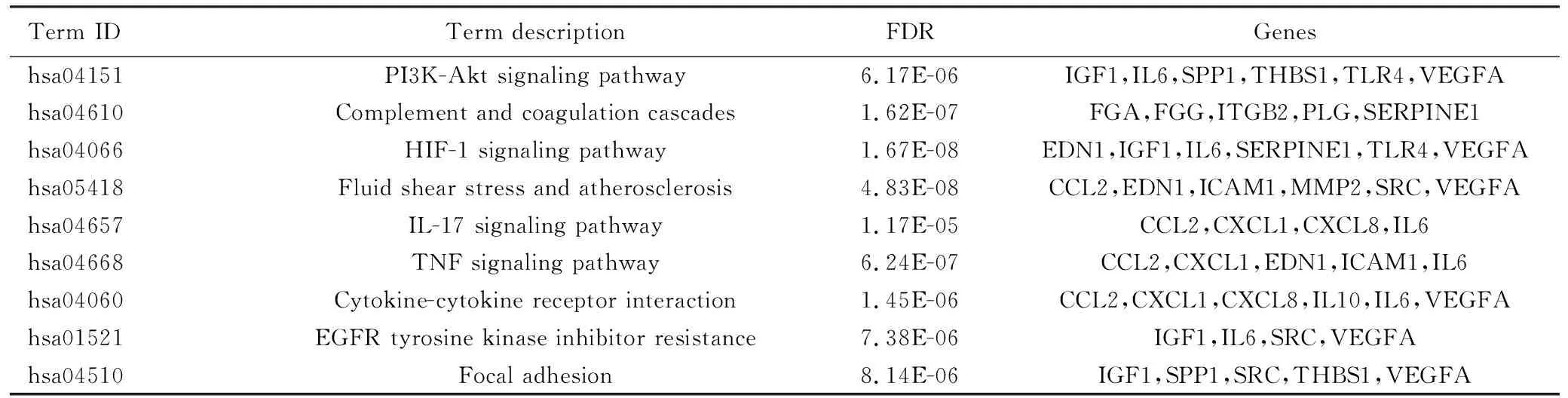
表5 神经血管单元20个枢纽靶标富集的部分信号通路
注:FDR列下的E为科学计数
3 讨论
20世纪80年代,人类基因组计划被提出,随着生物信息技术的飞速发展,基因芯片技术现已被广泛应用于发现疾病易感基因、分子诊断和靶向治疗等医学与生物学领域。脑卒中是全球死亡和致残的主要原因之一,缺血性脑卒中占脑卒中的70%~80%。缺血性脑卒中不仅对神经元造成损伤,神经胶质和血管成分也发生不同程度的损害。神经血管单元(NVU)作为缺血性脑卒中生物学标志物的来源[12],研究其各组成部分之间的功能关系和调控的信号通路具有重要意义。
本研究对神经血管单元的主要成分神经元、星形胶质细胞、血管内皮细胞和周细胞的基因表达谱芯片数据进行整合,得到236个缺血性脑卒中神经血管单元的靶标。GO分析结果显示,这些靶标参与的生物过程主要与炎症反应、血管生成、细胞增殖、免疫反应、信号传导等有关。KEGG显著富集的信号通路有PI3K-Akt信号通路、HIF-1信号通路、补体与凝血级联、细胞因子-细胞因子-受体相互作用通路等。通过Cytoscape软件对PPI网络进行拓扑分析,VEGFA、IL-6、CXCL8和SRC在整个网络的连接度均超过30,可见在缺血性脑卒中发挥重要作用。
VEGFA属于PDGF/VEGF家族的成员,是具有约120~190个编码氨基酸的同源二聚体糖蛋白[13]。其基因表达受缺氧刺激、细胞因子、性激素、趋化因子、生长因子等调节。低氧诱导因子1(HIF-1)是促进其表达的重要转录因子,激活HIF-1α/VEGF信号转导通路,可促进脑缺血再灌注损伤大鼠血管新生[14-15]。白细胞介素6(IL-6)是常见的炎性细胞因子,但在脑缺血中具有双重作用。在急性期,IL-6由神经元和小胶质细胞分泌作为炎症介质,但在亚急性期,由星形胶质细胞分泌,则可能参与神经营养和保护作用[16-17]。炎症趋化因子CXC配体8(CXCL8)又称白细胞介素8(IL-8),有研究表明,抑制CXCL8可以抑制炎症反应[18],而CXCL8基因沉默能激活PI3K-Akt信号通路[19],进而起到神经保护作用[20],有助于阐明中风的潜在分子机制。此外,SRC激酶(一种原癌性酪氨酸激酶)已被证实,通过NR2A亚基的直接磷酸化来增强NMDA受体功能,调节突触囊泡的谷氨酸释放,并激活钙通道[21-22]。因此,阻断SRC活性可能会降低NMDA的功能,并调节与缺血性卒中兴奋性毒性损伤相关的多种蛋白。
综上所述,本研究利用多个基因表达谱芯片鉴定了缺血性脑卒中神经血管单元的靶基因并进行生物学信息分析,发现在缺血性脑卒中,神经血管单元主要参与炎症反应、血管生成、细胞增殖、免疫反应、信号传导等生物过程,并调控PI3K-Akt信号通路、HIF-1信号通路、补体与凝血级联、细胞因子-细胞因子-受体相互作用通路等。我们着重分析了VEGFA、IL-6、CXCL8和SRC在缺血性脑卒中可能发挥作用的分子机制。这些神经血管的关键靶标和信号通路,可以为我们研究抗缺血性脑卒中靶向药物治疗提供一些新的思路。
