microRNA-155对重症急性胰腺炎大鼠急性肺损伤作用的研究
2020-06-01
(蚌埠医学院第一附属医院急诊外科,安徽 蚌埠 233000)
重症急性胰腺炎(severe acute pancreatitis,SAP)目前仍缺乏有效的特异性的治疗方法,治疗棘手,仍是死亡率高的疾病[1]。肺脏是重症急性胰腺炎最先受累的胰外器官,急性肺损伤(acute lung injury,ALI)是重症急性胰腺炎严重并发症之一,当合并有多脏器功能障碍时死亡率可达54%。microRNA-155(miRNA-155)是一类非编码RNA分子,与靶基因mRNA的碱基配对结合,在免疫调控中发挥重要作用[2],同时参与调控炎症因子,维持细胞生物学稳态。用miRNA-155抑制剂在大鼠中进行试验以明确是否能够通过阻断miRNA-155而减轻重症急性胰腺炎急性肺损伤的研究少见报道。我们通过建立SAP-ALI大鼠动物模型,观察重症急性胰腺炎时miRNA-155抑制组大鼠肺组织肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)蛋白、细胞间黏附分子(intercellular adhesion molecule,ICAM-1)蛋白的表达水平及肺组织病理和TNF-α等炎症因子变化,探讨miRNA-155及其抑制剂siRNA对重症急性胰腺炎大鼠急性肺脏损伤的影响,为探索重症急性胰腺炎急性肺损伤相关机制提供新依据。
1 材料与方法
1.1 实验动物与分组 成年雄性清洁级Sprague-Dawley(SD)大鼠27只,体重186~230 g,随机均分为:对照组(B1组)、重症急性胰腺炎组(B2组)和miRNA-155抑制组(B3组),每组各9只。
1.2 重症急性胰腺炎动物模型复制和处理 所有雄性清洁级SD大鼠术前均禁食12 h,可以饮水,手术部位备皮。采用异氟烷(上海雅培制药有限公司提供)吸入性麻醉对SD大鼠进行麻醉,碘伏常规消毒铺无菌巾,在无菌条件下行腹正中切口进腹。B1组SD大鼠进腹后仅仅翻动胰腺、十二指肠后随即缝合切口;B2组SD大鼠采取5%牛磺胆酸钠(0.1 ml/100 g)经胆胰管逆行缓慢匀速注入(0.1 ml/min)制作大鼠重症急性胰腺炎肺损伤动物模型;B3组大鼠在制作大鼠动物模型前24 h经尾静脉注射miRNA-155抑制剂siRNA (80 mg/kg,上海吉玛制药有限公司)。
1.3 标本采集与检测方法 分别于制作模型成功12 h后处死所有SD大鼠,经腹主动脉采血备用,一部分肺组织经液氮置入-80℃冰箱冷冻保存,用于检测肺组织TNF-α蛋白以及ICAM-I蛋白表达情况,另取一部分肺组织用于病理学检查。
1.3.1 各组SD大鼠血清淀粉酶水平测定 采用全自动生化分析仪测定各组SD大鼠血清淀粉酶水平。
1.3.2 各组SD大鼠血清中IL-1β、IL-6、TNF-α的检测 ELISA法测定各组大鼠血清中IL-1β、IL-6、TNF-α的含量。
1.3.3 各组SD大鼠肺组织病理学检查 ①测定各组大鼠肺组织ICAM-1蛋白和TNF-α蛋白表达情况(Western blot法)。②病理学检查:各组大鼠肺组织标本以10%甲醛溶液固定、石蜡包埋、苏木精-伊红染色,在光镜下观察,并按Schmidt等[3]对3组肺组织进行病理学评分。

2 结果
2.1 各组大鼠血清IL-1β、IL-6、TNF-α、淀粉酶水平和肺W/D比较 B2组、B3组IL-1β、IL-6、TNF-α、淀粉酶水平和肺W/D水平均高于B1组(P<0.01),而B2组高于B3组(P<0.01),见表1。
2.2 各组大鼠肺组织ICAM-1蛋白和TNF-α蛋白表达情况 B1组、B2组、B3组肺组织ICAM-1蛋白和TNF-α蛋白表达比较,差异有统计学意义(P<0.01),B2组、B3组较B1组升高(P<0.01),B3组较B2组降低(P<0.01)。见表2和图1。

表1 各组大鼠血清IL-1β、IL-6、TNF-α、淀粉酶水平和肺W/D比较

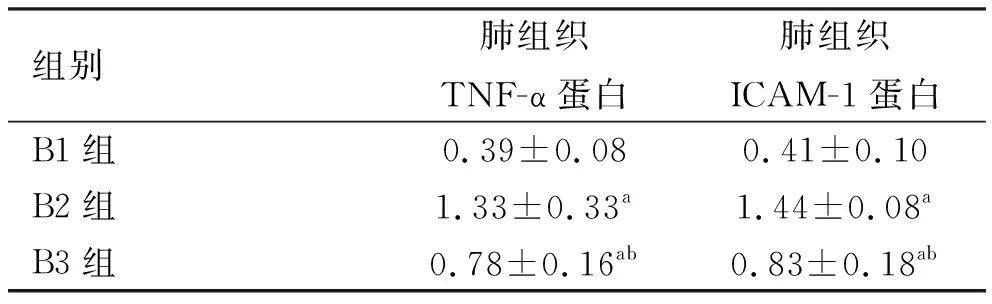
表2 各组大鼠TNF-α蛋白、ICAM-1蛋白表达情况

注:与B1组比较,a:P<0.01;与B2组比较,b:P<0.01
2.3 各组大鼠肺组织病理学变化 B2、B3组肺组织间质炎症细胞的浸润及纤维化,肺组织损伤较B1组重;B3组肺组织损伤较B2组减轻。见图2。 肺组织病理评分:B1组为(0.39±0.13)分,B2组为(7.98±1.26)分,B3组为(6.44±1.15)分;B1组、B2组、B3组肺组织病理评分比较,差异有统计学意义(P<0.01),B3组与B2组比较,B3组降低,B2组与B1组比较,B2组升高。
B1组 B2组 B3组
图2 光镜下各组大鼠肺组织病理学改变(HE ×400)
3 讨论
至今对重症急性胰腺炎发病机制尚不完全清楚,其临床疗效我们一直在不断的探索[4]。重症急性胰腺炎时会释放大量的炎症因子,如IL-1β、IL-6、TNF-α等在重症急性胰腺炎病程进展过程中发挥关键的作用,所引起的SIRS、多器官功能障碍综合征(MODS)是其死亡的重要因素。
TNF-α是重症急性胰腺炎病程中最早产生并起至关重要作用的炎症因子,在短期内快速升高,并诱导IL-1β、IL-6等细胞因子的产生,作用于血管内皮细胞,导致细胞出血、坏死、蛋白酶激活等。TNF-α可作为启动因子产生瀑布样级联放大效应,促使血小板活化因子、缓激肽、一氧化氮、氧自由基、IL-6等释放,这些强效介质相互影响形成高度偶联复杂的网络系统,这种失控性的级联效应在重症急性胰腺炎急性肺损伤中起重要作用,可导致肺组织细胞结构、功能的改变及细胞坏死、SIRS、急性呼吸窘迫综合征(ARDS)、MOF等。在炎症反应和组织损伤过程中TNF-α担当重要角色[5],ICAM-1 的表达受TNF-α调控,ICAM-1可与粒细胞的整合素相互作用,导致细胞损害,由肺组织炎症感染导致的ARDS病死率可达50%。研究发现淋巴细胞蛋白激酶R样内质网激酶表达水平的增加与重症急性胰腺炎大鼠淋巴细胞的凋亡相关,对重症急性胰腺炎淋巴细胞凋亡的起调节作用[6]。我们研究发现胸腺素α1对重症急性胰腺炎大鼠肺损伤具有一定的保护作用[7],因此,在重症急性胰腺炎急性肺损伤的治疗过程中逐渐重视抑制或降低炎症因子产生。对重症急性胰腺炎合并脓毒症病人采用参附注射液治疗可以减轻病人IL-10的过度表达,有较好的临床疗效[8]。
本项研究中B2组复制重症急性胰腺炎大鼠动物模型成功12 h后血清淀粉酶、IL-1β、IL-6、TNF-α较B1组和B3组明显升高,炎症因子大量释放并迁移至肺组织,对肺毛细血管以及肺泡上皮造成严重损伤,肺不张、肺水肿等,最终可导致ARDS、MOF等;同时由于中性粒细胞的活化,产生过多的活性氧等,导致肺组织和细胞的损害,加重肺损伤。本研究也发现B2组肺组织TNF-α蛋白、ICAM-1蛋白含量、病理评分较B1、B3组显著升高,病理学检查发现肺组织损伤重。
miRNA-155在炎症反应中扮演重要的角色[9-10],它参与多种病理炎症反应[11-12],与维持细胞生物学稳态,调控免疫与炎症介质紧密相关[13-14]。研究发现miRNA-155参与脑缺血/再灌注损伤,在大脑皮层中miRNA-155表达增加[15],抑制miRNA-155可以改变脑缺血后主要细胞因子的表达,影响炎症反应进展[16-17]。抑制miRNA-155可增加内皮一氧化氮合酶表达和一氧化氮产生从而减少炎症反应[18]。而miRNA-155抑制剂对重症急性胰腺炎急性肺损伤影响如何鲜见报道。本项研究通过采用miRNA-155抑制剂siRNA对重症急性胰腺炎大鼠急性肺损伤进行干预,结果发现,重症急性胰腺炎组(B2组)大鼠血清淀粉酶、IL-1β、IL-6、TNF-α、肺组织TNF-α蛋白、ICAM-1蛋白水平至复制模型成功后12 h明显升高,肺组织可见炎症细胞浸润、组织水肿等。使用miRNA-155抑制剂siRNA后干预组(B3组)大鼠血清淀粉酶、IL-1β、IL-6、TNF-α、肺组织TNF-α蛋白、ICAM-1蛋白、病理评分较B2组显著降低,肺组织损害较B2组减轻,说明miRNA-155抑制剂siRNA能够减少重症急性胰腺炎急性肺损伤大鼠炎症因子产生,能够减轻重症急性胰腺炎肺组织炎症反应,具有保护作用。本项研究通过血清学检查、蛋白水平分析miRNA-155抑制剂siRNA对重症急性胰腺炎大鼠肺损伤的影响,ICAM-1及 TNF-α等炎症介质的下调,肺组织损伤减轻。重症急性胰腺炎并发急性肺损伤是多种炎症介质共同参与复杂的动态过程[19],因此,尽早、有效地抑制这些炎症介质产生将有助于肺损伤的控制,其确切的作用机制尚需进一步研究。
