基于SEER数据库分析放疗对宫颈癌患者生存的影响
2020-06-01邢海洋张砚迪王可心
邢海洋,张砚迪,王可心
(中国医科大学附属盛京医院 放疗中心,辽宁 沈阳,110022)
宫颈癌是全球第3大常见癌症,也是女性癌症死亡的第4大原因[1]。在妇科癌症中,宫颈癌的发生率仅次于乳腺癌,位居第2位。发展中国家宫颈癌的发生率是发达国家的6倍,并且其中80%的患者确诊时已是浸润癌。近年来,宫颈癌发病有年轻化的趋势,并且以每年2%~3%的速度增长[2]。宫颈癌根治性放疗包括外照射、近距离放射治疗和顺铂联合化疗[3]。调强放疗(IMRT)具有降低胃肠道毒性的作用,可选择性地增加放疗剂量。个性化图像引导的近距离放射治疗能够更好地保证肿瘤扩展的目标靶区接受足够的照射剂量,同时还能使患者的正常组织受到更好的保护。强化伴随或顺序全身治疗目前正在评估中[4]。SEER数据库是美国癌症数据的主要来源,约覆盖美国人口总数的28%,包括人口统计数据、原发肿瘤部位、肿瘤形态学、分期、治疗及随访等资料[5]。Nomogram为Logistic回归或Cox回归的图形化表现,可用来预测个体患者的生存概率,具有较高的准确性及良好的临床实用性[6]。
1 材料与方法
1.1 数据来源
利用SEER Stat软件(8.3.5版本)搜索截至2016年确诊为宫颈癌的病例,并筛选符合纳入与排除标准的病例共10 920例。纳入标准:① 依据美国癌症联合会(AJCC)第7版分期指南标准,具有TNM分期;② 具有完整的随访数据。排除标准:① 放疗数据不详;② 随访数据不完整。
1.2 COX多因素分析
采用Cox回归分析评估不同变量对宫颈癌患者预后的影响,P<0.05为差异有统计学意义,而P<0.05的变量对于宫颈癌预后产生影响的相关性最高。
1.3 绘制列线图
基于多因素COX回归模型的基础上,使用R软件将可能影响宫颈癌预后的多个不同临床病理因素进行整合,实现预测模型可视化。
1.4 模型评价
使用一致性指数(C-index)、受试者工作特征(ROC)曲线及校准曲线指数作为模型评价指标,计算生存分析中COX模型预测值与真实值的区分度。
1.5 Kaplan-Meier生存分析
为探讨危险因素对宫颈癌预后的影响是否显著,对所有样本进行风险评估,将评估数据进行整理后再行Kaplan-Meier生存分析。分析过程中P<0.05的变量被认为与样本的生存时间显著相关。
2 结 果
2.1 COX多因素分析
Cox模型多因素分析结果显示,年龄、放疗、TNM分期均是影响宫颈癌患者总生存期的重要因素,其中≥60岁(P=0.001)、T4期(P=0.019)、N1期(P=0.001)、NX期(P=0.001)、M1期(P=0.001)、未接受放疗(P=0.001)的患者预后较差。见表1。
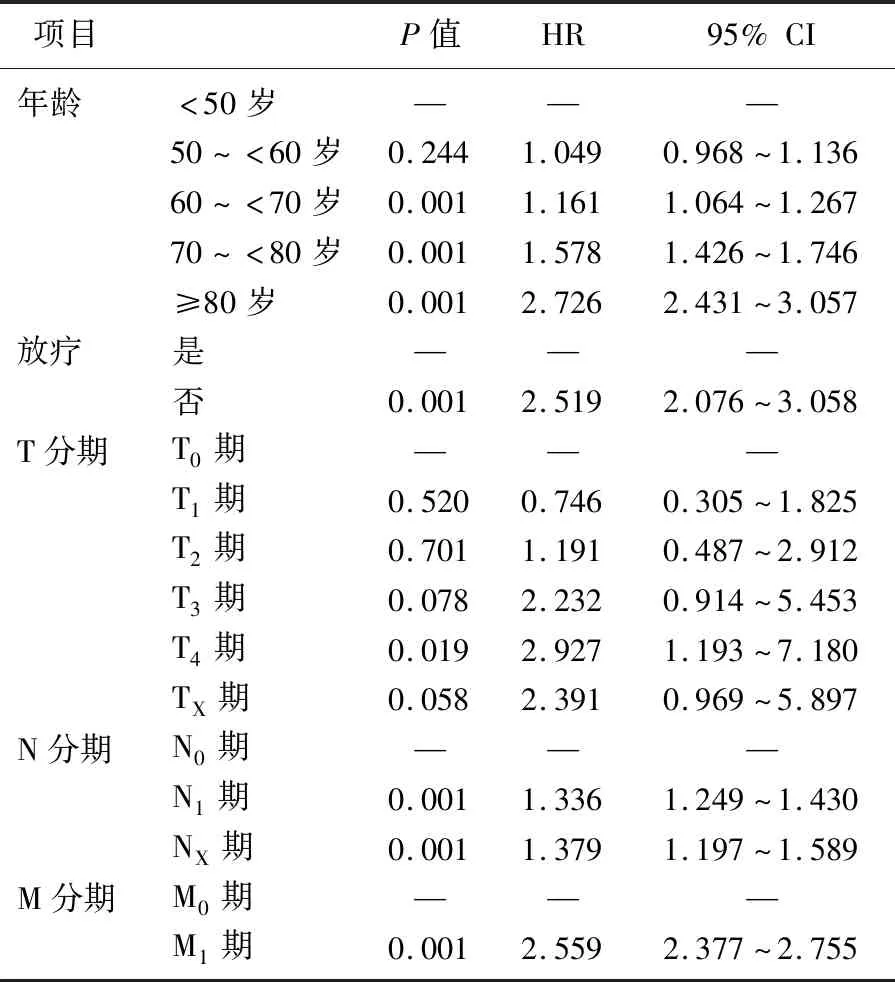
表1 宫颈癌患者总生存期Cox模型多因素分析
2.2 列线图
列线图是根据回归模型中各个影响因素对结局变量的贡献程度,对每个影响因素的每个取值水平进行赋值,然后再将各个评分相加得到总评分,最后通过总评分对3、5年生存期进行预测,年龄、放射治疗、TNM分期分别对应列线图变量得分,各个变量总分对应的变量总得分对应3、5年生存期。结果显示,年龄≥80岁、未接受放疗、肿瘤原发灶进展达到T3期、远处转移发展至M1期均可作为影响宫颈癌预后的独立危险因素。见图1。
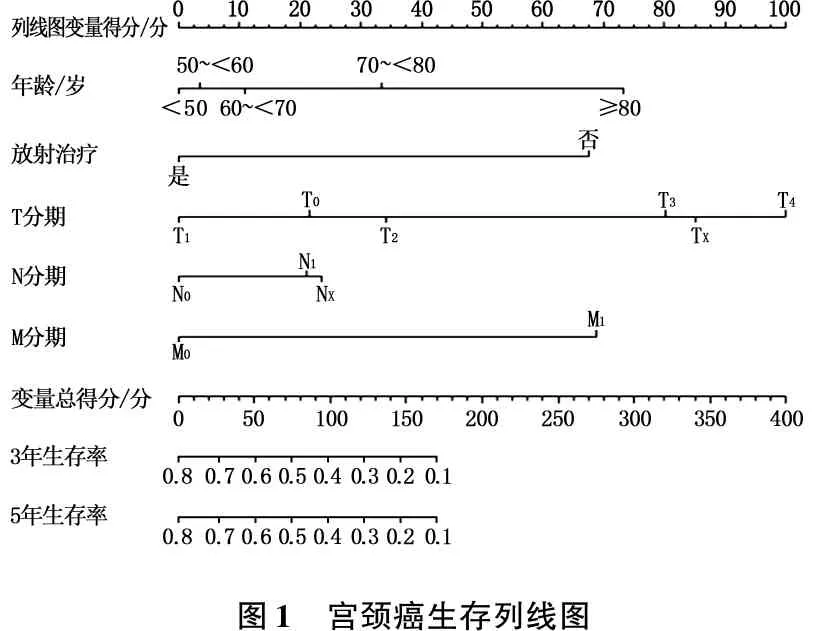
图1 宫颈癌生存列线图
2.3 模型评价
2.3.1 C-index:使用R软件计算得出C-index=0.745,标准误(SE)=0.004,表明预测模型具有中等准确度,预测结果可信。
2.3.2 ROC曲线:ROC曲线显示,3、5年的曲线下面积(AUC)分别为0.759、0.758,表明预测模型具有较好的敏感性和特异性。见图2、3。
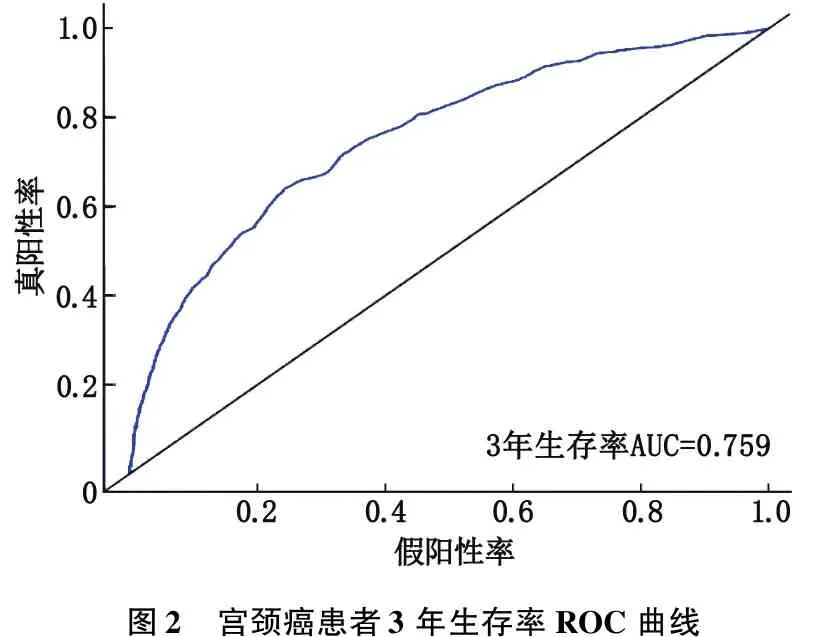
图2 宫颈癌患者3年生存率ROC曲线

图3 宫颈癌患者5年生存率ROC曲线
2.3.3 校准曲线:作者进一步绘制校准图评估建立的模型预测宫颈癌发生、发展的准确性,校准曲线横坐标0~1表示发生可能性是0%~100%。纵坐标表示实际概率,即患者实际疾病发生率。通过3、5年校准曲线的绘制,作者发现本试验校准曲线拟合线与参考线重合率极高,表明该预测模型准确可信。见图4、5。
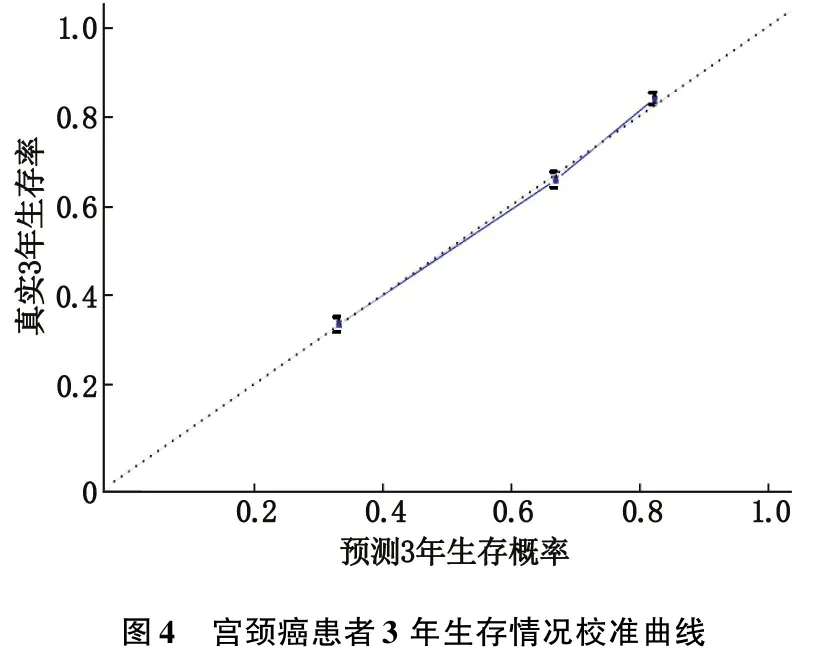
图4 宫颈癌患者3年生存情况校准曲线
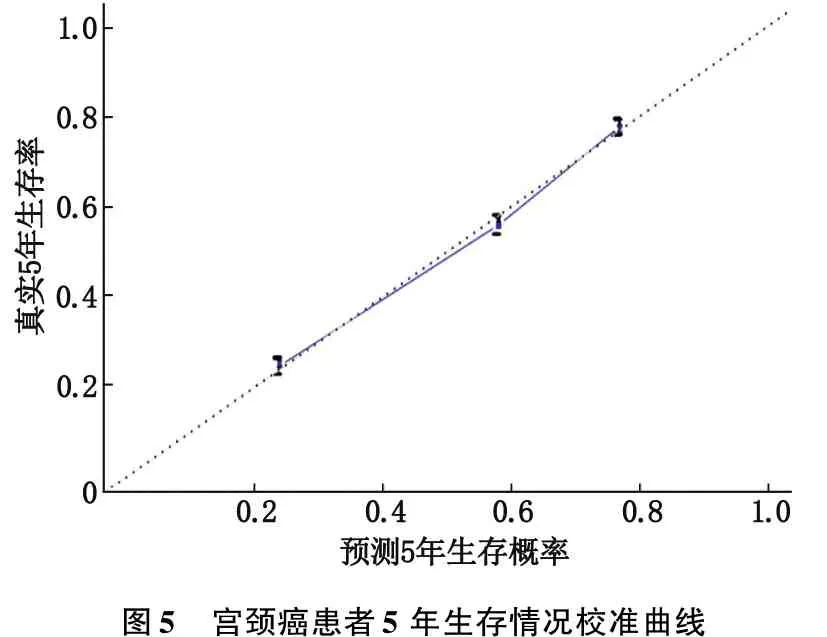
图5 宫颈癌患者5年生存情况校准曲线
2.4 生存分析
对每一个可能影响宫颈癌预后的危险因素即年龄、TNM分期及是否接受放疗进行Kaplan-Meier生存分析。结果显示,与未接受放疗者相比,接受放疗者80个月总体生存率明显较高(图6);TNM Ⅰ~Ⅱ期患者的生存率明显高于Ⅲ~Ⅳ期宫颈癌患者(图7);年龄小的患者生存率高于年龄大的患者(图8),但其中50~<60岁患者与60~<70岁患者生存率相近。
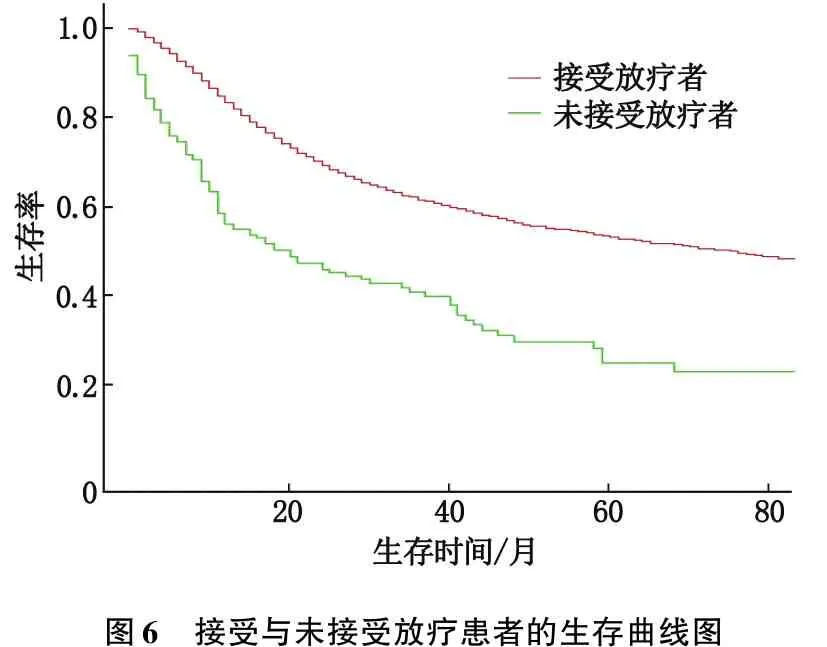
图6 接受与未接受放疗患者的生存曲线图
3 讨 论
宫颈癌为常见的妇科恶性肿瘤之一,手术和放疗是宫颈癌的主要治疗方法,早期以手术治疗为主,中晚期大多采用放射治疗。放射治疗在宫颈癌治疗中具有重要地位,约80%的患者把放射治疗作为宫颈癌单独治疗或综合治疗手段之一[7]。
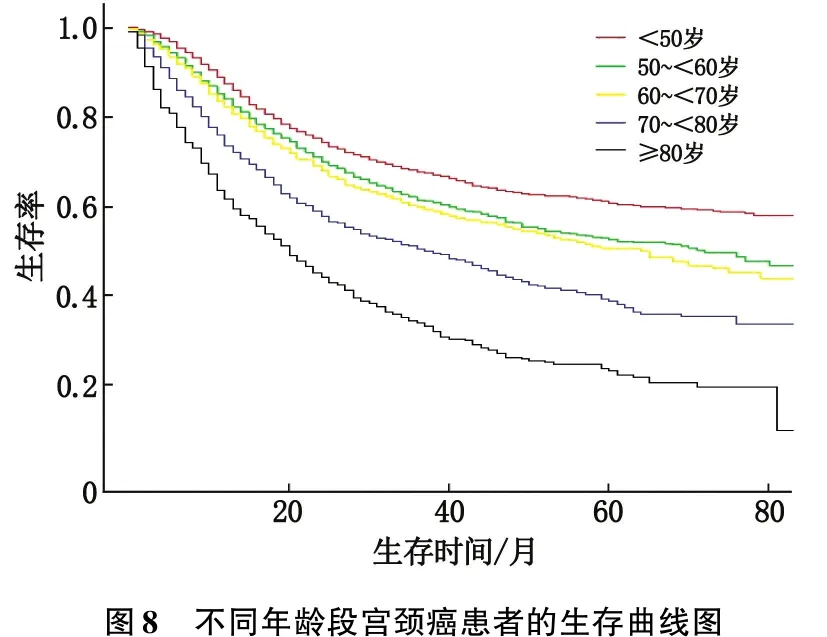
图8 不同年龄段宫颈癌患者的生存曲线图
针对原发灶或转移灶进行放疗可使多种肿瘤患者取得生存获益,包括肾癌、小细胞肺癌、直肠癌[8-11]及脑转移瘤等[12-13]。延长晚期肿瘤患者生存期的主要手段有2种,一方面是通过有效的全身治疗提高肿瘤控制率,降低原发灶肿瘤负荷;另一方面是通过局部放疗产生某些细胞因子,抑制原发及转移灶肿瘤细胞的增殖和转移,即远隔效应[14-15]。
美国国立综合癌症网络(NCCN)指南[16]认为以铂类为基础的同步放化疗是局部晚期宫颈癌的标准治疗方案,虽然尚无高级别证据推荐应用单纯放疗治疗宫颈癌,但研究[17]显示,310例宫颈癌患者采用放疗后症状减轻或消失,生活质量明显改善,3、5年生存率分别达到58.71%和8.71%。Huang K等[18]通过一项基于SEER数据库的大数据研究探讨放射疗法是否对IVb期(M1)宫颈癌患者的生存产生影响,结果显示放疗显著改善了患者的总生存期(OS)(P<0.001,HR=0.69,95%CI为0.62~0.76)和癌症特异性生存率(CSS)(P<0.001,HR=0.79,95%CI为0.70~0.89)。然而,该研究仅分析了放疗对M1期宫颈癌所产生的影响。本研究通过SEER数据库将研究范围延伸至TNM分期,并探讨了不同的临床病理特征对宫颈癌放疗的生存获益影响,结果显示放疗可显著提高患者生存率,年龄及TNM分期也可能成为影响宫颈癌患者总体生存期的重要因素。
在通过SEER数据库得到宫颈癌的独立危险因素后,作者在SEER大数据研究的基础上,建立了具有高可信度的Nomogram预测模型。本研究应用的Nomogram预测模型能够通过整合不同的预后和决定因素,将统计预测模型简化为一个单一的数字,进而得到临床事件的个体概率,满足了作者对生物学和临床集成模型的需求[6]。
本研究中的模型通过评价验证了其可靠性及有效性,在设计治疗方案和评估个人预后方面均具有一定的价值。同时,作者利用已有的临床数据对模型进行反向验证,探讨各类风险因素如何对宫颈癌的生存期产生影响。除年龄较轻及分期较早外,通过生存曲线直接验证了接受放疗是提高宫颈癌生存率的有效条件。
