修饰碳糊电极H2O溶液中BQ对CO2的电化学捕获
2020-06-01金葆康
张 陈,金葆康
(安徽大学 化学化工学院,安徽 合肥 230601)
大气中人类活动产生的CO2被认为是全球气候变化的主要原因之一[1-2].工业革命以来,化石燃料已成为全球经济可持续增长的主要能源和动力.人类对化石燃料的依赖可能会持续到本世纪末,届时化石燃料的剩余储量约100亿吨[3].大量化石燃料的使用不仅带来环境污染,还增加了大气中CO2的浓度,使全球变暖现象严重,温室效应加剧.所以为了降低CO2浓度,许多科研工作者纷纷开展相关研究工作[4-7].
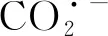
离子液体(ionic liquid,简称IL)具有良好的导电性能和宽的电化学响应范围,应用前景十分广阔[12-16].利用其高黏度和优良溶解性等特点,既可以用作黏合剂,又可充当修饰剂,尤其适合用于修饰化学电极.如Maleki等[17]利用正辛基吡啶六氟磷酸盐(OPPF6)制备修饰电极,提升了电极的电化学响应.
而碳糊电极(carbon paste electrode, 简称CPE)由于其电化学窗口宽、背景电流低、重现性好,制备简易、无毒生物友好性好、价格便宜等,被应用于各个领域[18].自Olson等[19]在1958年报道的最早的CPE以来,电分析者们开始尝试各种方法来制备碳基CPE.而化学修饰碳糊电极(chemically modified carbon paste electrode, 简称CMCPE)更因其具有的优异性能受到广泛研究.区别于CPE,CMCPE就是在制备CPE的同时添加修饰剂,从而赋予电极新功能.化学修饰碳糊电极测定各种无机离子的工作已有相关文献报道[20].笔者利用IL的特性,对CPE进行电化学改性,制备离子液体修饰碳糊电极,利用其作为反应界面,以期实现H2O中BQ对CO2的转化捕获.同时将尝试对CPE和修饰碳糊电极进行现场红外光谱电化学实验,开展其电化学捕获机制研究.
1 实验部分
1.1 试剂与仪器
1-丁基-3-甲基咪唑六氟磷酸盐([BMIM]PF6),纯度99%,林州市科能材料科技有限公司;石墨粉(750~850目),纯度99.95%,麦克林试剂有限公司;切片石蜡,熔点56~58 ℃,阿拉丁试剂有限公司;氯化钾,纯度99.5%,天津市光复精细化工研究所;对苯醌,纯度99%,阿拉丁试剂有限公司;硫酸,纯度95%~98%,国药集团化学试剂有限公司;实验室用水均为二次石英蒸馏水.电化学工作站CHI660D,上海辰华仪器有限公司;傅里叶红外光谱仪iS50,美国Nicolet公司;冷场发射式扫描电镜*/S-4800,日本日立公司;电子分析天平,上海精密科学仪器有限公司;自制碳糊电极管(d=4 mm).
1.2 电极的制备
碳糊电极(CPE)的制备:将石墨粉与切片石蜡(熔融状态)按照质量比2∶1的比例先在小烧杯中混合,再置于玛瑙研钵中充分研磨,得到均匀的碳糊.装入自制的碳糊管(d=4 mm)中压实,电极表面用硫酸纸抛光.
离子液体修饰碳糊电极(CILE)的制备按照质量比(m(C)∶m(石蜡)∶m(IL))=2∶1∶1.38的比例进行混合,其余步骤同CPE相同.
1.3 电化学实验
采用三电极体系开展线性扫描伏安实验,以不同的修饰电极为工作电极,铂丝为对电极,Ag/AgCl为参比电极,自制薄层电化学池[21].溶液为不同浓度BQ的水溶液,支持电解质是0.5 M KCl.扫描电位在0.8~-0.6 V,扫速为10 mV·s-1.所有溶液在测试前均通入15 min N2除氧,再通入1 h CO2得到饱和的CO2溶液.
1.4 现场红外光谱电化学实验
采用现场快速扫描红外光谱电化学技术、液氮低温检测器(MCT/A检测器)、CaF2光窗采集谱图,每张谱图由32张干涉图叠加获得,采样间隔为0.7~1.8 s,分辨率为16 cm-1,得到的三维红外光谱(3D)在OMNIC Software软件中处理.
2 结果与讨论
2.1 电极表征
图1是CPE和CILE电化学阻抗和CV图.
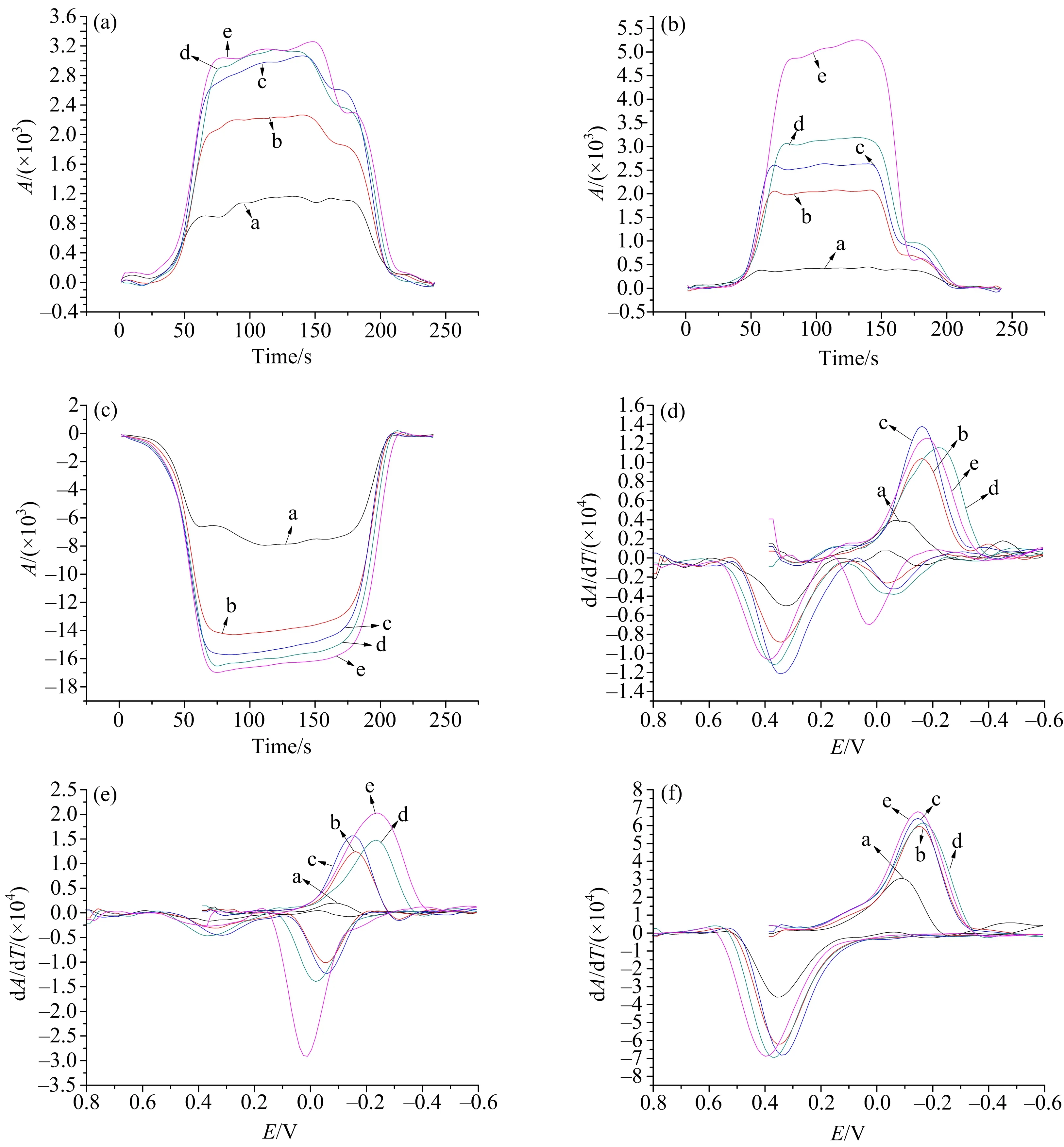
图1(a)是CPE和CILE电化学阻抗图.阻抗图谱中的高频段受动力学控制,低频段受扩散控制.半圆的半径直接表示了电阻的大小,半径越大,电阻越大;半径越小,电阻越小.从图中可以观察到CPE的半径明显大于CILE.Rct代表的是电荷转移电阻,对应的Rct变化是Rct(CILE) 图1(b)是CPE和CILE的CV图.曲线a:Epc=0.129 V,Epa=0.28 V,ΔEp=151 mV.曲线b:Epc=0.147 V,Epa=0.226 V,ΔEp=79 mV.可以看出,ΔE(CPE)>ΔE(CILE).CILE比CPE峰电位差减小了72 mV,还原电位正移,说明IL的加入促进了反应的进行,CILE具有更优的电化学性能.可能是因为IL具有高黏度性和高导电性,使得碳糊电极拥有更好的电极状态和导电性,从而使其电化学性能得到改善. 借助扫描电镜(SEM)可以观察电极表面的微观形貌[22].图2为CPE和CILE的SEM. 图2 CPE和CILE的SEM 观察图2发现,在相同的倍率下, CPE表面是不连续的碳层且不平整,CILE表面较为平整.推测可能是IL的加入,使碳糊的状态得到了改善.表明CILE更适用于光谱电化学研究. 在对CPE和CILE进行电化学表征后,发现CILE拥有更佳的电化学性能,且光滑的电极表面更适用于光谱电化学研究,所以采用CILE作为电化学反应界面在H2O溶液中开展BQ捕获CO2的电化学研究,结果如图3所示. 图3 6 mM BQ在CILE上通和不通CO2以及不含BQ的饱和CO2溶液的循环伏安图(a);饱和CO2溶液中不同浓度BQ溶液在CILE上的CV图(b);扫速为10 mV·s-1 BQ在水中的CV结果如图3(a)所示.图中,曲线a是在不含CO2的6 mM BQ水溶液的CV曲线,曲线b是通入饱和CO2的6 mM BQ水溶液的CV曲线,曲线c是不含BQ的饱和CO2溶液的CV曲线.从曲线a中可以观察到BQ在H2O中只出现一对氧化还原峰,还原峰电位Epc=-0.214 5 V,氧化峰电位Epa=-0.092 3 V, ΔE=122.2 mV.虽然从CV图上仅呈现一对氧化还原峰,但文献[23]利用红外光谱电化学研究发现,BQ的还原过程实际经历两步一电子转移过程,因为两步还原过程电位过于靠近,以致电化学无法分辨,所以CV图呈现一对氧化还原峰,即 BQ+e= BQ-·,BQ-·+e=BQ2-.从曲线b中可观察到,在通入CO2后,BQ的还原电位正移.同时,-0.1 V附近氧化峰峰电流显著降低,而在更正的电位下(0.443 V)出现一个新的氧化峰.曲线c并未观察到明显的法拉第电流,表明实验条件下CO2并不发生还原反应.以上结果表明,CO2的存在促进了BQ的电化学还原;新的氧化峰出现,表明可能存在新物质生成,推测是BQ的还原产物与CO2作用形成的一个[BQ…CO2]2-复合物,即发生了BQ还原产物对CO2的捕获. 为了证实上述猜测,笔者开展了饱和CO2溶液中不同浓度BQ的电化学行为研究,结果如图3(b)所示.图3(b)显示,随着BQ浓度的增加,还原峰C1峰电流呈现出依次递增的趋势,C1对应的氧化峰A1在低浓度时未出现,高浓度时出现,且随BQ浓度增大而增大.新生成的氧化峰A2在低浓度下依次递增,高浓度下基本保持不变.合理的解释是:BQ的电化学还原产物与CO2发生捕获反应,随着BQ浓度的增加,捕获CO2量增多,同时 BQ2-自身氧化峰A1峰消失,而捕获产物的氧化峰A2不断升高;当BQ过量后,CO2完全被捕获,此时A2峰不再增大,与此同时,氧化峰A1出现,且随BQ浓度增大而增大,说明过量的BQ发生电化学还原生成BQ2-.为了更好地理解整个电化学捕获过程,笔者开展了现场红外光谱电化学研究. 图4是饱和CO2溶液中,不同浓度BQ循环伏安同时记录的红外3D图,与图3(b)电化学相对应. 从图4的3D图上可以明显观察到,在低浓度下,BQ的特征吸收峰不能很好地显示出来,随着BQ浓度的增加,吸收峰越来越明显.在低浓度BQ下,仅观察到两个特征吸收峰,2 342 cm-1和1 364 cm-1,它们分别归属于CO2中O=C=O的反对称伸缩振动和[BQ…CO2]2-复合物的伸缩振动;高浓度下,除上述两个特征峰外,还出现2 826,1 495,1 388 cm-13个新的特征峰,分别归属于BQ2-与H2O形成氢键的O-H振动峰,一价阴离子自由基(BQ-·)C=C的伸缩振动和BQ2-/BQH2芳环上的骨架伸缩振动重叠形成的峰[23],以及BQ2-的伸缩振动峰. (a)~(e)中BQ的浓度分别为2,6,8,15,20 mM.图4 CILE电极上不同浓度BQ溶液对应的3D图 图4结果显示,随着BQ浓度的增加,1 388 cm-1峰逐渐呈现,且该峰吸光度随BQ浓度增加而增大,同时高浓度BQ溶液中,1 495 cm-1和2 826 cm-1峰的出现说明BQ2-在还原过程中稳定出现. 红外特征吸收峰归属如表1所示. 表1 红外特征吸收峰归属 基于上述分析,可以利用1 364,1 388,2 342 cm-13个特征吸收峰分别追踪[BQ…CO2]2-,BQ2-,CO2在整个电化学过程的浓度变化.为了更详细地观察不同波数下红外特征吸收峰的变化,分别对图4各浓度的红外3D图进行处理,得到对应的循环伏吸图(CVA)和导数循环伏吸图(DCVA),如图5所示. (a)~(f)中的吸收峰分别位于1 364,1 388,2 342,1 364,1 38 8,2 342 cm-1;曲线a~e中BQ浓度分别为2,6,8,15,20 mM.图5 CILE上不同浓度BQ对应红外吸收峰的CVA图及对应的DCVA图 图5分别是不同BQ浓度下对应的特征吸收峰的CVAs和DCVAs曲线图.在电化学过程中,1 364 cm-1峰的吸光度在低浓度下(以2 mM BQ为例)从25 s(0.25 V)开始升高,至62 s(0.62 V)达到最大值,随后保持不变,随着反应的进行,其吸光度值从180 s(1.8 V)开始下降,至210 s(2.1 V)到最低点;高浓度下(以15 mM BQ为例)吸光度从25 s(0.25 V)开始升高,至72 s(0.72 V)达到最大值,随后保持不变,随着反应的进行,其吸光度值从145 s(1.45 V)开始下降,至171 s(1.71 V)到达另一个平衡,至180 s(1.8 V)开始下降,215 s(2.15 V)到达最低点.1 388 cm-1峰的吸光度在低浓度(2 mM BQ为例)时基本不发生变化;高浓度(15 mM BQ为例)时,吸光度从48 s(0.48 V)开始升高,至75 s(0.75 V)达到最大值,随后一段时间保持不变,随着反应的进行,1 388 cm-1峰的吸光度从148 s(1.48 V)开始下降,至172 s(1.72 V)到达另一个平衡,至187 s(1.87 V)开始下降,至210 s(2.1 V)达到最低点.2 342 cm-1峰的吸光度(15 mM BQ为例),从20 s(0.2 V)开始下降,至70 s(0.7 V)达到最大值,后保持不变,随着反应的进行,吸光度从178 s(1.78 V)开始上升,到210 s(2.1 V)最高点.从CVA曲线结果可以知道,随着扫描时间(电位)的变化,各个红外特征吸收峰回到原始位置. 低浓度BQ溶液中,电化学还原时并未观察到中间体BQ-·特征吸收峰(1 495 cm-1及1 341 cm-1),表明是一价阴离子自由基而不是二价阴离子发生了CO2的捕获作用.结合图5(d)和(f)发现1 364 cm-1及2 342 cm-1对应的DCVA波形与CV图(图3(b))C1/A2一致,表明在电化学还原C1峰处CO2浓度减少速度最快,而BQ还原产物与CO2作用生成速度达到最大.由图5(e)可知,1 388 cm-1峰对应的DCVA波形与CV图C1/A1峰一致,显然高浓度时,过量BQ的第二步电化学还原速度(生成BQ2-的速度)亦在C1峰附近处达最大,由于峰电位接近,故在CV图上仅观察到一个重叠的还原峰,而氧化过程是BQ2-在A1峰处被氧化为BQ. 综上,其电化学捕获CO2机制为 BQ+e=BQ-·, BQ-·+CO2=[BQ…CO2]-·, [BQ…CO2]-·+e=[BQ…CO2]2-. 过量的BQ-·进一步发生还原生成BQ2-. 由于IL的高黏度性和高导电性,使得CILE相比于CPE有更为光滑的电极界表面,且导电性更好,电极界面电子传递速度快,电化学性能更佳.实验采用IL作为修饰剂来制备化学修饰碳糊电极进行H2O溶液中BQ捕获CO2的电化学研究结果表明,当CO2存在时,BQ的还原产物一价阴离子自由基与CO2反应生成[BQ…CO2]-·,随后进一步得到电子生成[BQ…CO2]2-;当BQ量逐渐增大,BQ的还原产物与CO2反应后,过量BQ还原得到2个e生成BQ2-.
2.2 电化学捕获CO2研究



3 结束语
