基于生物信息学分析癫痫相关基因在低级别胶质瘤患者预后中的作用*
2020-05-31梁沛余马晓雨常秀君韩蕙竹夏晓晓解安达
梁沛余,马晓雨,常秀君,韩蕙竹,夏晓晓,解安达,吴 穹#
(1.青海大学医学院,青海 西宁 810001;2.武汉大学基础医学院,湖北 武汉 430000)
目前影响低级别胶质瘤(Low-grade gliomas,LGG)预后的因素不明。有研究显示,仅存在癫痫表现的LGG患者相比于其他临床表现患者具有更高的存活率,术前存在癫痫史患者相比于无癫痫史患者具有更好的临床预后结果[1-2],说明癫痫史可能是影响临床预后的重要因素。对于此现象,有学者从行为决策角度认为癫痫的发作可能会促进患者早期就医而及时获得相关治疗,而头痛、感觉异常等其他神经表现易被忽视[3]。本课题组从肿瘤病理生理角度推测,癫痫史对LGG预后的影响可能依赖于脑肿瘤独特的分子生物学基础,但目前癫痫相关基因在LGG预后中的作用尚不清楚。本研究拟利用生物信息学高通量筛选LGG相关癫痫基因,并通过联合多数据库分析关键癫痫基因对LGG患者预后的影响,并初步探讨其可能作用机理。
1.资料与方法
1.1 资料
GSE32534基因芯片数据[4]获取于NCBI-GEO数据库,是基于GPL570平台的[HG-U133_Plus_2]Affymetrix Human Genome U133 Plus 2.0 Array转录本,种属为人源,芯片样本信息共计10例,其中LGG伴有癫痫样本5例(2例星形细胞瘤,2例神经节神经胶质瘤,1例少突神经胶质瘤)、LGG无癫痫样本5例(1例星形细胞瘤,3例神经节神经胶质瘤,1例少突神经胶质瘤)。本研究选用全部芯片结果。
1.2 方法
1.2.1 LGG癫痫相关基因筛选
用GEO2R算法比对筛选差异基因,以P<0.05且Fold Change>1.5为差异基因筛选标准;下载NCBI-gene、DisGeNET、GeneCards数据库癫痫基因,获取多数据库人癫痫共有基因;将芯片差异基因与多数据库人癫痫共有基因比对,用Bioinformatics & Evolutionary Genomics软件在线绘制Venn图,得到最终的LGG癫痫相关基因。
1.2.2 基因本体论(Gene ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析
将LGG癫痫相关基因上传DAVID数据库(https://david.ncifcrf.gov/home.jsp)进行GO功能分析,分析模块包括生物学过程、细胞成分、分子功能。随后行KEGG通路分析(基因在相关信号的富集情况),以P<0.05表示有统计学意义。
1.2.3 蛋白质互作网络(Protein protein interaction network,PPI network)构建和Hub基因筛选分析
将LGG癫痫相关基因上传STRING数据库(https://string-db.org/cgi/input.pl),构建PPI network,用Cytoscape软件的MCODE插件筛选核心子网模块、CytoHubba插件筛选Hub基因;利用GEIPA数据库(http://gepia.cancer-pku.cn/)对Hub基因在低/高级别胶质瘤的表达情况及基因间表达相关性进行验证。
1.2.4 LGG预后分析
以高级别胶质瘤为对照,利用GEIPA数据库观测Hub基因表达对LGG患者存活率的影响。
1.2.5 免疫细胞浸润分析和经典标志物相关性验证
利用TIMER数据库(https://cistrome.shinyapps.io/timer/)分析Hub基因与LGG中T、B细胞等多种免疫细胞浸润的相关性;挑选相关性最高的免疫细胞,利用LinkedOmics数据库(http://linkedomics.org/login.php)对Hub基因与免疫细胞亚群标志物的相关性做进一步验证。
2.结果
2.1 LGG癫痫相关基因筛选与分析
芯片GSE32534经GEO2R标准化处理后,形成可视化火山图(Epilepsy Vs No epilepsy)(图1A),可获得差异基因1304个(图1B);联合NCBI-Gene、DisGeNET、GeneCards数据库可获得多库人癫痫基因422个,芯片差异基因与422个基因比对可得到LGG癫痫相关基因46个(图1C);对LGG癫痫相关基因GO功能分析发现,其主要富集在关键启动子序列特异性结合、神经递质传递等过程(图1D),对KEGG通路分析显示,其主要富集在细胞外基质受体互作信号、磷脂酰肌醇3-激酶(PI3K)-Akt信号、谷氨酸能突触信号等通路(图1E)。

A.基因芯片火山图;B.差异基因数量;C.癫痫相关基因筛选Venn图;D.GO功能分析图;E.KEGG通路富集分析图
2.2 LGG癫痫相关Hub基因筛选与验证
为探究蛋白互作情况,用STRING数据库构建LGG癫痫相关基因PPI network,发现39个基因节点及101条边所形成如图2A所示的调控网络,内含3个核心子网模块(图2BCD);用CytoHubba插件多算法筛选前10位Hub基因(表1),比对Venn图后发现SYN1、GRIN2B、GRIA2、MAPT、SLC1A2、GRM5、RBFOX3、NRXN1为共有Hub基因(图2E),其主要富集于核心子网1和3,在LGG伴癫痫样本中呈上调趋势(图2F);现认为LGG相比于高级别胶质瘤更易发癫痫[5],Hub基因在低/高级别胶质瘤的表达情况如图2G,其在LGG中存在更高表达,符合易发癫痫趋势;同时,各Hub基因间在LGG中存在不同程度的正向调控作用(图2H),可形成PPI network(图2I)。
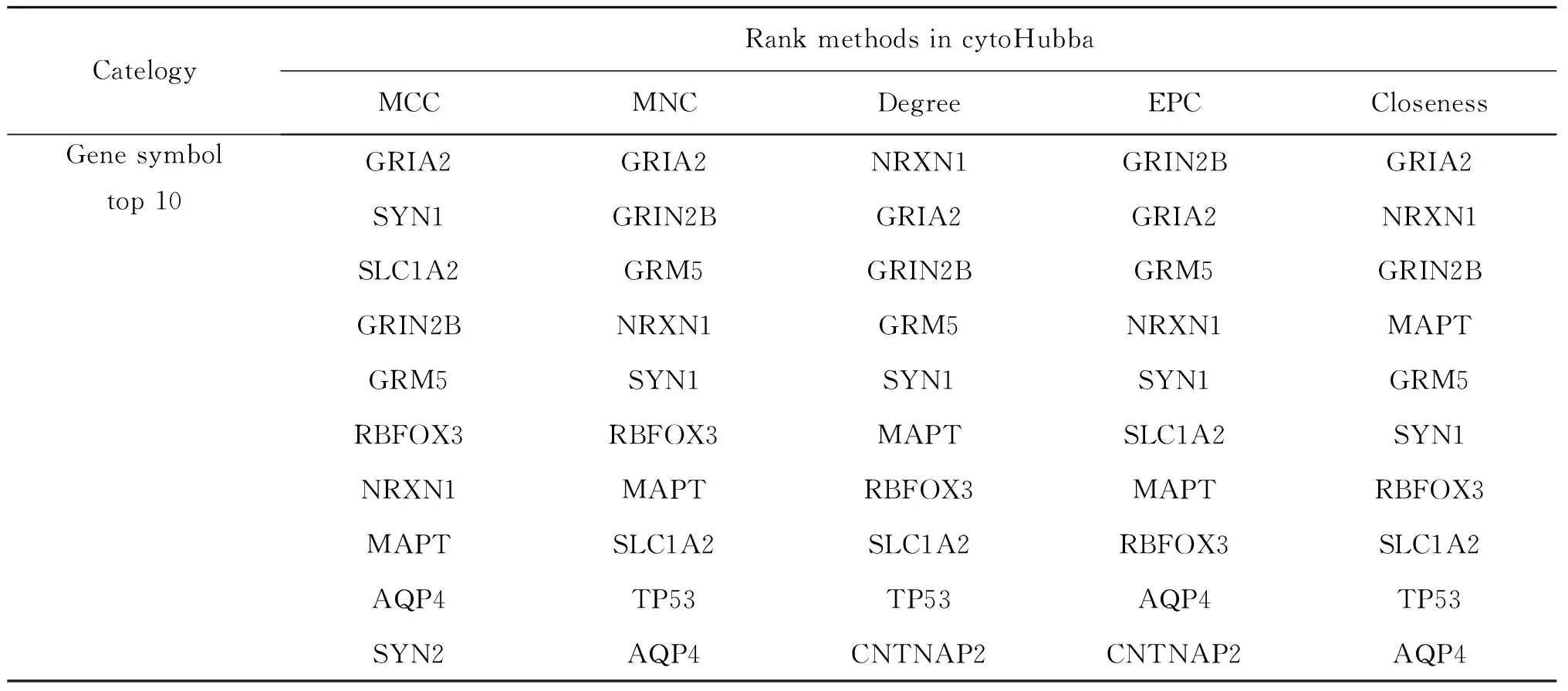
表1 CytoHubba插件筛选候选Hub基因
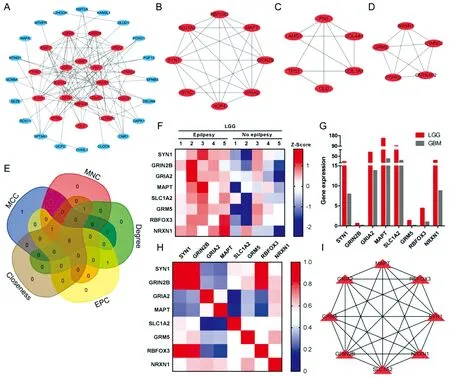
A.LGG癫痫相关基因PPI network;B.核心子网1;C.核心子网2;D.核心子网3;E.多算法筛选Hub基因Venn图;F.芯片Hub基因表达情况;G.不同级别胶质瘤Hub基因表达情况;H.各Hub基因间表达相关性;I.Hub基因PPI network
2.3 LGG癫痫相关Hub基因对LGG患者存活率的影响
利用GEIPA数据库分析各Hub基因表达与LGG患者存活率关系发现,SYN1、GRIN2B、GRIA2、MAPT、GRM5、RBFOX3、NRXN1等七个Hub基因的高表达与LGG患者更高存活率有关,差异有统计学意义(P<0.05),高表达SLC1A2亦呈现存活率提高趋势(图3A);为探究Hub基因影响LGG患者存活率的特异性,通过对照研究分析Hub基因表达与高级别胶质患者存活率的关系,发现其与高级别胶质瘤患者存活率间无显著关联。
2.4 LGG癫痫相关Hub基因与免疫细胞浸润相关性分析
B细胞、CD8+T细胞、CD4+T细胞、中性粒细胞、树突状细胞等多种免疫细胞的浸润程度与LGG患者存活率间呈现显著负相关关系(图4A)。用TIMER数据库分析Hub基因与免疫细胞的浸润相关性发现,八个Hub基因与多种免疫细胞浸润间均存在不同程度的负相关关系,说明Hub基因高表达可能通过影响免疫细胞浸润提高LGG患者存活率。
2.5 LGG癫痫相关Hub基因与免疫细胞亚群浸润相关性分析
Hub基因与CD4+T细胞浸润的相关性最高(图5A);CD4+T细胞不同亚群对肿瘤转归的作用不同甚至相反,Hub基因与CD4+T细胞不同亚群标志物的相关性分析结果显示Hub基因与Treg标志物存在显著负相关关系(图5B),而Treg标志物的上调会恶化LGG患者预后(图5C),说明CD4+T细胞亚群Treg可能在Hub基因调控LGG患者预后过程中发挥重要作用。

A.Hub基因对LGG患者存活率的影响;B.Hub基因对高级别胶质瘤患者存活率的影响

A.不同免疫细胞浸润对LGG患者存活率的影响;B.Hub基因表达与不同免疫细胞浸润的相关性

A.各免疫细胞浸润相关性比较;B.Hub基因与CD4+T细胞亚群标志物的表达相关性;C.细胞亚群标志物表达对LGG患者存活率的影响
3.讨论
LGG在脑胶质瘤中约占成年人的15%、儿童的25%,随着肿瘤的发生发展部分或向高级别胶质瘤恶化,最终可致神经功能障碍甚至死亡,故深入分析LGG预后影响因素对于认识、防控LGG的进展具有重要意义。LGG是致痫性最强的肿瘤之一,癫痫控制亦是肿瘤治疗中的重要组成部分[6]。合并癫痫史的LGG患者相比无癫痫患者有着更高的生存率[2],提示癫痫发生可能影响LGG患者预后,但其分子生物学机制尚不清楚。本研究利用生物信息学方法探究癫痫关键基因与LGG患者预后之间的关系,并初步分析其与多种免疫细胞及亚群浸润的相关性。
我们的研究结果显示,LGG癫痫的发生与神经递质传递、轴突延伸的正向调控等生物学过程,谷氨酸能突触信号等通路关系密切。既往研究显示,LGG并发癫痫与肿瘤类型、部位、病理分级等有关[7],脑肿瘤向四周侵袭增殖过程中需伴随谷氨酸的浓度提升,谷氨酸可引起皮层兴奋性增高,γ-氨基丁酸的失平衡会导致神经元、肿瘤细胞转运蛋白改变,提高胞外钾离子浓度,最终诱发癫痫发作[5],与我们的研究结果相符。PI3K-Akt信号是胶质瘤进展的关键通路,其活化可促进肿瘤细胞的增殖、分裂,并上调Bcl-2等蛋白发挥抑制细胞凋亡作用,加速肿瘤向周围的浸润、侵袭和转移[8];而在癫痫模型中PI3K-Akt信号呈抑制状态,如大麻素受体等分子可通过促进PI3K-Akt信号的活化改善星形胶质细胞的增殖活性发挥抗癫痫作用[9]。在本研究中,我们发现伴有癫痫相比于不伴有癫痫LGG患者PI3K-Akt信号相关蛋白呈现下调趋势,提示癫痫发生可能通过作用PI3K-Akt通路抑制肿瘤进一步进展,从而改善LGG患者预后。
免疫细胞浸润在脑肿瘤发生发展中起着举足轻重的作用,经数据库分析我们发现B细胞、T细胞、巨噬细胞、中性粒细胞、树突状细胞等多种免疫细胞浸润与LGG患者的较差预后有关。目前认为,Treg介导的免疫抑制是肿瘤发生免疫耐受和逃逸的重要机制[10],Treg可通过以下途径发挥功能:(1)利用表面CTLA-4与靶细胞受体相互作用,抑制效应T细胞对肿瘤的杀伤;(2)分泌大量免疫抑制分子如IL-10、TGF-β等,抑制相关免疫效应细胞杀伤清除能力;(3)影响抗原提呈细胞的抗原提呈功能;(4)抑制免疫效应细胞在肿瘤微环境的聚集。实验研究显示,Treg随着脑胶质瘤的恶性程度增高及复发率显著提升而影响预后,清除Treg能明显抑制肿瘤生长[11],这些结果提示癫痫的发生可能通过相关基因抑制Treg的浸润,改善肿瘤微环境,提高LGG患者存活率。
综上所述,本研究利用生物信息学探究了癫痫发生影响LGG患者预后的可能分子调控机制,并筛选出SYN1、GRIN2B、GRIA2、MAPT、SLC1A2、GRM5、RBFOX3、NRXN1等八个与LGG患者预后相关的癫痫关键基因,为丰富LGG预后分子调控机制提供了一定的研究依据。但由于脑肿瘤信号功能转导的复杂性,其具体分子调控过程仍有待进一步深入研究。
