miR-197-3p调控DMBT1抑制甲状腺癌细胞系增殖、迁移和侵袭
2020-05-30曹邓晗陈奎生
曹邓晗,陈奎生
(1.郑州市第一人民医院 内分泌科,河南 郑州 450004; 2.郑州大学第一附属医院 病理科,河南 郑州 450052)
microRNAs(miRNAs)是人类基因组中一类调控细胞增殖、分化、凋亡和转移的重要小RNA分子,通过与其靶基因的3′UTR区特异性结合抑制或激活靶基因转录后表达而发挥作用[1]。miR-197在不同癌中发挥着重要的致癌基因或抗癌基因作用,是一种潜在的新型癌生物标志物[2]。甲状腺癌患者血清中miR-197的升高与肿瘤TNM分期和淋巴结转移有关[3]。但miR-197对甲状腺癌细胞增殖、迁移和侵袭的影响及其机制还不清楚。
恶性脑瘤缺失1基因(deleted in malignant brain tumors 1,DMBT1)是近年来新发现的一种抑癌基因,其在甲状腺癌、鼻咽癌和胆道癌等肿瘤组织中表达缺失,与肿瘤分化、淋巴结转移、侵袭、转移及不良预后有关[4-6]。本文探讨,miR-197-3p和DMBT1对甲状腺癌细胞增殖、迁移和侵袭的影响及其作用机制。
1 材料与方法
1.1 材料
1.1.1 细胞系:正常甲状腺细胞系Nthy-ori 3-1和甲状腺癌细胞系SW579及CGTHW-1(中国科学院上海生命科学研究院细胞资源中心)。
1.1.2 主要试剂:胎牛血清和DMEM培养基(HyClone公司);Trizol试剂(Invitrogen公司);LipofectamineTM2000试剂和MTT溶液(Solarbio公司);RIPA裂解液(上海碧云天生物科技研究所);康宁Transwell小室(北京优尼康生物科技有限公司);miR-197-3p抑制物(miR-197-3p inhibitor)及其无意义对照(inhibitor nosense control)、miR-197-3p模拟物(miR-197-3p mimics)及其无意义对照(mimics nosense controlpc)和小干扰RNA(siRNA)无意义序列及siRNA-DMBT1(广州锐博生物科技有限公司);pcDNA3.1空载体及pcDNA3.1-DMBT1(湖南丰晖生物科技有限公司);实验用蛋白抗体及相应二抗(武汉博士德生物工程有限公司)。
1.2 方法
1.2.1 细胞的培养:将Nthy-ori 3-1、SW579及CGTHW-1细胞接种于含10%胎牛血清的DMEM培养液中,放置于37 ℃、5%CO2培养箱中培养,待细胞接近90%汇合时,加入0.25%胰蛋白酶消化细胞5 min左右,进行传代培养。
1.2.2 RT-qPCR检测细胞中miR-197-3p表达水平:收集对数期的Nthy-ori 3-1、SW579和CGTHW-1细胞,使用Trizol试剂提取细胞总RNA,紫外分光光度计检测RNA样品A260/A280比值为1.8~2.0,琼脂糖凝胶电泳检测RNA样品出现3条完整条带,表示RNA样品纯度和完整性符合实验要求。以RNA为模板进行反转录反应合成cDNA,以U6为内参基因进行qPCR反应。采用2-△△Ct法计算miR-197-3p相对表达量。
1.2.3 细胞的分组及转染:收集对数期的SW579细胞,用DMEM完全培养液重悬细胞制成单细胞悬液,将细胞以1×106个/孔接种于6孔板中,放于培养箱中培养至细胞汇合度达70%左右,使用LipofectamineTM2000试剂将miR-197-3p inhibitor及inhibitor nosense control、pcDNA3.1及pcDNA3.1-DMBT1分别转染SW579细胞,并分别记为anti-miR-NC组、anti-miR-197-3p组、pcDNA3.1组、pcDNA3.1-DMBT1组,另将miR-197-3p inhibitor分别与siRNA-DMBT1、siRNA nosense control转染SW579细胞并记为anti-miR-197-3p+si-DMBT1组、anti-miR-197-3p+si-NC组,转染24 h后荧光显微镜下观察转染效果。
1.2.4 MTT法检测细胞增殖:取转染的各组SW579细胞,以2×104个/孔接种于96孔板中,每组细胞设置5个重复孔,放于培养箱中培养,分别于培养24、48和72 h时,每孔加入5 g/L的MTT溶液20 μL继续培养4 h后,吸出孔内上清液并加入150 μL二甲基亚砜溶液振荡孵育15 min左右。酶标仪在490 nm波长处检测每孔的吸光度值(A值)。
1.2.5 Transwell小室法检测细胞迁移和侵袭:取瞬时转染的各组SW579细胞,用无血清DMEM培养液重悬并调整细胞密度为2×105个/mL。在transwell小室的下室中加入600 μL DMEM完全培养基,另取150 μL细胞悬液加入上室,培养24 h后,取出小室并吸去上室液体,室温下加入甲醇固定30 min,然后在Giemsa染色液中染色15~30 min,清水冲洗小室并用棉签轻轻擦去上室表面细胞,显微镜下随机选取5个视野区(×200)计数细胞迁移数目;另取Transwell小室,在下室中加入100 μL Matrigel基质胶和无血清DMEM培养基混合液(1∶5),上室中加入50 μL Matrigel基质胶并接种50 μL细胞悬液,培养24 h后取出小室,4 ℃下加入5%戊二醛固定,然后加入0.1%结晶紫染色,显微镜下随机选取5个视野区(×200)计数细胞迁移数目。
1.2.6 Western blot检测DMBT1、cyclinD1、p21、MMP-2和E-cadherin蛋白表达:收集转染的各组SW579细胞,加入RIPA裂解液提取细胞总蛋白,取适量蛋白样品与1×SDS上样缓冲液按体积比1∶5混合均匀,放入沸水中5 min使蛋白变性。室温下冷却后,进行10% SDS-聚丙烯酰胺凝胶电泳及转膜,封闭液中封膜1 h。洗膜,加入稀释的DMBT1、cyclinD1、p21、MMP-2、E-cadherin和GAPDH抗体一抗4 ℃过夜孵育,洗膜后加入辣根光氧化酶标记的二抗室温轻摇2 h。加入ECL化学发光液中显影,放入Gel-Pro凝胶成像系统中曝光、拍照,以GAPDH蛋白条带为对照分析目的蛋白相对表达量。
1.2.7 双荧光素酶报告基因检测miR-197-3p和DMBT1的靶向关系:构建双荧光素酶报告基因DMBT1的3′UTR区及突变后的3′UTR区载体,分别与miR-197-3p mimics、mimics nosense control共转染SW579细胞,48 h后收获细胞并检测细胞中荧光素酶活性。
1.3 统计学分析
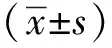
2 结果
2.1 miR-197-3p在Nthy-ori 3-1、SW579和CGTHW-1细胞中的表达
与正常甲状腺细胞Nthy-ori 3-1比较,甲状腺癌细胞SW579及CGTHW-1中miR-197-3p相对表达量明显升高(P<0.05)(图1)。

*P<0.05 compared with Nthy-ori 3-1 group图1 miR-197-3p在Nthy-ori 3-1、SW579、 CGTHW-1细胞中的表达Fig 1 Expression of miR-197-3p in Nthy-ori 3-1, SW579 and CGTHW-1
2.2 抑制miR-197-3p对SW579细胞增殖、迁移和侵袭的影响
与anti-miR-NC组比较,anti-miR-197-3p组SW579细胞中miR-197-3p相对表达量降低(P<0.05)(图2A),培养48和72 h时细胞增殖活性降低(P<0.05)(图2B),细胞迁移和侵袭数目明显减少(P<0.05)(图2C),细胞中cyclin D1蛋白和MMP-2蛋白表达降低而p21蛋白和E-cadherin蛋白表达升高(P<0.05)(图2D)。
2.3 miR-197-3p靶向调控DMBT1
miR-197-3p能够与DMBT1的3′UTR区互补结合(图3A);双荧光素酶报告基因实验结果表明(图3B),过表达miR-197-3p明显抑制SW579细胞中DMBT1的转录活性,将DMBT1的3′UTR区突变后miR-197-3p的抑制作用消失;与miR-NC组比较,miR-197-3p组SW579细胞中DMBT1蛋白表达降低(P<0.05),与anti-miR-NC组比较,anti-miR-197-3p组SW579细胞中DMBT1蛋白表达升高(P<0.05)(图3C)。
2.4 过表达DMBT1对SW579细胞增殖、迁移和侵袭的影响
与pcDNA3.1组比较,pcDNA3.1-DMBT1组SW579细胞中DMBT1蛋白表达升高(P<0.05)(图4C),培养48和72 h时细胞增殖活性降低(P<0.05)(图4A),细胞迁移和侵袭数目减少(P<0.05)(图4B),细胞中cyclinD1蛋白和MMP-2蛋白表达降低而p21蛋白和E-cadherin蛋白表达升高(P<0.05)(图4C)。

A.relative expression of miR-197-3p was detected by RT-qPCR; B.proliferation activity was detected by MTT assay; C.cell migration and invasion were detected by Transwell chamber assay; D.relative expression of cyclin D1, p21, E-cadherin and MMP-2 protein was detected by Western blot;*P<0.05 compared with anti-miR-NC group


A.miR-197-3p bound to the 3′UTR targeting ofDMBT1; B.double luciferase reporting experiment; C.relative expression ofDMBT1 protein was detected by Western blot;*P<0.05 compared with miR-NC group;#P<0.05 compared with anti-miR-NC group

2.5 抑制DMBT1能逆转miR-197-3p对SW579细胞增殖、迁移和侵袭的影响
与anti-miR-197-3p+si-NC组比较,anti-miR-197-3p+si-DMBT1组细胞中DMBT1蛋白表达降低(P<0.05)(图5C),培养48和72 h时细胞增殖活性增强(P<0.05)(图5A),细胞迁移和侵袭数目增多(P<0.05)(图5B),细胞中cyclinD1蛋白和MMP-2蛋白表达升高而p21蛋白和E-cadherin蛋白表达降低(P<0.05)(图5C)。
3 讨论
miRNA作为抑瘤或促瘤因子及细胞中关键调节因子参与肿瘤恶性进展的研究越来越多,为肿瘤靶向治疗提供了新途径[7-8]。miR-197-3p作为一种重要的miRNA,在膀胱癌、肺癌及骨肉瘤等肿瘤的发生发展中起促进作用[9-11]。本研究发现,miR-197-3p在甲状腺癌细胞SW579和CGTHW-1中均呈高表达;抑制miR-197-3p后甲状腺癌细胞SW579中cyclinD1蛋白和MMP-2蛋白表达降低;p21蛋白和E-cadherin蛋白表达升高;细胞增殖、迁移和侵袭能力降低。说明miR-197-3p异常表达与甲状腺癌增殖、迁移和侵袭密切相关。
DMBT1定位于人染色体10q26.13,其编码一种多功能的大分子糖蛋白,可通过介导蛋白质间相互作用发挥促进上皮分化及保护黏膜等多种生理作用[12]。本研究发现miR-197-3p可与DMBT1的3′UTR区互补结合,并证实在甲状腺癌SW579细胞中miR-197-3p靶向负调控DMBT1的表达。过表达DMBT1的鼻咽癌细胞增殖能力显著降低,细胞凋亡率增加,细胞对化疗药物敏感性增强[13]。提示DMBT1具有抑癌作用。本研究利用表达DMBT1转染的SW579细胞,发现细胞增殖、迁移和侵袭明显降低,说明DMBT1在甲状腺癌中也发挥抑癌作用。为证实miR-197-3p对甲状腺癌细胞生物学行为的影响是否与靶向DMBT1有关,本研究构建同时抑制DMBT1和miR-197-3p表达,SW579细胞,发现同时抑制DMBT1和miR-197-3p表达的SW579细胞增殖、 迁移和侵袭均明显增强,说明抑制DMBT1表达逆转了抑制miR-197-3p对SW579细胞增殖、迁移和侵袭的抑制作用。证实miR-197-3p对甲状腺癌细胞增殖、迁移和侵袭的影响与靶向DMBT1有关。

A.cell proliferation activity was detected by MTT assay; B.cell migration and invasion were detected by Transwell chamber assay; C.relative expression of DMBT1, cyclin D1, p21, E-cadherin and MMP-2 protein was detected by Western blot;*P<0.05 compared with pcDNA3.1 group


A.cell proliferation activity was detected by MMT assay; B.cell migration and invasion were detected by Transwell chamber assay; C.relative expression of DMBT1, cyclin D1, p21, E-cadherin and MMP-2 protein was detected by Western blot;*P<0.05 compared with anti-miR-NC group;#P<0.05 compared with anti-miR-197-3p+si-NC group
图5 抑制DMBT1能逆转miR-197-3p对SW579细胞增殖、迁移和侵袭的影响

综上所述,miR-197-3p在甲状腺癌细胞中高表达,干扰miR-197-3p可通过靶向调控DMBT1的表达抑制甲状腺癌细胞增殖、迁移和侵袭。本研究为miR-197-3p在甲状腺癌靶向治疗中的应用提供了实验依据。
